酶酸结合法降解植物纤维素新工艺
2011-08-09赵永亮侯启昌杨霞王卫国崔羽佳李鹏郭家瑞张鹏丁金聚
赵永亮,侯启昌,杨霞,王卫国,崔羽佳,李鹏,郭家瑞,张鹏,丁金聚
(1.河南工业大学 生物工程学院,河南 郑州,450001;2.河南广播电视大学 农医学院,河南 郑州,450008;3.河南职业技术学院 食品系,河南 郑州,450004)
纤维素是地球上最丰富的资源。仅在农业生产中,我国每年形成的秸杆就有8亿t左右;在工业生产中,还有数百万吨纤维素废弃物。这些纤维素资源既没有得到充分利用,又污染环境。纤维素降解后得到的葡萄糖可作为酿造、制药、饲料等许多产业部门的原料,可替代这些行业每年消耗掉的数千万吨粮食。据报道,全世界46亿人中有6亿人处于饥饿状态,因此,进行植物纤维降解研究,把其转化成可供微生物、动物和人直接利用的原料或制造生物能源的原料,不仅可以缓解和解决“人与工业争粮”、“人与牲畜争粮”、能源危机的根本矛盾,而且对于我们这个可耕地日益减少、人口日益增多的大国来说,更具有重要的战略意义。虽然国内外对降解植物纤维的研究较多[1−4],但大多从微生物[5−8]或酶[9−11]的角度进行。由于酶的分解代谢物或终产物的抑制性、酶的不稳定性使得这类方法难以推广,已报道的其他方法如美国专利[12]也因条件苛刻(160~230 ℃)、成本高而难以应用,酶酸结合法降解植物纤维素的文献报道甚少。文献[13]比较了在酸或酶的作用下纤维素的部分(不完全)降解特性。文献[14]则探讨了以甘蔗渣为材料用醋酸预处理后酶的降解效果。文献[13−14]也均未对酶酸循环利用降解纤维素进行进一步研究。在此,本文作者通过反复试验与探索,找到了一种条件温和、工艺简单、成本低、周期短的降解植物纤维素工艺(纤维素酶酸循环降解法(CDCA法)),可为发酵工业上以纤维素为原料从事乙醇、抗生素、SCP(Single cell protein)等产品的开发生产及环保上固态生活垃圾的生物处理提供科学依据。
1 材料及方法
1.1 材料
材料为:麦秸,乙酸(AR),冰乙酸(AR),盐酸(AR),硫酸(AR),硝酸(AR),NaOH(AR),Na2S(AR),羧甲基纤维素,醋酸钠(AR),纤维素酶,乙醇(AR)等。
1.2 方法
1.2.1 原料的预处理
根据工艺要求秤取一定量的干麦秸粒度粉碎至小米粒般大小。将粉碎后的原料用 8%(质量分数,下同)NaOH+Na2S煮沸1 h,以除去部分木质素和半纤维素。麦秸原料中纤维素含量为 44.9%,预处理后的材料中的水分含量为10.6%,纤维素含量为66.8%。
采用烘干失重法[15]测定原料中的水分含量;采用硝酸−乙醇法[16]测定纤维素的含量。
1.2.2 纤维素酶活力的测定
采用CMC液化力法[17]并略作改进。取2.5 mL适当稀释的酶液,加2.5 mL 0.2 mol/L醋酸缓冲液(pH为5.0)和5 mL 1% CMC溶液,于30 ℃反应10 min。用奥氏黏度计法[18]测定反应前后样液的比黏度,按下式计算CMC酶活力:
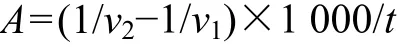
其中:A为CMC酶活力;v1为反应前比黏度;v2为反应后比黏度;t为反应时间。
1.2.3 还原糖含量的测定
采用斐林氏氧化−还原定糖法[19]测定还原糖含量。按下式计算纤维素转化为葡萄糖的转化率η:
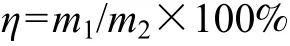
其中:η为纤维素转化为葡萄糖的转化率;m1为葡萄糖质量;m2为原始纤维素总质量。
1.2.4 酶酸结合法降解植物纤维素的试验方案
软文化包括适合学生的电影、电视、书刊杂志、网络信息等丰富的教学资源,给学生提供贴近学生实际、贴近生活、贴近时代的内容和丰富的课堂内容。这些软文化能够拓展学习和运用英语的渠道,使得知识融会贯通。
以混酸法[20]及短时单酶法[21]降解植物纤维素的最佳结果为基础,并考虑酸、酶添加顺序的影响,设计了酶酸结合法降解植物纤维素的2个试验方案。方案1:先酸解后酶解;方案2:先酶解后酸解。具体试验方案见表1、表2和图1。在考虑多因素影响的前提下,以上述2个试验方案的最佳结果为基础,又进一步设计出一种酶酸循环降解法(CDCA法)。取 500 g预处理的麦秸按序依次置于 5 L反应器中,先添加0.2%的纤维素酶和1 L水,于50 ℃反应2 h 以备后用。其他所需反应剂按表3中的要求添加至反应器中。
1.2.5 数据处理方法
所有试验结果均取3次重复试验的平均值。采用方差分析法对试验结果进行统计学分析,用F值检验判断组间差异有无显著性[22]。
2 结果与讨论
2.1 先酸解后酶解在纤维素糖化中的作用
先酸解后酶解的具体试验方案设计出2套,其详细的降解条件、试验程序及纤维素转化为葡萄糖的转化率见表1。
从表1可以看出:当依次加入 CH3COOH,HCl和纤维素酶时,纤维素转化为葡萄糖的转化率(R)为69.5% (F>F0.01,p<0.01,这表示该结果经过方差分析,具有极显著性,其置信度达99%),降解终产物中葡萄糖的最高含量达1.28% (F>F0.01,p<0.01);而当CH3COOH和HCl同时加入、再加入纤维素酶时,纤维素转化为葡萄糖的转化率(R)则为65.4% (F>F0.01,p<0.01),降解终产物中葡萄糖的最高含量为1.15% (F>F0.01,p<0.01,这表示该结果经过方差分析,具有极显著性,其置信度达99%)。葡萄糖的转化率和终糖含量均降低。
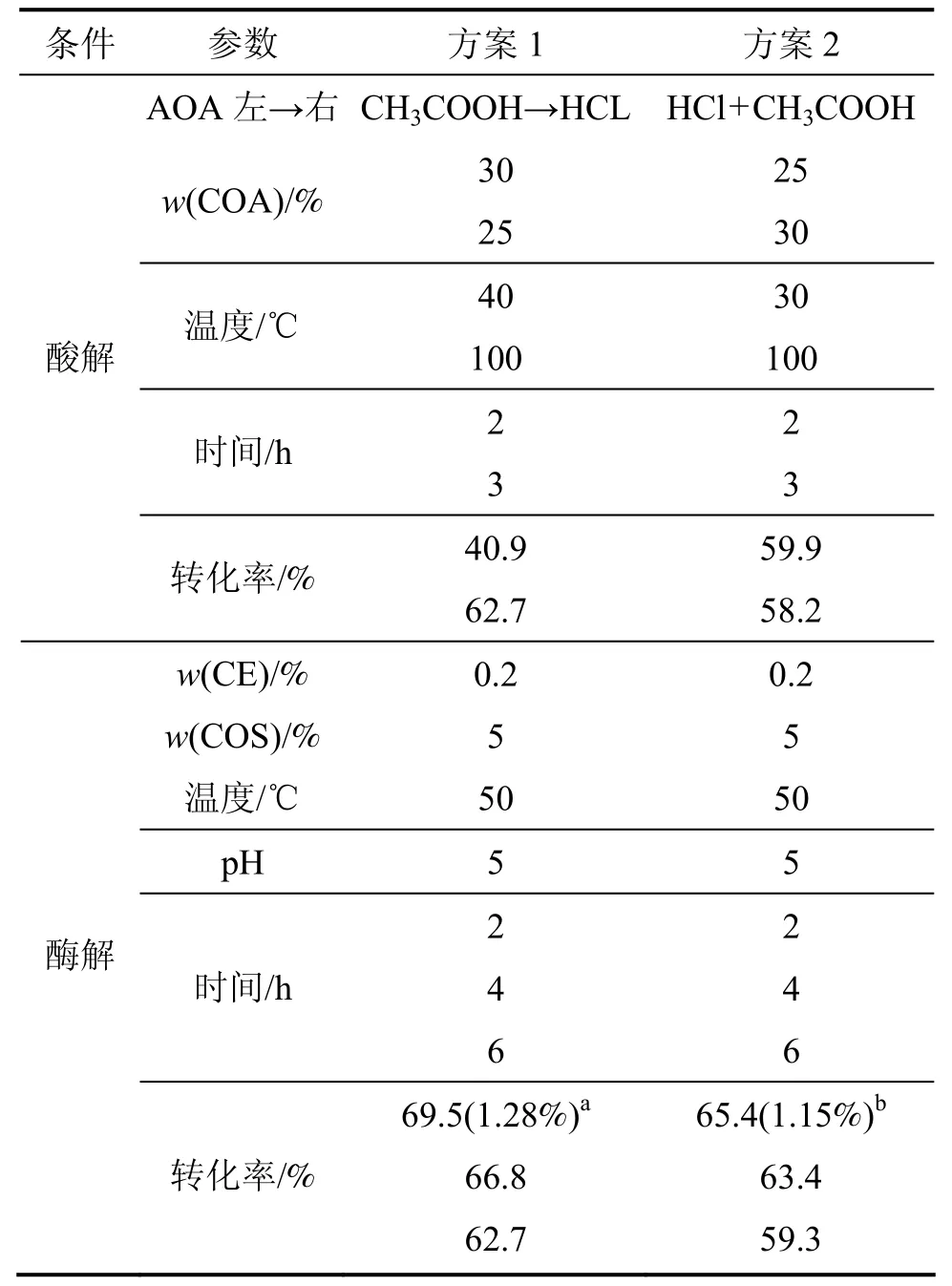
表1 先酸解后酶解的具体试验方案及纤维素转化为葡萄糖的转化率Table1 Experimental procedures and transformation rate of cellulose to glucose by enzyme-lyses after acids-lyses
从表1还可以看出:不管酸是依次加入还是同时加入,随着酶反应时间的延长,纤维素转化为葡萄糖的转化率(R)呈下降趋势。多次实践证明:酸反应后的溶液不太适合酶反应的进行,而且酶反应时间越长,其副作用也越大。
2.2 先酶解后酸解在纤维素糖化中的作用
先酶解后酸解的具体试验方案也设计出2套,其详细的降解条件、试验程序及纤维素转化为葡萄糖的转化率见表2。

表2 先酶解后酸解的具体试验方案及纤维素转化为葡萄糖的转化率Table2 Experimental procedures and transformation rate of cellulose to glucose by enzyme-lyses followed by acids-lyses
从表1和表2还可以看出:先酶解后酸解试验方案优于先酸解后酶解试验方案;在CH3COOH和HCl依次和同时加入反应体系的条件下,先酶解后酸解试验方案的转化率R分别比先酸解后酶解试验方案的R提高 29.0%和 16.1%。其原因可能是:当纤维素酶首次投入应用时,酶反应的最佳条件容易实现;纤维素酶能裂解纤维素晶体,以利于纤维素分子易于接触水和酸,进而把纤维素分子分解为大量的纤维二糖和纤维三糖;纤维二糖和纤维三糖在酸性条件下,很容易被降解成葡萄糖,使纤维素转化为葡萄糖的转化率(R)大幅度提高。如果采用先酸解后酶解试验方案,虽然第1步酸解后,R即可达60%左右,但由于反应产生的大量副产物影响了酶活性的发挥,所以,R的增加量不大。副产物的存在不仅会影响酶活性的发挥,而且随着副产物的大量增多,R趋于下降。R降低的原因可能是:在酸作用下,葡萄糖降解产生了其他副产物。
2.3 纤维素酶酸循环降解(CDCA)方案及工艺流程
虽然先酶解后酸解试验方案工艺能使纤维素转化为葡萄糖的转化率高达91.7% (F>F0.01,p<0.01),但是,因为麦秸原料非常蓬松,体积大,单次降解的底物质量分数最多只能达5%左右,这样,使得终产物葡萄糖的含量太低而难以应用。为此,本研究设计出一种纤维素酶酸循环降解(CDCA)方案,其工艺流程见图1。
从图1可以看出:纤维素酶酸循环降解(CDCA)方案系统非常简单,它仅由1个总反应器、1个副反应器、3个酶反应器和3个酸储罐组成。整个工艺流程仅需5套装备、3套反应器和2套储罐。
2.4 纤维素酶酸循环降解工艺(CDCA)的操作程序、转化率及终糖含量
纤维素酶酸循环降解工艺(CDCA)的操作程序、反应条件、纤维素转化为葡萄糖的转化率、反应每步降解物中葡萄糖的含量及降解终产物中葡萄糖的含量见表3。
由表3及图1可以看出:酶酸结合的纤维素连续循环降解法不仅步骤少,耗时短,而且具有较高的转化率和终糖含量,可使纤维素转化为葡萄糖的转化率R达98.68%(F>F0.01,p<0.01),终产品中葡萄糖的终糖含量达5.38% (F>F0.01,p<0.01)。表3中最后2列数据显示:当纤维素转化率为 89.8%时,葡萄糖含量为2.85%;当纤维素转化率为98.68%时,葡萄糖含量即可达到5.38%,纤维素转化率增幅不到10%,葡萄糖含量增幅却可达到89%。其原因主要是本研究采用了纤维素连续循环降解方案,该方案能大幅度提高底物纤维素的添加量或消耗量。从理论上说,纤维素转化率为 98.68%时已接近高限理论值,要再提高很困难,而产物葡萄糖的含量则会随着底物消耗量的明显增大而快速提高。多数工业发酵产品生产的培养基中仅需 3%左右的葡萄糖,因此,本研究的终产物经适当调节 pH和复合配制即可直接用做乙醇、抗生素、单细胞蛋白等发酵法生产的原料。本降解方法亦可用于生活垃圾等固态废弃物的生物处理。
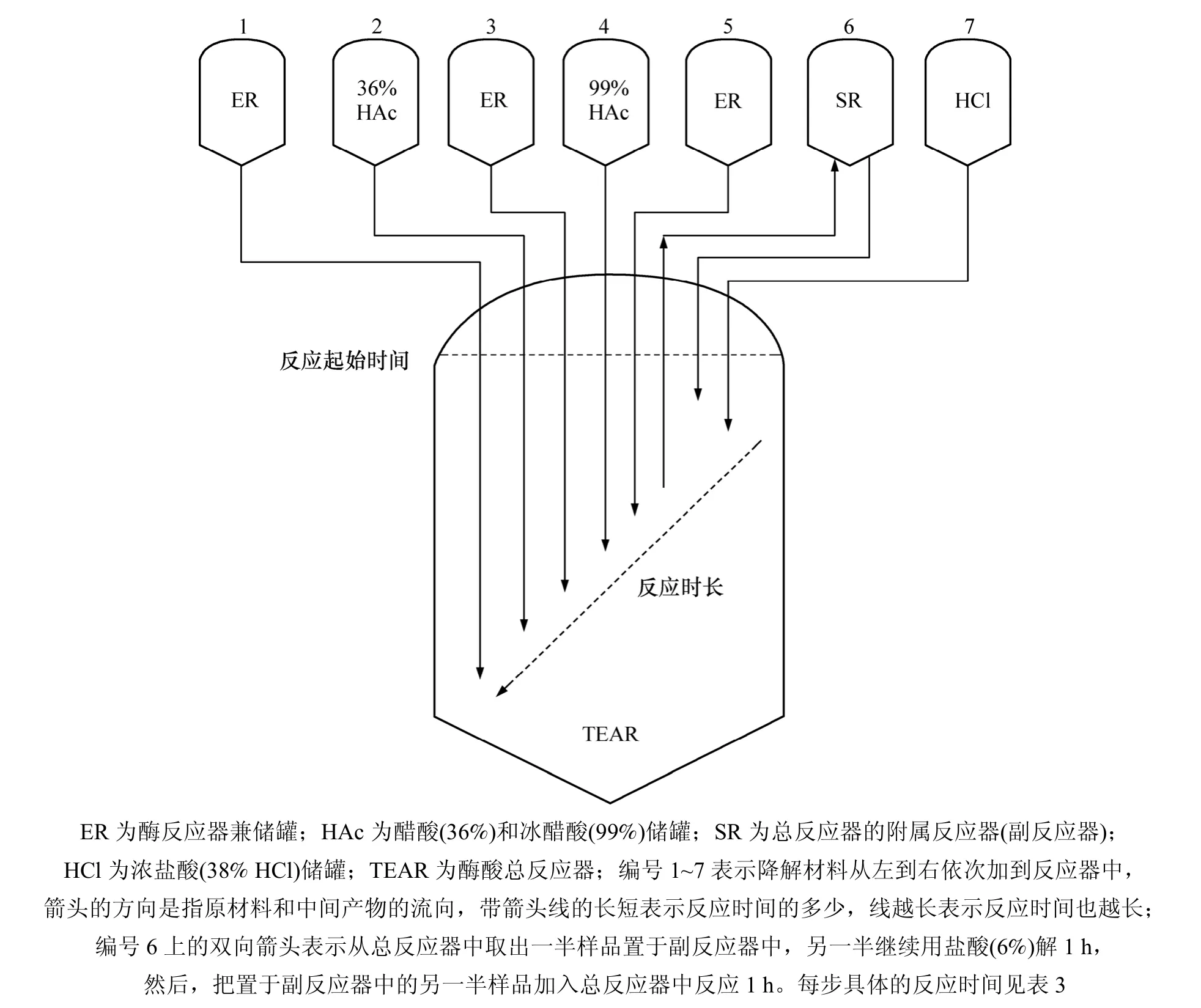
图1 纤维素酶酸循环降解(CDCA)方案及工艺流程Fig.1 Schematic flow diagram of CDCA for production of glucose with cellulose

表3 CDCA的操作程序、反应条件、纤维素转化为葡萄糖的转化率及糖含量Table3 Operating procedures and reaction conditions, transformation ratio of glucose from cellulose and percentage of glucose by CDCA
酶酸结合的纤维素连续循环降解法的操作条件相当温和。其反应温度不超过100 ℃,所需压力低于100 kPa,而文献[12]中需要高温高压。与传统的纤维素酶解需24 h以上相比,该方法的全生产周期可缩短至15 h之内。酶酸结合的纤维素连续循环降解法的工艺过程也比较短,整个过程仅需操作9步,整个系统所需反应器不超过7套。
酶酸结合的纤维素连续循环降解法能使终降解物中葡萄糖的终含量达5.38% (F>F0.01,p<0.01)。虽然本研究方案2在7 h内能使R达91.7% (F>F0.01,p<0.01),但终糖含量只有 2.93% (F>F0.01,p<0.01)。与文献[1, 2, 7, 8]的报道相比,采用CDCA法所得的终糖含量几乎是它们的3倍。所以,采用CDCA法非常有利于提高终糖含量,在此工艺条件下,能使纤维素转化为葡萄糖的转化率R达98.68%。转化率R和终糖含量这 2个参数在提高原料利用率方面是至关重要的。因此,为了更有效地利用原料,如何使转化率和终糖含量进一步提高有待深入研究。
生产成本对于一个技术方法能否投入实用也是必需考虑的关键问题。酶酸结合的纤维素循环降解法不仅能使纤维素转化为葡萄糖的转化率和终糖含量明显提高,它还可以大幅度降低酸的用量,并改善下游工艺。与常规技术相比,该新工艺只需25%的醋酸、50%的盐酸和少量酶,可以大幅度地降低纤维素转化成葡萄糖的成本。同时,由于该工艺采用酸的分步间断添加且用量较少,使得酶和酸的循环利用成为可能。
本文作者采用CDCA法对麦秸进行了研究,其是否适用于其他材料还需进一步研究。
3 结论
(1)获得一种降解植物纤维素的新型工艺方法,即酶酸结合纤维素循环降解法(CDCA法)。该工艺方法具有条件温和、过程简单、成本低和周期短等特点。
(2)采用先酶解后酸解方案,7 h内在纤维素酶、CH3COOH 和 HCl依次添加的条件下能使纤维素转化为葡萄糖的转化率达91.7% (F>F0.01,p<0.01)。
(3)酶酸结合纤维素循环降解法(CDCA 法)不仅步骤少,耗时短,而且具有较高的转化率和终糖含量。在反应温度不超过 100℃、压力为 100 kPa、时间为15 h之内,可使纤维素转化为葡萄糖的转化率达98.68%(F>F0.01,p<0.01),终产品中葡萄糖的终糖含量达5.38%(F>F0.01,p<0.01)。与常规技术相比,该新工艺只需25%的醋酸、50%的盐酸和少量酶,可以大幅度地降低纤维素转化成葡萄糖的成本,是一种值得进一步开发和推广的方法。
(4)先酶解后酸解工艺优于先酸解后酶解工艺;CDCA工艺又明显优于先酶解后酸解工艺。酶酸结合纤维素循环降解工艺方法(CDCA法)具有条件温和、工艺简单、成本低和周期短等特点,该工艺方法可为发酵工业上以纤维素为原料从事乙醇、抗生素、SCP等产品的开发生产及环保上固态生活垃圾的生物处理提供科学依据。
[1]Vendula V, Peter B.Degradation of cellulose and hemicelluloses by the brown rot fungus Piptoporus betulinus: Production of extracellular enzymes and characterization of the major cellulases[J].Microbiology, 2006, 152(12): 3613−3622.
[2]Watson B J, ZHANG Hai-tao, Atkinson G.L, et al.Processive endoglucanases mediate degradation of cellulose by saccharophagus degradans[J].J Bacteriol, 2009, 191(9):5697−5705.
[3]Hans R, Elke L, Peter S, et al.Byssovorax cruenta gen nov, sp nov, nom rev:A cellulose-degrading myxobacterium: rediscovery of ‘Myxococcus cruentus’ Thaxter 1897[J].Int J Syst Evol Microbiol, 2006, 56(10): 2357−2363.
[4]Jung-Hoon Y, Jong H C, So-Jung K, et al.Jeongeupia naejangsanensis gen nov, sp nov: A cellulose-degrading bacterium isolated from forest soil from Naejang Mountain in Korea[J].Int J Syst Evol Microbiol, 2010, 60(3): 615−619.
[5]Pereyra L P, Hiibel S R, Prieto R M V, et al.Detection and quantification of functional genes of cellulose-degrading,fermentative and sulfate-reducing bacteria and methanogenic archaea[J].Appl Envir Microbiol, 2010, 76(4): 2192−2202.
[6]Hatsumi S, Kinuyo S, Hitomi O, et al.Clostridium clariflavum sp.nov.and Clostridium caenicola sp nov, moderately thermophilic, cellulose-/cellobiose-digesting bacteria isolated from methanogenic sludge[J].Int J Syst Evol Microbiol, 2009,59(7): 1764−1770.
[7]WEN Fei, SUN Jie, ZHAO Hui-min.Yeast surface display of trifunctional minicellulosomes for simultaneous saccharification and fermentation of cellulose to ethanol[J].Appl Envir Microbiol, 2010, 76(2): 1251−1260.
[8]Farzaneh R, XING De-feng, Rachel W, et al.Simultaneous cellulose degradation and electricity production by enterobacter cloacae in a microbial fuel cell[J].Appl Envir Microbiol, 2009,75(6): 3673−3678.
[9]Sara E B, Derrick L L, Robert M K.Phylogenetic,microbiological, and glycoside hydrolase diversities within the extremely thermophilic, plant biomass-degrading genus caldicellulosiruptor[J].Appl Envir Microbiol, 2010, 76(10):8084−8092.
[10]Wolfgang H, Christoph S, Evelyn D, et al.Cellobiose dehydrogenase from the ligninolytic basidiomycete ceriporiopsis subvermispora[J].Appl Envir Microbiol, 2009, 75(5):2750−2757.
[11]Rumi K, Tomomi K, Kei'ichi B, et al.Loosening Xyloglucan Accelerates the enzymatic degradation of cellulose in wood[J].Mol Plant, 2009, 90 (2): 904−909.
[12]Dietrichs, Hans-Hermann, Sinner, et al.Process for the production of glucose from cellulose-containing vege
Tableraw materials: United States Patent, 4160695[P].1979−07−10.
[13]李沅, 孙衍宁, 班卫平.纤维素在酸及酶催化作用下的降解特性[J].大连轻工业学院学报, 2000, 19(3): 169−171.LI Yuan, SUN Yan-ning, BAN Wei-ping.Hydralytic properties of cellulose under acid and enzyme catalysizing[J].Journal of Dalian Institute of Light Industry, 2000,19(3):169−171.
[14]关燕琼, 邓强, 蔡燕飞, 等.酸和纤维素酶综合处理降解甘蔗渣为还原糖研究[J].广西轻工业, 2007, 100(3): 1−2.GUAN Yan-qiong, DENG Qiang, CAI Yan-fei, et al.Bagasse to reduced sugar by acid and cellulase[J].Guangxi Journal of Light Industry, 2007, 100(3): 1−2.
[15]天津轻院, 大连轻院, 无锡轻院.工业发酵分析[M].北京:轻工业出版社, 1994: 3−6.Tianjin Institute of Light Industry, Dalian Institute of Light Industry, Wuxi Institute of Light Industry.Industrial Analysis of fermentation[M].Beijing: Light Industry Press, 1994: 3−6.
[16]陈国符, 邬义明.植物纤维化学[M].北京: 轻工业出版社,1986: 142−168.CHEN Guo-fu, WU Yi-ming.Chemistry of plant fiber[M].Beijing: Light Industry Press, 1986: 142−168.
[17]Ghose T K.Determination of cellulase activity[J].Pure & Appl Chem, 1987, 59(2): 257−268.
[18]罗澄源.物理化学实验[M].北京: 高等教育出版社, 1996:82−86.LUO Cheng-yuan.Physicochemistry experiment[M].Beijing:Higher Education Press, 1996: 82−86.
[19]天津轻院, 大连轻院, 无锡轻院, 等.工业发酵分析[M].北京: 轻工业出版社, 1994: 7−16.Tianjin Institute of Light Industry, Dalian Institute of Light Industry, Wuxi Institute of Light Industry.Industrial analysis of fermentation[M].Beijing: Light Industry Press, 1994: 7−16.
[20]王卫国, 赵永亮.混酸法降解植物纤维素技术研究[J].生物技术, 2002, 12(3): 10−12.WANG Wei-guo, ZHAO Yong-liang.Technological study on plant fiber or cellulose degradation by the method of combining different Acids[J].Biotechnology, 2002, 12(3): 10−12.
[21]王卫国, 赵永亮.酶法降解植物纤维素技术研究[J].生物技术, 2002, 12(2): 10−11.WANG Wei-guo, ZHAO Yong-liang.Technological study on cellulose degradation by cellulase[J].Biotechnology, 2002, 12(2):10−11.
[22]上海师范大学数学系.高等数学[M].北京: 高等教育出版社,1986: 182−212.Department of Mathematics, Shanghai Normal University.Higher mathematics[M].Beijing: Higher Education Press, 1986:182−212.
