荷电态对锰酸锂电池储存性能的影响
2011-08-09刘云建李新海郭华军王志兴
刘云建 ,李新海,郭华军,王志兴
(1.江苏大学 材料科学与工程学院,江苏 镇江,212013;2.中南大学 冶金科学与工程学院,湖南 长沙,410083)
LiMn2O4为 Fd3m空间群,理论比容量为 148 mA·h/g,实际比容量可达 120~130 mA·h/g。由于具有三维隧道结构,锂离子可以可逆地从尖晶石中脱嵌,并且尖晶石LMin2O4的原料来源广泛,电化学性能较好,对环境友好,价格低廉,安全性好,被认为是锂离子动力电池的首选材料。但是,锰酸锂材料也具有循环性能、储存性能差等缺点。很多研究者通过在16d的位置掺杂金属离子[1−5]来稳定 LMin2O4的尖晶石结构,或者通过表面包覆[6−7]来减少锰的溶解,循环性能得到了较大改善。但在锰酸锂电池制作、运输和使用过程中,不可避免会碰到储存搁置的问题,并且锰酸锂电池储存后不可逆容量损失严重[8−10]。目前国内外研究者就锰酸锂电池储存后容量衰减情况及机理研究尚不深入,为此,本文作者研究锰酸锂电池在不同荷电态下储存后电池电化学性能以及电极材料的结构变化。并通过材料检测和电化学分析等手段研究锰酸锂电池储存后容量衰减的机理。
1 实验
1.1 LiMn2O4的形貌和结构分析
利用 X 线衍射仪(日本 Rigaku公司制造)对LiMn2O4样品进行物相分析,以Cu Kα靶作为辐射源,电压为40 kV,电流为50 mA,步宽为0.02°,扫描速度为 2 (°)/min,扫描范围(2θ)为 10°~90°。
用JSM−5600型扫描电子显微镜对LiMn2O4的表面形貌进行表征。
1.2 LiMn2O4电池的制作
首先将LiMn2O4、导电剂、偏聚二氟乙烯(PVDF)在80 ℃真空烘烤6 h,然后,按照一定的比例进行搅拌,涂布在集流体铝薄上,经过120 ℃真空脱气烘干压膜,制成小片,负极采用人造改性石墨。通过卷绕,装入钢壳,脉冲脱气24 h,注液,电解液采用1 mol/L的 LiPF6的碳酸乙烯酯(EC)、碳酸二甲酯(DMC)和碳酸甲乙酯(EMC)(体积比为 1:1:1)溶液,搁置后预充、化成。
1.3 LiMn2O4的储存
将化成后的电池分别充电至半电态、满电态以及全放电态,然后,在室温下储存28 d。然后,将电池放电至3.0 V,在3.0~4.2 V之间充放电循环200次。充放电电流分别为1/3C和0.5C(其中,C为比容量)。
1.4 电化学测试
采用三电极体系测试循环伏安和交流阻抗,测试仪器为上海辰华 CHI660电化学工作站。循环伏安扫描速度为0.1 mV/s,扫描电位区间为2.5~4.5 V。交流阻抗的频率为0.01~100 kHz。
2 结果与讨论
图1(a)和(b)所示是 LiMn2O4的 SEM 图,放大倍数分别为3 000和5 000倍。从图1可以看出:LiMn2O4的形貌呈块状,颗粒较大,表面附有细小的颗粒;样品经粒径分布测试,LiMn2O4的粒径分布较为集中,其D10,D50和D90分别为2.7,12.0和29.2 μm,符合批量化生产的涂布要求,也符合锂离子动力电池的生产要求。

图1 LiMn2O4的SEM图Fig.1 SEM images of LiMn2O4
图2所示是正极材料LiMn2O4的X线衍射图。从图2可以看出:尖晶石相的(111),(311)和(400)衍射峰明显而且尖锐,并且未出现其他杂相峰,表明所选原料是纯相的LiMn2O4,且结晶化程度良好,并无其他杂质。
图3所示是储存前及放电态、半电态、满电态储存后的LiMn2O4的放电曲线。储存前LiMn2O4的放电容量为105.2 mA·h/g,放电态、半电态和满电态常温储存1月后LiMn2O4的放电容量分别为104.4,101.3和 98.4 mA·h/g,容量恢复率分别为 99.2,96.3和93.5%。由此可见:放电态下储存的锰酸锂电池容量恢复率最高,满电态下储存的锰酸锂电池容量恢复率最低。
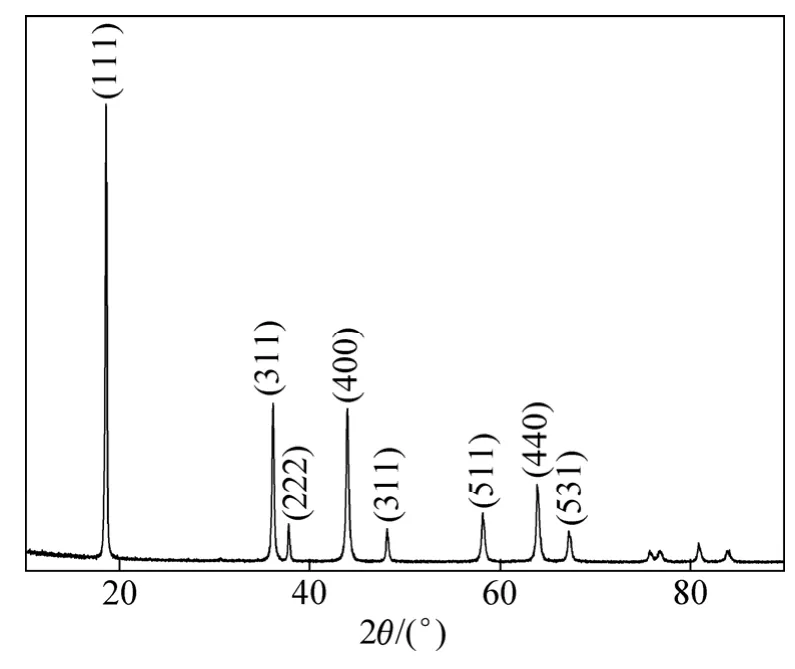
图2 LiMn2O4的XRD图谱Fig.2 XRD of LiMn2O4
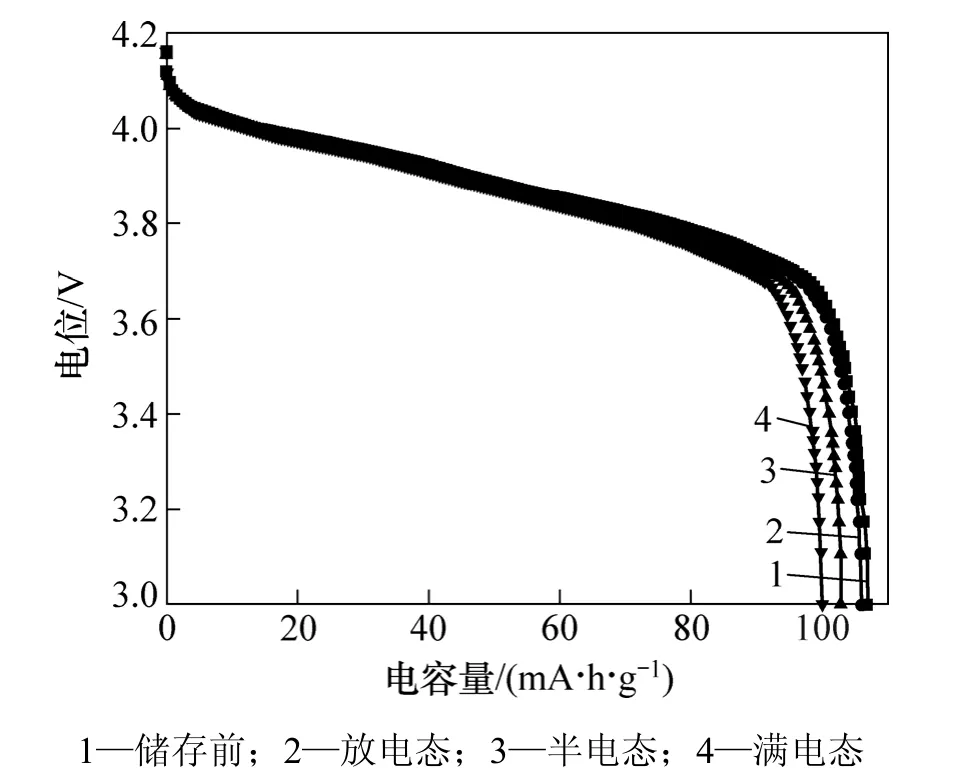
图3 LiMn2O4储存前后的放电曲线Fig.3 Discharge curves of LiMn2O4 before and after storage
图4所示为不同荷电态下锰酸锂电池储存后LiMn2O4的 X线衍射图。从图4可以看出:储存后LiMn2O4依旧保持着良好的尖晶石结构。但是,随着荷电态的增加,储存之后LiMn2O4的各条衍射峰的强度都变弱,衍射峰变宽,(311)衍射峰的半峰宽分别为0.28°,0.28°和 0.30°,而储存前的半峰宽为 0.26°。由此可见:LiMn2O4结构的坍塌程度随着荷电态的增加而增加;此外,储存后LiMn2O4衍射峰的角度都向高角度漂移;满电、半电和放电态储存后LiMn2O4的(111)晶面衍射峰的位置为18.6°,18.6°和18.58°,而储存前LiMn2O4的(111)晶面衍射峰的位置为18.58°。
图5所示是不同荷电态下储存后锰酸锂电池正极的SEM图。结合图4可以看出:储存后的LiMn2O4电极表面细小颗粒都有所减少;并且随着荷电态的增加,LiMn2O4颗粒的棱角越来越不清晰,LiMn2O4电极表面絮状物质有所增厚。这表明:LiMn2O4电极表面的腐蚀程度以及钝化膜的厚度随着荷电态的增加而增加;锰酸锂在储存过程中,电极的侵蚀程度随着荷电态的增加而增加,进而导致电容量损失增加。
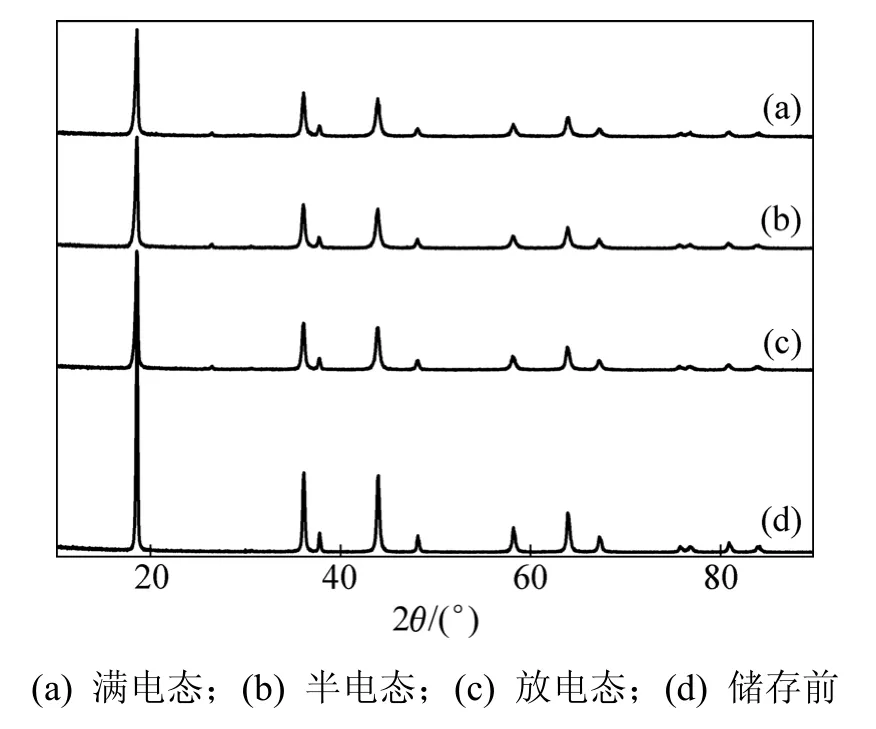
图4 LiMn2O4不同荷电态下储存后的XRD比较图Fig.4 XRD of LiMn2O4 after storage with different charged states

图5 不同荷电态储存后LiMn2O4的形貌Fig.5 SEM images of LiMn2O4 electrode after storage with different charged states
图6所示为不同荷电态下储存后锰酸锂电池的循环性能。从图6可见:经过170次循环后,储存前及放电态、半电态、满电态储存后的锰酸锂电池容量保持率分别为85.4%,86.2%,88.1%和89.7%。由此可见:不同荷电态储存之后锰酸锂电池的循环稳定性都得到了明显提高,并且循环性能的提高程度随着储存荷电态的增加而增加。从曲线的斜率来看,随着循环的进行,各荷电态储存后循环性能的差异进一步被拉大。
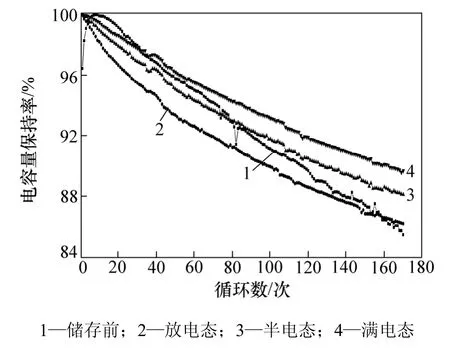
图6 不同荷电态储存后LiMn2O4的循环性能Fig.6 Cycling performance of LiMn2O4 after storage with different charged states
图7(a)所示为不同荷电下储存后的锰酸锂电极的循环伏安曲线,图7(b)所示为图7(a)的局部放大图。从图7可以看出:储存之后的锰酸锂电极循环伏安曲线的峰电流都有所减小,峰电位都向高电位移动,证明储存之后的锰酸锂电表面都发生了不同程度的钝化。在各种荷电条件下储存的锰酸锂电极都在 3.3 V和3.5 V处出现了1对氧化还原峰,这表明在任何荷电态下储存,氧缺陷都会发生。该结果表明:在任何荷电态下,锰酸锂正极都将和电解液发生反应。但是,从循环伏安曲线中看不出锰酸锂中氧缺陷程度。
LiMn2O4正极材料中Mn的溶解是锰酸锂电池容量衰减的一个直接原因。为了研究不同荷电态储存过程中LiMn2O4中Mn的溶解量,模拟了不同荷电态中锰酸锂电池锰的溶解情况。分别将放电态、半电态和满电态的锰酸锂电池解剖,刮取正极并用溶剂清洗,接着将0.6 g各种锰酸锂正极材料和10.0 g电解液置于钢壳中密封,并将钢壳在35 ℃下搁置48 h。然后,利用吸收光谱对电解液中Mn2+的含量进行测试,结果见表1。
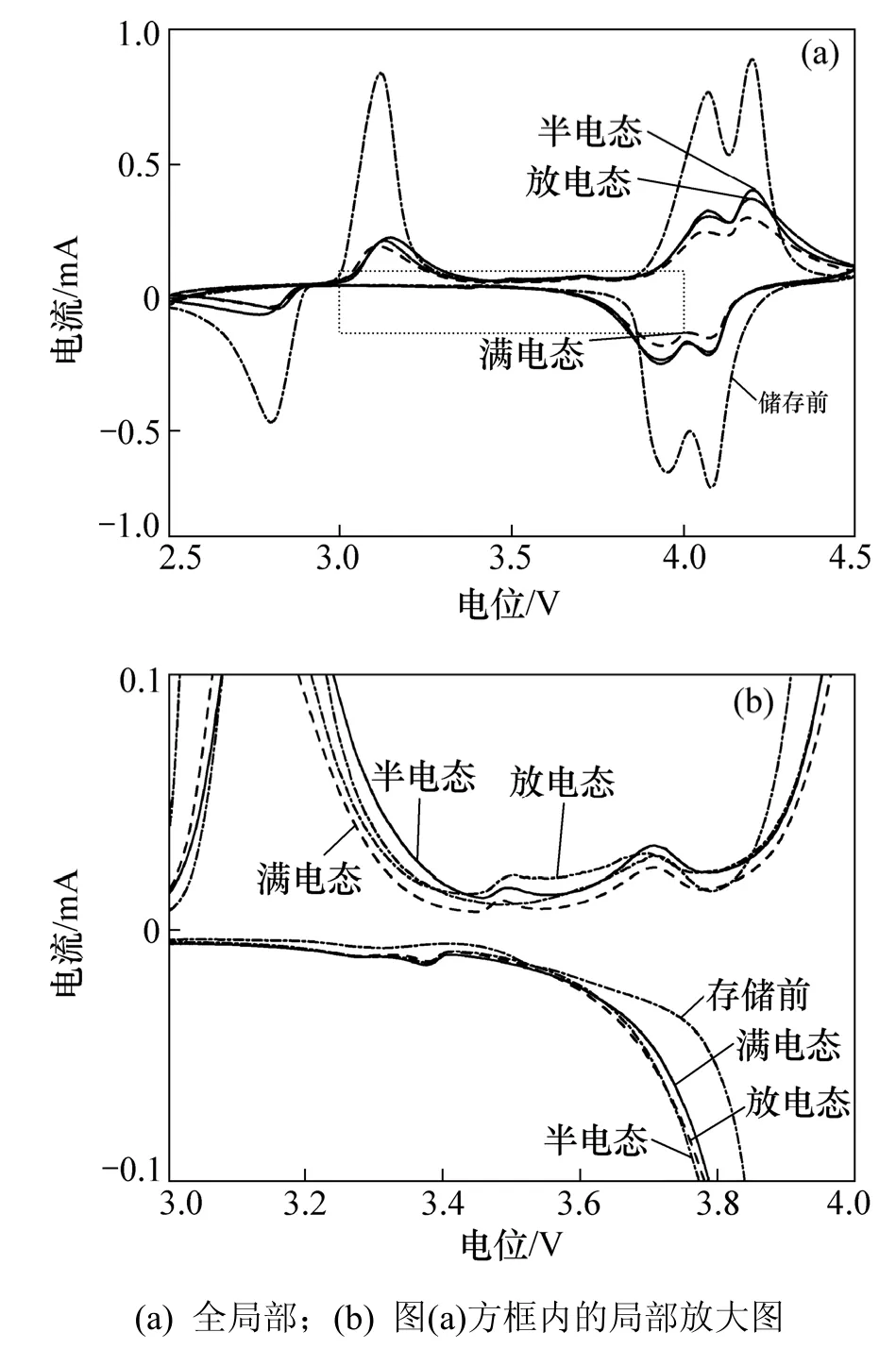
图7 锰酸锂储存前后的循环伏安图Fig.7 Cyclic voltammogram curves of cathode electrode
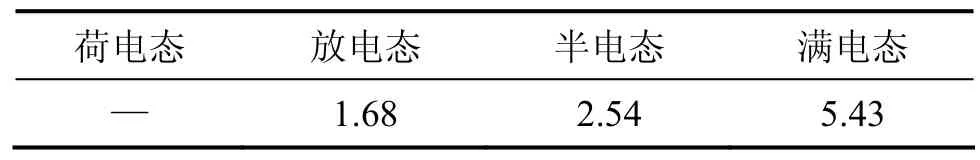
表1 不同荷电态储存过程中LiMn2O4中Mn的溶解量Table1 Dissolution of Mn in LiMn2O4 with different charged states mg/L
该结果表明:LiMn2O4正极材料中Mn的溶出量随着荷电态的增加而增加。这和Saitoh等[11]的研究结果相一致,但是,他们并未对其原因进行进一步研究和解释。Mn的溶出伴随着LiMn2O4尖晶石结构的塌陷和MnO2的沉积,并且直接造成锰酸锂电池中活性物质含量减少,进而造成容量损失。
为了进一步研究不同荷电态储存的锰酸锂电极的表面极化情况,测试了不同荷电态储存的锰酸锂电极的交流阻抗图谱,结果如图8所示。从图8可以看出:各条阻抗图谱都是由高频区和中频区的2个半圆和低频区的1条直接组成。但是,高频区的表面双电层阻抗则随着电池荷电态的增加而增加。这表明储存之后锰酸锂电池正极表面的钝化膜随着电池荷电态的增加而增加。其原因可能有以下几个方面:
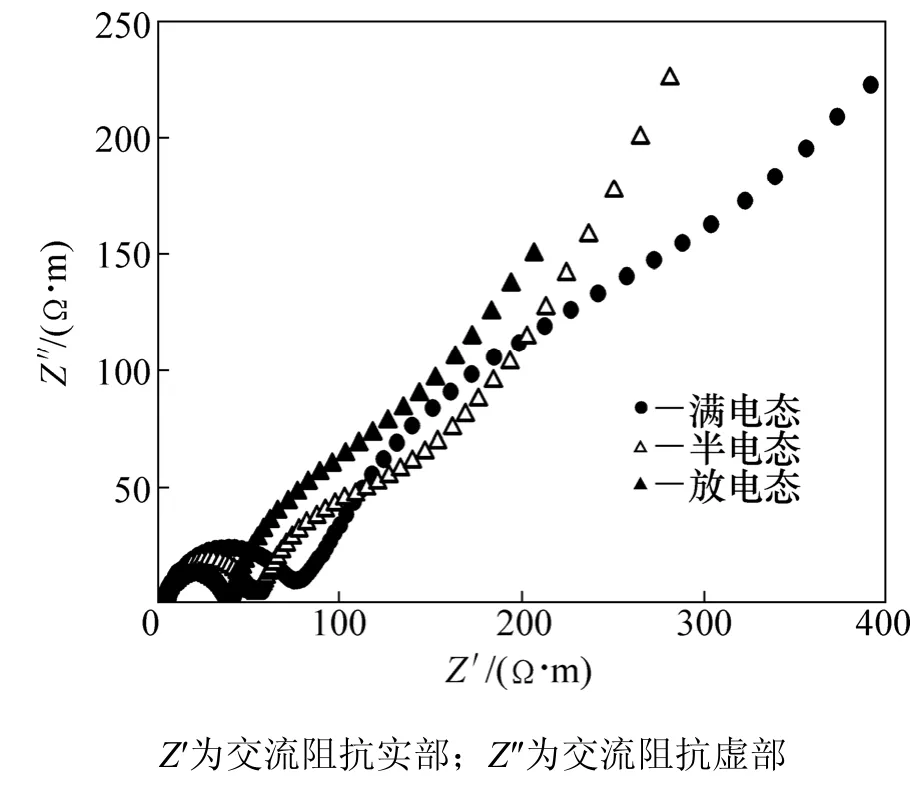
图8 不同荷电态储存的锰酸锂电极的交流阻抗图谱Fig.8 AC impedance of LiMn2O4 electrode with different charged states
(1)Mn的溶出量随着电池荷电态的增大而增大,Mn溶出伴随着MnO2的沉积,因此,MnO2的沉积量随着电池荷电态的增大而增大,沉积的MnO2导致电极表面阻抗增大。
(2)在储存过程中,电解液也在电极表面被正极材料所氧化,其电极表面形成钝化膜。随着荷电池电态的增加,正极材料的氧化性增强,电解液被氧化的程度增加,钝化膜的厚度也增加,因此,导致其阻抗增大。
Mn的溶解机理最初是由 Tarascon[12]等提出的。他们提出了质子催化导致Mn溶出的机理,该机理是目前较为人们普遍接受的一种机理。他们认为 Mn2+的溶出主要是由于电解液中的酸引起的。LiMn2O4中Mn3+不稳定,易自发地发生歧化反应,生成 Mn2+和Mn4+,Mn2+溶出并沉积在负极的表面,具体反应如下:
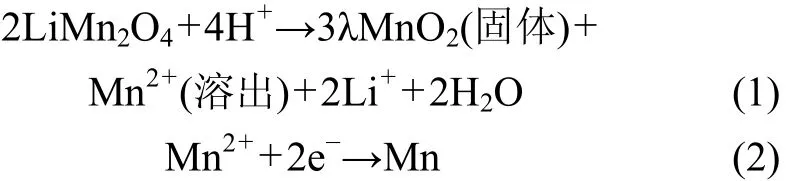
其中H+来自HF的电离,而HF则来自于电解液中锂盐 LiPF6的分解。随着电池荷电态的增加,电极中Mn3+的含量越来越少,但是,其Mn2+的溶出量越来越多,这似乎与质子催化机理相矛盾。因此,在储存过程中,Mn2+的溶解还可能与电极材料的化学活性有关。因此,可以推断在高荷电状态的储存过程中,Mn2+的溶出可能存在以下2个步骤:高氧化性的Mn4+被电解液溶剂还原成Mn3+;而刚还原出来的Mn3+活性比较强,容易与电解液中的 H+发生反应,生成Mn2+。其中被还原的 Mn3+可能以 Li2Mn2O4或者Mn2O3的形式存在。
此外,随着电池荷电态的增加,正极的相对电位越来越高,其氧化性也越来越强;负极的相对电位越来越低,其还原性也越来越强。正极氧化性强,导致正极和电解液发生反应,从而产生氧缺陷导致。氧缺陷会使 Mn-O键变弱且易断裂,进而导致 Mn容易溶出。
负极的还原性越强,其还原 Mn2+的能力也就越强,Mn2+还原的反应速度就越快,在储存过程中被还原的Mn2+的含量也就越多。Mn2+被还原成Mn单质沉积在负极表面,进而导致电解液中Mn2+含量降低,根据化学反应平衡的原理,Mn2+含量降低,促使反应(2)向右进行,从而导致大量Mn溶出。
3 结论
(1)放电态、半电态和满电态下锰酸锂电池容量恢复率分别为99.2%,96.3%和93.5%。储存后循环性能得到改善,满电态储存的锰酸锂电池循环性能改善程度最大,170次循环容量保持率为 89.7%,储存前170次循环容量保持率为85.4%。随着荷电态的增大,储存后锰酸锂尖晶石结构的塌陷程度增大,正极阻抗增加,并且都发生了氧缺陷现象。
(2)锰酸锂电池储存后容量衰减随着荷电态的增加而增加,主要是Mn溶解量以及储存后正极表面极化增大所致。随着荷电态的增大,电极氧化性增强,Mn4+可能先被还原成Mn3+,进而因为H+存在而自发地发生歧化反应,生成Mn2+。
[1]Amine K, Tukamoto H, Yasuda H, et al , Preparation and electrochemical investigation of LiMn2−xMexO4(Me: Ni, Fe, and x=0.5, 1)cathode materials for secondary lithium batteries[J].Journal of Power Sources, 1997, 68 (2): 604−608.
[2]Hong Y S, Han C H, Kim K, et al, Structural and electrochemical properties of the spinel Li(Mn2−xLix/4Co3x/4)O4[J].Solid State Ionics, 2001, 139(1/2): 75−81.
[3]李运娇, 常建卫, 李洪桂, 等.富锂型掺钴尖晶石锂锰氧化物的结构与电化学性能[J].中南大学学报: 自然科学版, 2004,35(3): 381−385.LI Yun-jiao, CHANG Jian-wei, LI Hong-gui, et al.Structure and electrochemical performance of Li-rich spinel lithium manganese oxide with doping cobalt[J].Journal of Central South University: Science and Technology, 2004, 35(3): 381−385.
[4]Alcantara R, Jaraba M, Lavela P, et al, New LiNiyCo1−2yMn1+yO4spinel oxide solid solutions as 5 V electrode material for Li-Ion batteries[J].Journal of Electrochemical Society, 2004, 151(1):A53−58.
[5]Yoon C S, Kim C K, Sun Y K, Cycling behavior of selenium-doped LiMn2O4spinel cathode material at 3 V for lithium secondary batteries[J].Journal of Power Sources, 2002,109(1): 234−238.
[6]Eftekhari A, Solid State Ionics, Aluminum oxide as a multi-function agent for improving battery performance of LiMn2O4cathode[J].Journal of Power Sources, 2004, 167(3/4):237−242.
[7]Gnanaraj J S, Pol V G, Gedanken A, et al, Improving the high-temperature performance of LiMn2O4spinel electrodes by coating the active mass with MgO via a sonochemical method[J].Electrochemistry Communication, 2003, 5(11): 940−945.
[8]Yamane H, Saitoh M, Sano M, et al, Cycle performance in each state-of-charge in LiMn2O4[J].Journal of Electrochemical Society, 2002, 149(10): 1514−1519.
[9]Takahashi K, Saitoh M, Asakura N, et al, Electrochemical properties of lithium manganese oxides with different surface areas for lithium ion batteries[J].Journal of Power Sources, 2004,136(1): 115−121.
[10]Liu Y J, Li X H, Guo H J, et al, Electrochemical performance and capacity fading reason of LiMn2O4/graphite batteries stored at room temperature[J].Journal of Power Sources.2009, 189(2):721−725.
[11]Saitoh M, Sano M, Fujita M, et al.Studies of capacity losses in cycles and storages for a Li1.1Mn1.9O4positive electrode[J].Journal of Electrochemical Society, 2004, 151(1): A17−A22.
[12]Tarascon J M, Mckinnon W R, Goowar F, et al.Synthesis conditions and oxygen stoichiometry effects on Li insertion into the spinel LiMn2O4[J].Journal of Electrochemical Society, 1994,141(6): 1421−1431.
