采用湿式氧化法脱除铝酸钠溶液中硫的研究
2011-08-09胡小莲陈文汨
胡小莲 ,陈文汨
(1.中南大学 冶金科学与工程学院,湖南 长沙,410083;2.湖南科技大学 化学化工学院,湖南 湘潭,411201)
由于硫在拜耳法生产中的铝工矿中造成 Na2O的质量损失,而且溶液中的硫层使钢材受到腐蚀,使蒸发和分解工序的钢制设备因严重腐蚀而损坏,特别是在溶出过程中形成的 S2−使得铝酸钠溶液中铁的含量增加而影响氧化铝的品位[1−4],而且随着温度提高,铝土矿中硫的转化率大大提高,给高温溶出含硫铝土矿带来很多困难。S2−在溶液中与铁作用生成溶解度较大的羟基硫代铁酸钠,压煮矿浆稀释和铝酸钠溶液冷却时,羟基硫代铁酸钠的溶解度降低,并沉淀,污染氢氧化铝,进而引起氧化铝中铁含量升高。为了保证氧化铝的纯度,很多科研工作者开展了拜耳液中的除硫研究[5−7],以脱除S2−或用各种氧化剂来降低其含量。有效的排硫方法之一是采用氧化剂使硫化钠和硫代硫酸钠转化为硫酸钠。采用硫代硫酸钠作为氧化剂时,在用水化学法处理铝土矿生产氧化铝的条件下,硫代硫酸钠是惰性化合物[1],一般是在溶液中加入添加剂[5−6]。此外,还可以采用净化铝酸钠溶液脱除硫化物型硫和铁的特殊工序。现已应用于工业生产的办法有:使溶液中硫化物型硫以微溶的硫化锌沉淀进入固相,或通过在搅拌槽中的空气搅动和高压溶出前的矿浆保温而使硫化物型硫氧化,从而可降低高压溶出液中硫的转化率;此外,使铝酸钠溶液中的硫深度氧化成硫酸钠,使其析出,然后加工成商品[1]。本文作者采用往高压釜内通入氧气的湿式氧气氧化法以脱除铝酸钠液中的 S2−。湿式氧化法(WAO)是20世纪 50年代发展起来的一种处理高浓度、有毒有害、生物难降解废水的方法[8]。它通常需要在高温(150~350 ℃)和高压(0.5~20 MPa),以空气或者纯氧为氧化剂(也有的使用其他氧化剂,如臭氧、过氧化氢等),在液相中将有机污染物氧化为CO2、水、无机物或小分子有机物的化学过程。这一技术后来被用于去除拜耳法溶液中的有机物,国外WAO技术已用于拜耳法氧化铝生产[9−10]。德国的AOS氧化铝厂和美国的Gramercy氧化铝厂分别在20世纪80年代进行了往铝土矿溶出系统通入氧气的湿式氧化工业试验,取得了很好的效果。目前,关于湿式氧化处理拜耳液的文献和专利报道较多[11−15],但其中大部分只停留在实验室或中试阶段,用湿式氧化脱除拜耳液中的硫离子[1],通入氧气使硫氧化成硫酸钠,在溶液蒸发时析出,以达到除硫的目的。在此,本文作者采用湿式氧气氧化法脱除铝酸钠溶液中的S2−,使其深度氧化成硫酸钠,从而减少拜耳液中硫化物型硫含量,达到除硫的目的。
1 实验
试验原料为:溶出实验所用铝酸钠溶液取自国内某拜耳法氧化铝厂, 其主要成分为Al2O3140 g/L,全碱NT248 g/L,苛性碱NK228 g/L,其中Al2O3质量浓度与苛性碱 NK质量浓度之比RP为 0.61, 不含有 S2−及其他硫离子成分。
试验设备为:美国DIONEX公司ICS—2500型离子色谱仪;湿式氧化反应器(ZCF-3型 GS-0.5型磁力搅拌高压釜);TA−091型控温仪(控温精度为±1 ℃),由大连自控设备厂生产。高压釜工艺结构如图1所示。
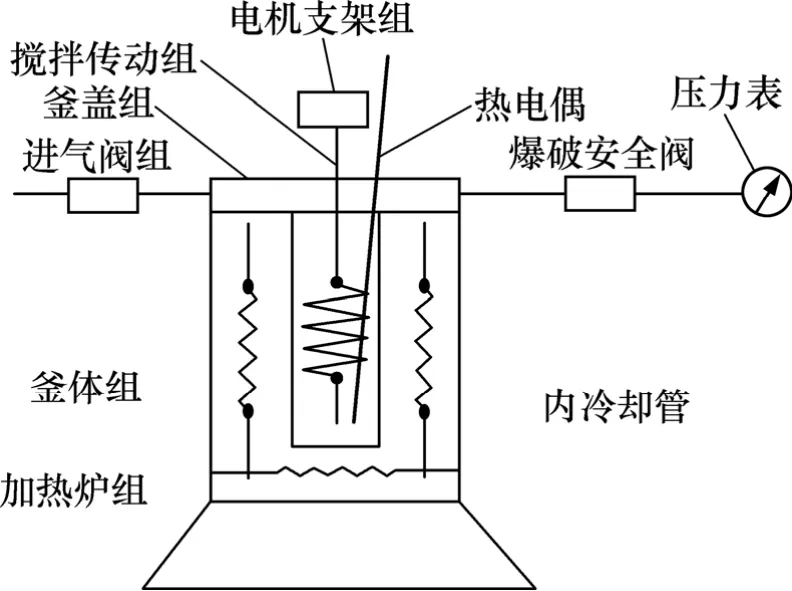
图1 高压釜结构Fig.1 Structure of high pressure autoclave
高压釜用不锈钢1Cr18Ni9Ti制成,附有电加热磁力传递搅拌装置和温度自动控制装置。为确保整个系统的安全,高压釜及管路设计有安全阀,安全阀内爆破片的最大承受压力为20.0 MPa。
1.1 实验方法流程
本方法主要针对拜耳法溶出后的铝酸钠溶液,在高压釜内对其通氧气,进行湿式氧气氧化法处理脱除溶液中的S2−,使其深度氧化成硫酸钠,从而减少拜耳液中硫化物型硫含量,达到除硫的目的。湿式氧化法原理流程如图2所示。
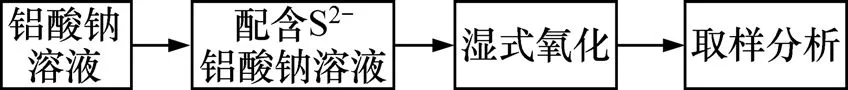
图2 湿式氧化法原理流程图Fig.2 Basic flow chart of wet oxidation
1.2 湿式氧化操作步骤
湿式氧化操作在高压釜反应器中进行,反应采用间歇操作,高压釜的氧气由氧气瓶提供,氧气瓶连有缓冲罐,缓冲罐出口管道与高压釜体相连。操作步骤如下。
(1)打开釜盖,向釜内加入定量一定初始浓度的待处理液样。
(2)合上反应釜盖,并用螺母固定,连接冷却水管路、充氧管路。
(3)打开电源,设定反应温度及加热功率,加热升温。
(4)待反应温度到达90 ℃后,打开氧气瓶阀,充氧至缓冲罐设定压力,关闭氧气瓶阀,开启搅拌器。
(5)反应到达指定的温度后,作为反应时间的起始点。
(6)试验结束后关闭电源,待釜体冷却至室温。
(7)取样分析。
1.3 分析方法
1.3.1 铝酸钠溶液中硫代硫酸根、亚硫酸根和硫酸根浓度分析
近年来,离子色谱法在测定各种水性溶液中的常见无机阴离子方面已得到广泛应用。尤其是离子色谱法中的背景抑制电导检测法,因其有灵敏度高、重现性好且可进行多种离子同时测定的突出优点,因此,对溶液中的硫代硫酸根、亚硫酸根和硫酸根浓度采用离子色谱分析,而S2−因检测结果不稳定,仍然采用化学分析法进行测定。
混合淋洗液为1.0 mmol/L NaHCO3+3.2 mmol/L Na2CO3;淋洗液流速为 0.7 mL/min;泵压力为 13.6 MPa;样品进样体积为50.0 μL;温度为20.0 ℃;色谱柱为METROSEP A SUPP 5-250 (6.1006.530);粒径为5.0 μm。以保留时间进行定性分析,峰面积进行定量分析。
样品预处理:实际样品为有代表性的铝酸钠溶液,针对其为高离子浓度、强碱性以及成分很复杂的黏稠溶液的特点,若直接进样,则样品中大量的金属离子会缩短阴离子分离柱寿命,降低柱效并干扰测定。所以,必需对样品进行前处理,以消除大量的阳离子基体,并使溶液由强碱性变为中性。首先将样品用高纯水稀释1 000倍,然后,经过活化好的固相萃取柱或自制的阳离子交换树脂柱处理,预处理后的样品再经孔径为0.45 µm微孔滤膜过滤进行离子色谱分析。
1.3.2 铝酸钠溶液中S2−分析
依文献[16]测定熟料及烧结赤泥中S2−浓度[16]。
1.3.3 单质硫的分析
采用差减法对单质硫浓度进行分析,即用溶液中总硫浓度(配成的 S2−浓度)减去反应后溶液中硫代硫酸根、亚硫酸根及硫酸根中的硫离子及S2−的浓度。
2 实验结果与讨论
2.1 湿式氧化处理S2−
采用上面的铝酸钠溶液配成含有一定 S2−浓度的溶液,在高压釜反应器中进行湿式氧气氧化法处理拜耳液中硫的实验,实验按操作步骤进行,在实验过程中,当高压釜内液体温度升至90 ℃时,开始通氧气,调节缓冲罐内的压力和釜内压力达到平衡且达到指定的实验压力,然后关掉氧气瓶的出口阀门,则缓冲罐和高压釜形成了一个密闭系统。随着高压釜内温度的上升,由于蒸气压的存在,高压釜内压力不断升高,当达到实验指定的温度并保持不变时,压力不变,实验结束后,分析铝酸钠溶液中S2−浓度。在氧气足量的情况下,研究反应温度、开始通氧气时高压釜和缓冲罐达到的起始平衡氧气压力、反应时间以及硫化物浓度对硫化物S2−去除率的影响。
2.1.1 反应温度对硫化物S2−去除率的影响
反应条件:通入氧气的起始平衡压力为2.0 MPa,反应时间为60 min,反应液体积为500 mL,自配铝酸钠溶液中S2−的浓度为31.2 mmol/L。反应温度对硫化物去除率的影响如图3所示。由图3可知:在温度为140,160,180,200和220 ℃时,铝酸钠溶液中硫化物S2−的浓度随温度的升高而下降;而其去除率则随温度的升高而上升,且在温度160~200 ℃之间发生突变,在温度为260 ℃时,S2−的浓度降到最低,为0.3 mmol/L,而S2−的去除率最大,为99%。
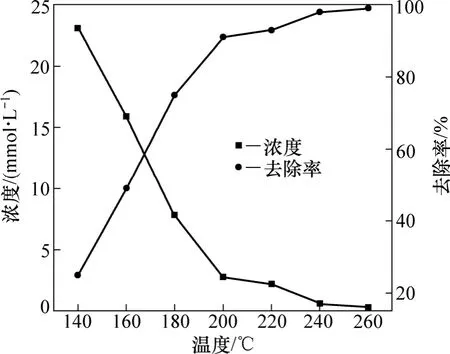
图3 反应温度对硫化物去除率的影响Fig.3 Influence of temperature on removal rate of sulfide
2.1.2 氧气起始平衡压力对硫化物S2−去除率的影响
反应条件如下:反应温度为200 ℃,反应时间为60 min,反应液体积为500 mL,自配铝酸钠溶液中S2−的浓度为31.2 mmol/L。在保证氧气足量的情况下,通入氧气的起始平衡氧气压力对硫化物去除率的影响如图4所示。由图4可知:在氧气的起始平衡氧气压力为0.5,1.0,1.5,2.0,2.5,3.0和3.5 MPa时,铝酸钠溶液中硫化物 S2−的浓度随氧气起始平衡压的升高而下降,而其去除率则随气压的升高而上升;在氧气的起始平衡压为3.5 MPa时,S2−的浓度降到最低,为0.6 mmol/L, 而S2−的去除率最大,为98%。
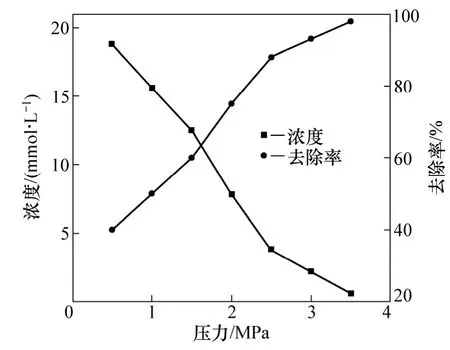
图4 氧气的起始平衡氧气压力对硫化物去除率的影响Fig.4 Influence of oxygen pressure on removal rate of sulfide
2.1.3 氧化时间对硫化物S2−去除率的影响
反应条件如下:反应温度为200 ℃,氧气起始平衡压力为3.0 MPa,反应液体积为500 mL,自配铝酸钠溶液中S2−的浓度为31.2 mmol/L。氧化时间对硫化物去除率的影响如图5所示。由图5可知:铝酸钠溶液中硫化物S2−的浓度随氧化时间的增加而下降,而其去除率则随氧化时间增加而上升,且在氧化时间为0~40 min时反应速度较快;在氧化时间为120 min时,S2−的浓度降到0.3 mmol/L, 而S2−的去除率为99%。

图5 氧化时间对硫化物去除率的影响Fig.5 Influence of time on removal rate of sulfide
2.1.4 硫化物浓度对硫化物S2−去除率的影响
反应条件如下:反应温度为200 ℃,氧气起始平衡压力为3.0 MPa,反应液体积为500 mL,反应时间为60 min。硫化物浓度对硫化物去除率的影响如图6所示。由图6可知:在硫化物S2−的浓度为15.6,31.2,46.8和62.4 mmol/L时,其去除率随硫化物S2-的浓度增加变化不大;在已知的反应条件下,S2−去除率为98%左右。

图6 硫化物浓度对硫化物去除率的影响Fig.6 Influence of concentration of S2− on removal rate of sulfide
2.2 硫化物的转化规律
一般认为硫化物被氧化成为单质硫(S)、硫代硫酸根、亚硫酸根、硫酸根等不同氧化态,经深度氧化,最终氧化为硫酸根,通过试验来确定各中间产物的含量[17]。
2.2.1 样品测定结果
采用表1中铝酸钠溶液配成含有一定 S2−浓度的溶液,反应时间为60 min, 反应液体积为500 mL, 在实验条件下,按操作步骤,在高压釜反应器中进行湿式氧气氧化法实验。实验结束后取样,分析铝酸钠溶液中各种硫离子的浓度,其中S2−浓度采用化学分析测定,而硫代硫酸根、亚硫酸根、硫酸根在色谱条件下采用离子色谱分析,单质硫采用差减法分析,实验结果如表1所示。
由表1可知:在高温高压下,S2−大部分被氧化为SO42−,进行的是深度氧化,只有少部分 S2−被氧化为硫的其他形态。影响S2−的氧化因素主要是反应温度和氧气起始平衡压力。当氧气起始平衡压力为3.5 MPa时,只要温度达 180 ℃,就有 90%的 S2−被氧化为SO42−;当温度高达到260 ℃时,当氧气起始平衡压力达到1.0 MPa时, 仍有98%以上的S2−被氧化为SO42−。
S2−在通氧的条件下进行深度氧化转化为 SO42−具有重要的工业意义。在深度氧化的情况下氧化为SO42−,在氧化能力及氧化程度不够的情况下,S2−主要氧化为 S2O32−,但在强氧化剂作用下,硫代硫酸钠才能继续被氧化成亚硫酸钠。亚硫酸钠比较容易被氧化成硫酸钠,这由表1可以看出。在180 ℃和1.5 MPa时,浓度为 6.25×10−2mol/L 的 S2−通过深度氧化为SO42−的硫离子浓度为34.2 mmol/L, 没有氧化的S2−浓度仍然有15 mmol/L,氧化为S2O32−的硫离子浓度为7.0 mmol/L。反应方程式如下:
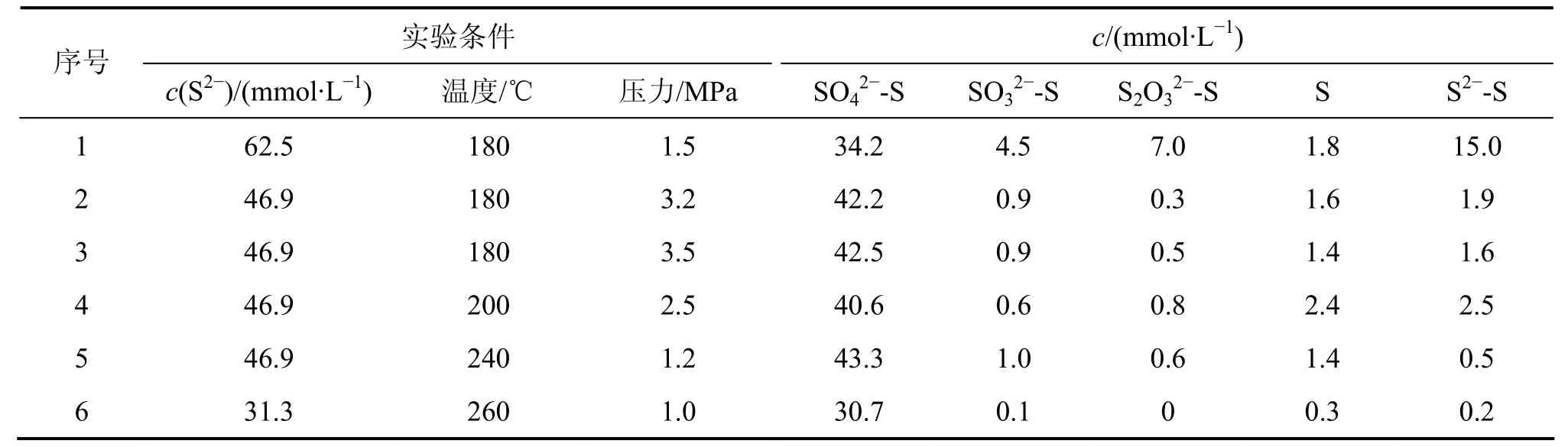
表1 硫的各种形态浓度Table1 Concentration of different forms of sulfur

S2O32−在铝酸钠溶液中的积累同样是要抑制的。随着温度的提高,硫代硫酸钠稳定性变弱,并在高压溶出过程中于230~235 ℃分解:
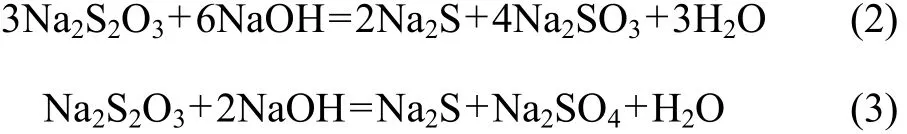
因此,在氧化程度不够的情况下,铝酸钠溶液中各种形态的硫离子并存;在氧化能力较强的情况下,硫离子进行了深度的氧化并最终氧化为硫酸根离子:

在高温高压的湿式氧气氧化法处理硫离子的过程中,反应产物主要是硫酸根离子,进行的是深度氧化。
因此,在高温高压的湿式氧气氧化法处理硫离子的过程中,反应产物铝酸钠溶液中的SO42−和S2−在溶液中的含量反映了氧化的程度。为了进一步探讨反应条件对氧化程度的影响,就反应时间对湿式氧气氧化法氧化程度的影响进行研究。
2.2.2 反应时间对湿式氧气氧化法氧化程度的影响
反应条件如下:通入氧气的起始平衡压力为 3.0 MPa,反应温度为200 ℃,反应液体积为500 mL,自配铝酸钠溶液中S2−的浓度为46.8 mmol/L。反应时间对湿式氧气氧化法氧化程度的影响见图7。
从图7可以看出:随着反应时间的增加,铝酸钠溶液中硫化物 S2−的浓度减少,SO42−浓度增大,氧化程度加深,且在氧化时间为0~40 min时,变化较大;当氧化时间为120 min时,铝酸钠溶液中S2−几乎全部转化为SO42−;当反应时间为60 min以后,随着时间的增加,S2−和SO42−含量变化较小。

图7 反应时间对湿式氧气氧化法氧化程度的影响Fig.7 Influence of reaction time on degree of oxidation
3 结论
(1)在高压釜内,采用往釜内通入氧气的湿式氧化法除硫工艺能有效去除铝酸钠溶液的S2−,去除效率受釜出氧气压力、反应温度、反应时间的影响。较适宜的操作条件如下:反应温度为200 ℃,氧气压力为3.0 MPa,S2−的浓度为 31.2 mmol/L,此时,S2−的去除率为99%。
(2)在高温高压下,铝酸钠溶液中的S2−大部分被氧化为SO42−,进行的是深度氧化,只有少部分S2−被氧化为硫代硫酸根、亚硫酸根及硫的其他形态, 影响S2−氧化为 SO42−主要是反应温度和氧气压力。当氧气压力为3.5 MPa时,只有温度达到180 ℃,就有90%的S2−被氧化为SO42−;当温度高达到260 ℃时,只要氧气压力达1.0 MPa, 便仍有98%以上的S2−被氧化为SO42−。
[1]毕诗文.氧化铝生产工艺[M].北京: 化学工业出版社, 2006:96−102.BI Shi-wen.Technology of alumina production[M].Beijing:Chemical Industry Press, 2006: 96−103.
[2]阿布拉曼夫 B.碱法综合处理含铝原料的物理化学原理[M].陈谦德, 等译.长沙: 中南工业大学出版社, 1988: 178−182.Ablamoff B.Physical and chemical principles of comprehensive treatment of aluminum-containing raw materials by basic process[M].CHEN Qian-de, et al, transl.Changsha: Press of Central South University of Technology, 1988: 178−182.
[3]刘桂华, 高君丽, 李小斌, 等.拜耳法高压溶出液中铁浓度变化规律的研究[J].矿冶工程, 2007, 27(5): 38−40.LIU Gui-hua, GAO Jun-li, LI Xiao-bin, et al.Study on variation rule of iron in the aluminate solution after digestion process at high temperature by bayer process[J].Mining and Metallurgical Engineering, 2007, 27(5): 38−40.
[4]陈文汨, 陈学刚, 郭金权, 等.拜耳液中铁的行为研究[J].轻金属, 2008, 4: 14−18.CHEN Wen-mi, CHEN Xue-gang, GUO Jin-quan, et al.Research on the behavior of iron in bayer liquor[J].Light Metals,2008, 4: 14−18.
[5]何润德.工业铝酸钠溶液氢氧化钡除硫[J].有色金属, 1996,48(4): 63−66.HE Run-de.Sulphur removal with barium hydroxide from industrial sodium aluminate solution[J].Nonferrous Metals,1996, 48(4): 63−66.
[6]何润德, 田忠良.论用铝酸钡除工业铝酸钠溶液中硫的经济合理性[J].贵州工业大学学报, 2000, 29(6): 54−58.HE Run-de, TIAN Zhong-liang.Discussion on reasonable cost of sulphur removal with barium aluminate from industrial sodium aluminate solution[J].Journal of Guizhou University of Technology, 2000, 29(6): 54−58.
[7]谭鸿喜.主要排硫方法简介与评述[J].轻金属, 1982, 7: 10−14.TAN Hong-xi.Brief introduction and review of the main method of desulphurization[J].Light Metals, 1982, 7: 10−14.
[8]Luck F.Wet air oxidation: Past, present and future[J].Catalysis Today, 1999, 53: 81−91.
[9]Bhargava S K, Tardio J.12 years of experience with wet oxidation[J].Light Metals, 2002, 4: 177−180.
[10]Loh J S C, Brodie G M, Power G, et al.Wet oxidation of precipitation yield inhibitors in sodium aluminate solutions:effects and proposed degradation mechanisms[J].Hydrometallurgy, 2010, 104(2): 278−289.
[11]Malite J T, Roberson M L.Removal of high molecular weight organic compounds from bayer process caustic liquor: US Patent,4663133[P].1987.
[12]Rosenberg S P, Tichbon W.Organic impurity process for bayer liquors: US Patent, 6555077[P].2003.
[13]Bernhard S, Gerhard B, Ernst U.Method for removing organic substances from caustic aluminate liquors: US Patent,4668486[P].1987.
[14]Eyer S L, Bhargava S, Sumich M.Removal of organic from bayer liquor and wet oxidation[J].Light Metals, 2000, 1: 45−51.
[15]Soucy G, Larocque J E, Forté G.Organic control technologies in bayer process[J].Light Metals, 2004, 2: 109−114.
[16]《联合法生产氧化铝》编写组.联合法生产氧化铝控制分析[M].北京: 冶金工业出版社, 1977: 140−142.The Drafting Group of Production Alumina by Combination Process.Control analysis of production alumina by combination process[M].Beijing: Metallurgical Industry Press, 1977:140−142.
[17]Barton H R, LI Wen-ge.Binuelear manganese complexes as catalysts in the selective and efficient oxidation of sulfides to sulfones[J].Tetrahedron Letters, 1998, 39(9): 7055−7058.
