通过膜分离法纯化猪瘟疫苗的效果分析
2011-08-08武桂梅王振辉张桂荣
武桂梅,王振辉,张桂荣,刘 军
(1.吉林农业科技学院动物科学学院,吉林吉林132101;2.吉林正业生物制品股份有限公司,吉林 吉林 132101)
目前,用于预防畜禽传染病的疫苗都是没有纯化的。疫苗中含有大量的制苗材料来源的蛋白质及抗生素,无疑是接种动物的各种不良反应的过敏原,严重干扰疫苗蛋白抗原的免疫应答,大大减少中和抗体的产生,导致一些畜禽个体免疫失败[1]。本试验采用膜分离技术对猪瘟病毒的纯化浓缩,显著提高了免疫效果。
1 材料与方法
1.1 微滤/超滤管式陶瓷(有机)膜分离系统(型号:S Y-MU-2-500) 管式陶瓷膜元件孔径0.80μm、0.60 μm、0.45μm、0.22 μm;管式有机膜元件(改良纤维素)5K由本院生物制药实验室提供。
1.2 猪瘟疫苗病毒细胞培养液 吉林正业生物制品股份有限公司提供90000 m L效力检验不合格(病毒最小感染量≥10-4/mL)的猪瘟细胞培养液及合格的常规猪瘟冻干活疫苗(500头份,批号20080109)。
1.3 试剂与实验动物 中国农业科学院哈尔滨兽医研究所生产的猪瘟阳性血清(批号20080206)、猪瘟阴性血清(批号20080110)、猪瘟正向间接血凝诊断液(批号20080309)、猪瘟病毒脾淋毒(最小感染量≤10-5/m L)均由吉林正业生物制品股份有限公司提供。仔猪由吉林农业科技学院种猪场提供;健康家兔、小鼠、豚鼠由吉林正业生物制品股份有限公司健康动物舍提供。
1.4 不同膜组合对猪瘟病毒液的纯化与浓缩[2]每组膜纯化浓缩处理30000 mL不合格的猪瘟病毒细胞培养液,分三组进行:1组(0.80μm、5K、0.22 μm)陶瓷(有机)膜过滤器;2组(0.60μm、5K 、0.22 μm)陶瓷(有机)膜过滤器;3组(0.45μm、5K 、0.22 μm)陶瓷(有机)膜过滤器。先分别用0.80μm、0.60μm、0.45μm 陶瓷膜过滤杂蛋白,再用5K有机膜浓缩病毒,最后用0.22μm陶瓷膜除菌处理。
1.5 杂蛋白去除率与无菌检验[2-3]三组纯化的猪瘟病毒液分别用紫外分光光度计检测杂蛋白去除率;分别用硫乙醇酸盐培养基(T.G)、酪胨琼脂培养基(G.A)、葡萄糖蛋白胨水培养基(G.P)按文献中的方法进行无菌检验。
1.6 纯化浓缩的猪瘟病毒液效力检验[3-4]三组纯化的猪瘟病毒液分别稀释为10-4、10-5、10-6三个滴度,每个滴度分别用3.0 kg左右的健康家兔2只,每只家兔耳静脉注射1 m L。家兔接种后,每天上下午各测体温1次,48~96 h后,每隔6 h测体温1次,根据体温反应和无体温反应兔攻击猪瘟病毒脾淋毒后的体温测定结果,判定纯化浓缩的各组猪瘟病毒液的最小感染量。
1.7 纯化浓缩的猪瘟病毒液安全检验[3-4]三组纯化的猪瘟病毒液分别进行10倍稀释,分别皮下注射体重 18~22 g小鼠各5只,每只0.2 mL;肌肉注射体重350~ 400 g豚鼠各2只,每只1 m L,均观察10 d;肌肉注射无猪瘟母原抗体10 kg左右的仔猪各4头,每头5 m L,饲养观察21 d,同时设同批对照小鼠5只、豚鼠2只、仔猪 4头,按要求饲养在非免疫区,判定结果。
1.8 纯化浓缩的猪瘟冻干活疫苗成品检验 分别将三组纯化浓缩合格的猪瘟病毒液添加常规的猪瘟冻干活疫苗保护剂,按照猪瘟疫苗冻干曲线进行冻干制造成品。其成品的无菌检验、效力检验、安全检验分别按1.5、1.6、1.7项进行。
1.9 纯化浓缩的猪瘟冻干活疫苗成品免疫试验
1.9.1 仔猪分组与免疫[5-6]根据试验内容,选用28日龄断奶前仔猪80头(母原抗体平均≤4log2),随机平均分为4组。第 1、2、3组每头仔猪对应接种三组纯化浓缩的猪瘟冻干活疫苗1.0头份;第4组为常规疫苗免疫对照组,每头仔猪接种常规猪瘟活疫苗1.0头份,四组免疫仔猪均在相同条件下饲养90 d监测抗体消长规律。
1.9.2 抗体测定[7-8]分别于免疫后第0、7、14、21 、28、35、42、49、56、63、70、77 、84 天对 4 组试验猪耳静脉采血,分离血清,用猪瘟正向间接凝集诊断试剂盒测定猪瘟抗体。每组试验猪的抗体效价均以各自的几何平均值表示。
2 试验结果与分析
2.1 杂蛋白去除率与无菌检验结果 1组的陶瓷膜是0.80μm,孔径最大,只有大分子杂蛋白被截留除去,所以杂蛋白去除率较低,为63.1%,浓缩除菌收获量最多为10800 m L;3组的陶瓷膜是 0.45 μm,孔径最小,多数杂蛋白被截留除去,所以杂蛋白去除率最高,为79.4%,但浓缩除菌收获量最少,为4700 mL;2组纯化效果介于1组和3组之间。结果见表1。
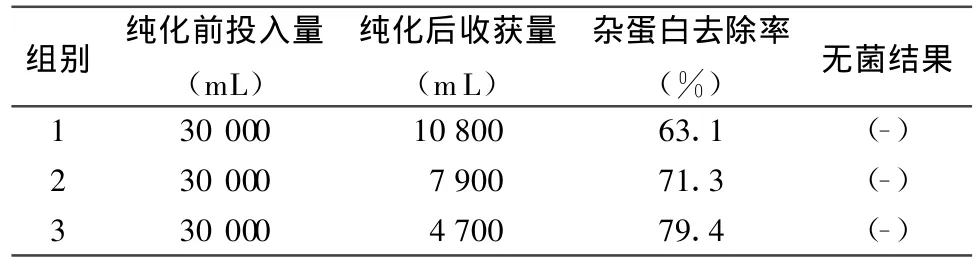
表1 猪瘟疫苗病毒液纯化浓缩杂蛋白去除率与无菌检验结果
2.2 纯化浓缩的猪瘟病毒液冻干前后效力检验、安全检验结果 3组冻干疫苗由于纯化浓缩平均去除杂蛋白达到71.27%,大大减少杂蛋白对最小感染量和安全检验的影响,达到检验一次通过率,全部合格。结果见表2。
2.3 纯化浓缩的猪瘟冻干活疫苗成品免疫抗体检测结果 通过纯化浓缩的冻干活疫苗的免疫和常规疫苗免疫对照试验检测的数据,绘制出抗体消长曲线,结果见图1。3组纯化浓缩的冻干活疫苗免疫28 d时:1组抗体平均升至最高,为8.3log2稀释倍数,平均抗体升高为5.9log2稀释倍数;2组抗体平均升至最高,为8.7log2稀释倍数,平均抗体升高为6.6log2稀释倍数;3组抗体平均升至最高为9.3log2稀释倍数,平均抗体升高为7.2log2稀释倍数;而常规的弱毒冻干活疫苗抗体平均升至最高为6.8log2稀释倍数,平均抗体升高为4.8log2稀释倍数。免疫至84 d时,三组纯化冻干疫苗平均抗体增加8.8log2稀释倍数,比普通猪瘟疫苗平均抗体增加3.9log2稀释倍数,差异极显著(P<0.01)。免疫63~84 d时,三组纯化冻干疫苗抗体滴度仍然高于免疫前水平,而普通常规的冻干疫苗抗体滴度显著下降到免疫前水平。
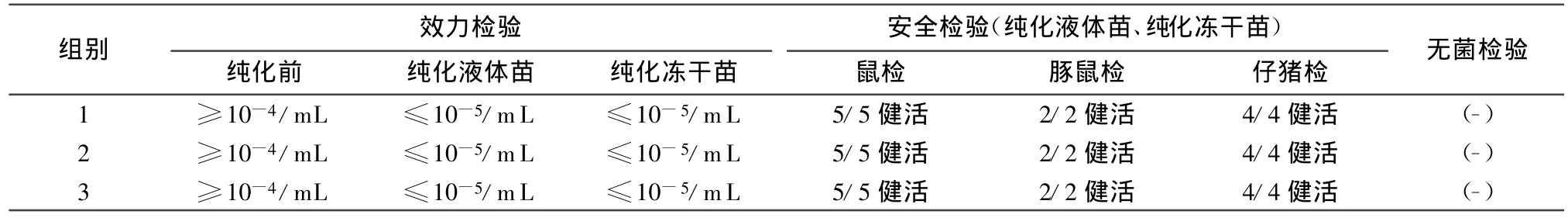
表2 纯化浓缩的猪瘟疫苗病毒液冻干前后效力检验、安全检验结果
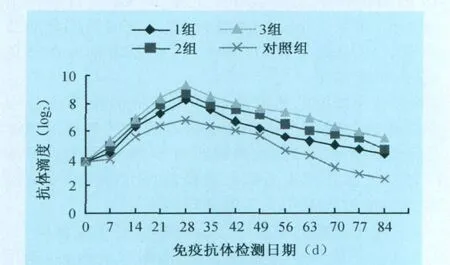
图1 抗体消长曲线
3 讨论
本试验采用不同孔径的微孔滤膜及不同分子量截留值的超滤膜组件,可连续进行杂蛋白的去除纯化、浓缩、除菌操作。而结构完整的猪瘟病毒[9]粒子粒径大小为34~50 nm,正好介于所选陶瓷(有机)膜孔径之间。由结果证明:1组的0.80μm陶瓷膜滤除杂蛋白效果最差,为63.1%,免疫效果比2、3组差,但比常规苗好;2组的0.60μm陶瓷膜滤除杂蛋白效果较好,为71.3%,免疫效果介于1、3组之间;三组的0.45μm陶瓷膜滤除杂蛋白效果最好,为79.4%,免疫效果最好。
陶瓷(有机)膜纯化与浓缩工艺可将效价不合格的猪瘟病毒培养液变成合格的疫苗,提高了疫苗的产量与经济效益,而且纯化浓缩的冻干活疫苗免疫效果显著高于常规的冻干活疫苗免疫效果。从图1的抗体曲线明显看出,三组纯化的冻干活疫苗免疫抗体效价上升快,抗体消长时间比普通常规的疫苗免疫抗体延长达3周左右,其中3组抗体消长效果最好,因为它的纯度最高;1组抗体消长比2组、3组稍差,这说明疫苗的杂蛋白的含量干扰免疫抗体的消长变化。而常规的疫苗抗体消长效果大大低于三组纯化的疫苗免疫效果,充分证明杂蛋白的含量对免疫的影响。
[1] 王金华.猪瘟疫苗注射变态反应1例[J].黑龙江畜牧兽医,2002,3:58-59.
[2] 吴梧桐.生物制药工艺学[M].2版.北京:中国医药科技出版社,2006:325-363.
[3] 姜平.兽医生物制品学[M].2版.北京:中国农业出版社,2003:251-256.
[4] 中华人民共和国农业部.兽用生物制品质量标准[S].北京:中国农业科技出版社,2001:120.
[5] 李明义,刘志军,徐太辉,等.猪瘟组织灭活疫苗与猪瘟弱毒冻干活疫苗免疫效力的比较[J].中国兽医科技,2004,34(4):44-46.
[6] 李明义,白志娟,王莉娟,等.猪瘟灭活疫苗抗体消长规律动态研究[J].中国预防兽医学报,2005,27(5):385-388.
[7] 沈绍新,戴爱玲,李晓华,等.IHA与 ELIS A检测猪瘟病毒抗体的比较[J].动物医学进展,2009,30(9):20-23.
[8] 周相华,韩喜连.猪瘟免疫接种抗体效价检测试验[J].中国动物检疫,2006,23(7):35-36.
[9] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:304-323,652-664.
