siRNA下调TROP-2基因表达对人胰腺癌细胞迁移和侵袭的影响
2011-08-08瞿彩兴
瞿彩兴, 马 圭, 范 钰
近年来,胰腺癌发病率明显增高。肿瘤转移是细胞迁移侵袭的结果,也是导致治疗失败的主要原因。恶性肿瘤的侵袭和转移是一个多阶段多步骤的过程,许多基因共同调控导致其表达产物改变,影响其生物学行为。研究发现,肿瘤相关钙信号传导蛋白-2(tumor-associated calcium signal transducer-2,TROP-2)基因在人胰腺癌组织中高表达,且与癌细胞侵袭有关[1]。但是国内相关的研究甚少,2011年3月—2011年5月,本课题组以胰腺癌CFPAC-1细胞为模型,考察小干扰RNA(small interfering RNA,siRNA)介导的RNA干扰(RNA interference,RNAi)技术对胰腺癌细胞中TROP-2表达、胰腺癌细胞迁移及侵袭的影响。
1 材料与方法
1.1 材料来源 人胰腺癌CFPAC-1细胞株为本院组织细胞生物库冻存。TROP-2基因siRNA购自德国Qiagen公司。RBMI 1640培养液购自美国GIBCO公司;Trizol、RealTime PCR扩增试剂盒和脂质体转染试剂LipofectamineTM2000及逆转录试剂盒购自美国Invitrogen公司;鼠抗人TROP-2及β-actin抗体购自美国Santa Cruz公司;基底膜基质Matrigel购自美国Becton Dickinson公司。
1.2 细胞培养 胰腺癌CFPAC-1细胞在含10%胎牛血清(fetal bovine serum,FBS)的RPMI 1640培养液,37℃、5%CO2、饱和湿度环境的条件下连续培养。待对数生长期时,收取细胞,进行以下试验。
1.3 siRNA转染 借助于 LipofectamineTM2000进行转染,具体操作参照说明书进行。转染前1d,将1.0×105对数期生长的细胞接种于24孔培养板,1 mL/孔,培养过夜,次日进行转染。细胞分组:(1)空白对照组(Con-A)为未经任何处理的胰腺癌细胞;(2)空载对照组(Con-B)为脂质体对照组;(3)siRNA组为10%FBS的RPMI 1640中含不同浓度的已用脂质体包埋的siRNA。
1.4 胰腺癌细胞TROP-2 mRNA水平检测 采用荧光实时定量RT-PCR方法检测。收集细胞,以TRIzol抽提细胞总 RNA,取总 RNA 1 μg,以 oligo dT(15 mer)为引物逆转录合成cDNA第一链,以此cDNA链2 μL为模板进行PCR扩增,步骤参照逆转录试剂盒说明书进行。TROP-2上游引物序列为5'-TCCACTTGTATCATGGCCTACC-3',下游引物序列为:5'-CTCAAAGACATCCAAACTGCGT-3',扩增片段长度111 bp。β-actin上游引物序列为:5'-CACG AAACTACCTTCAACTCC-3',下游引物序列为:5'-CATACTCCTGCTTGCTGATC-3';扩增片段长度262 bp。PCR反应条件为:95℃,预变性3 min,95℃,30 s;52℃,45 s;72℃,45 s;35个循环后,72℃再延伸7 min。反应后生成熔解曲线。TROP-2基因表达值以 2-ΔΔCt表示[2]。
1.5 TROP-2基因蛋白水平检测 采用免疫荧光法检测。将胰腺癌细胞接种到预先放置盖玻片的培养皿中,细胞和盖玻片表面完全吸附后,用PBS洗2次,丙酮固定。PBS振洗后吹干。滴加TROP-2单克隆抗体(1∶1 000)覆盖整个切片,4℃过夜。PBS振洗3次后吹干。滴加1∶50稀释的FITC标记的二抗,37℃保温30 min。PBS振洗2次后用蒸馏水振洗。50%缓冲甘油封片。在荧光显微镜下观察,拍照,荧光强度扫描。
1.6 细胞迁移检测 根据参考文献[3]方法,采用划痕实验(wound-healing Assay)方法检测。将细胞接种于6孔板,以含10%FBS的培养基培养至细胞将近长满,换无血清培养基培养24 h后,以l mL移液器吸头在细胞层仔细划痕,以PBS洗两遍,去除细胞碎片,更换含10%FBS的培养基继续培养20 h,倒置显微镜下对划痕前后的相应区域拍照。实验设3个平行孔,重复3次。倒置显微镜下测量细胞向致伤区迁移的相对距离,根据原始细胞致伤区距离计算出细胞实际迁移距离。
1.7 细胞侵袭检测 根据参考文献[3]方法,采用Boyden小室模型检测癌细胞侵袭能力:Boyden小室上下室之间铺聚碳酸醋微孔滤膜(孔径8 μm),滤膜上包被有Matrigel。用无血清培养基准备单细胞悬液,并调整浓度为2.5×104/mL。细胞以500 μL无血清培养基重悬,接种于培养小室的上层,小室下层加入500 μL含10%FBS的培养基作为趋化物。在37℃,5%CO2,饱和湿度条件下分别培养72 h后,用棉拭子去除上室底部基质胶并移除未侵袭细胞;接着固定 30 min,PBS漂洗 2次;HE染色30min。随机选择5个100倍显微视野,统计视野中的总细胞数,以侵袭细胞的相对数目表示肿瘤细胞的侵袭能力。每组设3个平行样本,取其平均值,进行统计学分析。
2 结果
2.1 siRNA转染对胰腺癌CFPAC-1细胞TROP-2基因mRNA和蛋白水平的影响 定量PCR和免疫荧光结果显示,siRNA转染组细胞TROP-2蛋白水平明显下降,且呈浓度和时间依赖性(P<0.001;P<0.001)。见图1,2。

图1 siRNA转染对胰腺癌CFPAC-1细胞TROP-2基因mRNA水平的影响
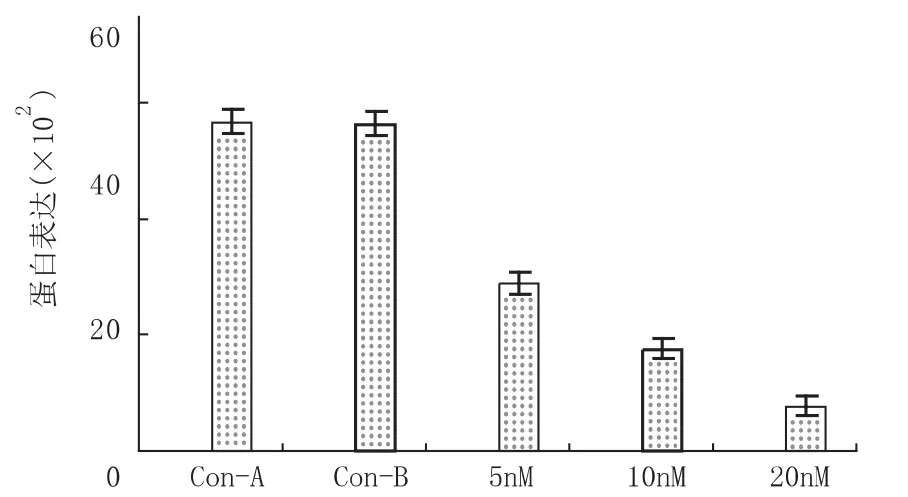
图2 siRNA转染对胰腺癌CFPAC-1细胞TROP-2基因蛋白水平(×102)的影响
2.2 siRNA转染对胰腺癌CFPAC-1细胞迁移的影响 划痕试验结果显示,TROP-2 siRNA转染组迁移距离明显低于对照组(P<0.001)。见图3。
2.3 siRNA转染对CFPAC-1细胞侵袭能力的影响Boyden小室上室细胞穿过膜上matrigel到膜的下室面,其数量反映了细胞侵袭能力的大小。Boyden小室结果显示,与对照组比较,TROP-2siRNA组穿过滤膜的细胞数明显下降,且呈浓度依赖性(P<0.001)。见图 4。

图3 TROP-2基因siRNA转染对胰腺癌细胞迁移的影响

图4 TROP-2 siRNA转染对胰腺癌细胞侵袭的影响
3 讨论
TROP-2亦称为M1S1,是GA733基因家族中的一员,定位在1号染色体短臂D1S2890和D1S2801之间一个长约2.6 cm的区域上[4]。TROP-2是无内含子的基因,所编码的产物为含有323个氨基酸、35.7 kDa的蛋白质,被认为是一种肿瘤相关抗原,其包含一个上皮生长因子样的重复区,一个甲状腺球蛋白样重复区,其分子羟基端含有丝氨酸和酪氨酸位点及PIP-2结合区域,其丝氨酸残端为激酶C所磷酸化。许多学者发现,TROP-2基因在许多实体瘤如大肠癌、肺癌、乳腺癌、食管癌等肿瘤中高表达[5-7],且其高表达与侵袭有关[8-10]。由此提示,TROP-2基因是一种有价值的治疗靶点,但该基因在国内研究甚少。
本研究以胰腺癌CFPAC-1细胞为模型,采用TROP-2基因siRNA转染该细胞后,分别以荧光实时定量PCR和免疫荧光方法检测,结果显示,转染组胰腺癌细胞TROP-2 mRNA和蛋白明显下调,且呈时间和浓度依赖性(P <0.001;P <0.001)。
癌细胞远处转移是一个多因素、多步骤、多阶段的复杂过程。其中细胞迁移及侵袭是关键步骤。本实验通过siRNA下调胰腺癌CFPAC-1细胞中TROP-2的表达,并观察对癌细胞 迁移和侵袭的影响。结果显示,TROP-2基因表达下调后,癌细胞迁移和侵袭力均明显下降,且呈浓度依赖性(P <0.001,P <0.001)。
目前尚不清楚TROP-2基因在恶性肿瘤细胞侵袭中的分子机制,相关研究也较少,有学者发现,TROP-2抗体对胞浆内钙离子水平具有一定的调控作用[11],而蛋白激酶 C(protein kinase C)及钙离子水平在信号传导中发挥着重要作用。
综上所述,为明确TROP-2基因靶向治疗作用,有必要深入研究TROP-2基因的具体分子机制,为今后胰腺癌的诊治提供新思路。
[1] Fong D,Moser P,Krammel C,et al.High expression of TROP2 correlates with poor prognosis in pancreatic cancer[J].Br J Cancer,2008,99(8):1290-1295.
[2] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J].Methods,2001,25:402-408.
[3] Fan Y,Zhang YL,Wu Y,et al.Inhibition of signal transducer and activator of transcription 3 expression by RNA interference suppresses invasion through inducing anoikis in human colon cancer cells[J].World J Gastroenterol,2008,14(3):428-434.
[4] Tsujikawa M,Kurahashi H,Tanaka T,et al.Identification of the gene responsible for gelatinous drop-like corneal dystrophy[J].Nat Genet,1999,21(4):420-423.
[5] Ohmachi T,Tanaka F,Mimori K,et al.Clinical significance of TROP2 expression in colorectal cancer[J].Clin Cancer Res,2006,12(10):3057-3063.
[6] Huang H,Groth J,Sossey-Alaoui K,et al.Aberrant expression of novel and previously described cell membrane markers in human breast cancer cell lines and tumors[J].Clin Cancer Res,2005,11(12):4357-4364.
[7] Nakashima K,Shimada H,Ochiai T,et al.Serological identification of TROP2 by recombinant cDNA expression cloning using sera of patients with esophageal squamous cell carcinoma[J].Int J Cancer,2004,112(6):1029-1035.
[8] Coldren CD,Helfrich BA,Witta SE,et al.Baseline gene expression predicts sensitivity to gefitinib in non-small cell lung cancer cell lines[J].Mol Cancer Res,2006,4(12):521-528.
[9] Mühlmann G,Spizzo G,Gostner J,et al.TROP2 expression as prognostic marker for gastric carcinoma[J].Clin Pathol,2009,62(2):152-158.
[10] Wang JB,Day R,Dong YY,et al.Identification of Trop-2 as an oncogene and an attractive therapeutic target in colon cancers[J].Mol Cancer Ther,2008,7(2):280-285.
[11] Ripani E,Sacchetti A,Corda D,et al.Human Trop-2 is a tumor-associated calcium signal transducer[J].Int J Cancer,1998,76(5):671-676.
