兔脂肪干细胞体外成骨诱导培养及成骨活性鉴定的实验研究
2011-08-07张开刚张月东
张开刚,张月东,王 玫
脂肪干细胞(adipose-derived stem cells,ADSCs)是近年来发现的一种成体干细胞,2001年Zuk等[1]首次从人的脂肪组织悬液中分离出类似于骨髓间充质干细胞,可以在体外稳定增殖,具有多向分化潜能的脂肪干细胞。因具有来源丰富、取材方便、对机体的损伤小、增殖快、能多向分化等优点,迅速成为组织工程学、再生医学等领域的研究热点。本实验通过分离培养兔脂肪干细胞,研究其成骨分化能力,探讨其作为骨组织工程种子细胞的可行性。
1 材料和方法
1.1 材料
1.1.1 主要试剂和仪器 Ⅰ型胶原酶、胰蛋白酶、地塞米松、维生素C、β-甘油磷酸钠(sigma公司,美国);高糖DMEM(Gibco公司,美国);胎牛血清(杭州四季青生物工程材料有限公司);碱性磷酸酶(alkaline phosphatase,ALP)染 色 试 剂 盒 、EDTA、四环素(华美生物工程公司);茜素红(Amersco公司,美国);恒温CO2培养箱(Queue Systems公司,美国);病理切片机(leica公司,德国)。
1.1.2 实验动物 4月龄体重为2.0~2.5 kg的健康新西兰大白兔,雌雄不拘,泰山医学院实验动物中心提供,实验动物生产许可证号:SCXK(鲁)2005-0005。
1.2 方法
1.2.1 ADSCs的分离、培养及传代 4月龄健康新西兰大白兔,经耳缘静脉注射空气栓塞致死,取兔双侧腹股沟脂肪,PBS液冲洗剪碎,Ⅰ型胶原酶法消化,加入高糖DMEM培养液重悬浮,恒温CO2培养箱内培养,隔日换液,融合达90%~95%后倾倒原培养液,PBS液轻缓漂洗贴壁细胞2次,尽量洗去残余血清,弃PBS液。在培养瓶中加入适量消化液(0.20%胰蛋白酶+0.02%EDTA)消化,吸管吸取培养液,反复轻柔吹打培养瓶底壁,使已消化的细胞脱离瓶壁,吹打液1200 r/min离心10 min,弃上清。用培养液将沉积细胞重新悬浮,接种于25 cm2培养瓶中,传代比例为1∶2,倒置相差显微镜下观察细胞形态特征及传代情况。
1.2.2 ADSCs的成骨诱导培养 成骨诱导培养液的配制按文献[2]所述:DMEM培养液+10%胎牛血清+0.l μmo1/L地塞米松+50 mg/L维生素C+10 mmol/L β-甘油磷酸钠+1%双抗(青霉素、链霉素);普通培养液的配制:高糖DMEM培养液+10%胎牛血清+1%双抗(青霉素、链霉素)
取第3代ADSCs,以l×105/cm密度接种于24块盖玻片,置于37℃、体积分数为5%的CO2饱和湿度培养箱内培养。待细胞长满后随机分为2组,其中12片作为成骨诱导组,加入成骨诱导液复合培养,进行成骨诱导分化;其余12块作为对照组,加入普通培养液培养。共培养4周,每72 h换液1次。
1.2.3 ADSCs的鉴定 以下3种染色实验均重复进行3次。
ALP染色:第3代细胞成骨诱导1周后取出盖玻片,PBS洗涤3次,4%多聚甲醛固定15 min,PBS洗涤3次,滴加ALP染色液,蒸馏水反复冲洗3次,晾干后甘油明胶封片、镜检。
茜素红染色:第3代细胞成骨诱导4周后取出盖玻片,洗涤3次,4%多聚甲醛固定15 min,PBS洗涤3次,加入1%茜素红溶液(pH 8.3,Tris-HCl配制),37℃染色30 min,蒸馏水反复冲洗3次,晾干后甘油明胶封片、镜检。
Von Kossa(钙结节)染色:第3代细胞成骨诱导4周后取出盖玻片,洗涤3次,4%多聚甲醛固定15 min,PBS洗涤3次,加入5%硝酸银溶液,避光孵育30 min,紫外线灯下染色1 h,蒸馏水冲洗3次,加入5%硫代硫酸钠作用5 min,蒸馏水冲洗3次,1%中性红复染5 min,蒸馏水反复冲洗3次,晾干后甘油明胶封片、镜检。
2 结果
2.1 ADSCs体外培养的生物学特性
原代ADSCs 8 h开始贴壁,24 h完成贴壁,接种后可见部分悬浮呈圆形的血细胞混杂其中,轮廓清晰,细胞呈短梭形和多角形(图l),5~7 d融合达90%~95%,大约两周内传至第3代,细胞数量扩增200~300倍,绝大多数细胞呈扁平的长梭形,局部排列有一定方向性,呈鱼群状(图2)。
2.2 ADSCs体外成骨诱导及鉴定
2.2.1 ALP染色 培养第3代的ADSCs细胞成骨诱导1周之后进行ALP染色,胞浆内可见蓝色颗粒(图3),而对照组ALP染色呈阴性(图4)。
2.2.2 茜素红染色 培养第3代的ADSCs细胞成骨诱导4周之后进行茜素红染色,细胞结节中央染色为红色团块,细胞结构为紫红色(图5),对组照仅见紫色细胞结构,结节中央未见红色团块染色(图6)。

图1 原代ADSCs呈短梭形(×100)

图2 第3代ADSCs呈扁平长梭形,形成鱼群状(×100)

图3 ALP检测胞浆内可见蓝色颗粒(ALP染色,×200)

图4 对照组ALP染色阴性(ALP染色,×200)
2.2.3 Von Kossa染色 培养第3代的ADSCs细胞成骨诱导4周后行Von Kossa染色,细胞集落中央区形成明显的钙化结节,细胞结节中央为黑色团块(图7),对照组则无黑色团块形成(图8)。
3 讨论
干细胞是一种具有多向分化潜能和自我复制能力的原始未分化细胞,是构建组织工程骨重要的种子细胞来源。根据来源不同,干细胞可分为胚胎干细胞(embryonic stem cell,ESC)和成体干细胞(adult stem cell,ASC)。ASC存在于人体各种组织中,具有自我更新和分化成多种组织(骨、软骨、脂肪、神经)的能力,正常生理情况下干细胞多处于G0期或缓慢向G1期转化[3]。在研究领域,许多人和动物不同部位来源的ASC已得到分离和鉴定[4-6]。脂肪干细胞(ADSCs)是近年来发现的一种成体干细胞,与骨髓间充质干细胞类似,有多向分化潜能,可以在体外稳定增殖。因其具有安全性高[7]、获得率高等优点,故迅速成为目前组织工程学的研究热点。有文献指出,ADSCs接种12~24 h后细胞可达到完全贴壁,传代培养后增殖迅速,能稳定传代10代左右,故此可为组织修复提供充足的种子细胞[8-9]。亦有研究证实,ADSCs成骨培养后,细胞外基质中出现Ⅰ型胶原蛋白、BMP-2、BMP受体等[10-11]成骨基因表达产物。本实验对兔皮下脂肪进行分离培养,结果显示,兔ADSCs贴壁迅速,细胞呈短梭形和多角形,传代后细胞增殖迅速,具有成骨分化潜能。
研究显示,ADSCs的体外分离及培养所应用的消化酶、消化方法并不完全相同[12-13],由于成熟脂肪基质中含有大量Ⅰ型胶原,因此本实验采用Ⅰ型胶原酶消化法分离ADSCs,用培养基重悬细胞后接种到培养瓶中,通过细胞贴壁获得ADSCs。
关于ADSCs的鉴定,目前尚未发现特异性表面分子标志物。本实验通过观察细胞的形态并绘制生长曲线,发现此细胞具有稳定、迅速的增殖能力,符合干细胞的生物学特点;而在脂肪干细胞分离、纯化过程中的一些混杂细胞如红细胞、内皮细胞、成纤维细胞等,尽管很难一次性彻底清除,但数量很少,约占细胞群的5%~20%,这些细胞大部分不能贴壁生长,增殖能力有限,随传代培养其数量逐渐减少。需要强调的是,在ADSCs运用过程中,选择合适时机、提高纯度是首要问题。本实验选择在倒置相差显微镜下观察判断:一般以细胞突起回缩、细胞间隙增大、细胞近乎缩成圆形为度,此时应立即吸出消化液,加入含有血清的培养液,终止消化,以保证消化的纯度。
本研究通过反复3次试验证实,第3代ADSCs在成骨诱导培养下,1周时通过ALP染色检测,胞浆内可见蓝色颗粒,表明细胞在诱导1周时已具有成熟成骨细胞的特点;4周时茜素红染色检测,细胞结节中央染色为红色团块,细胞结构为紫红色,显示细胞已形成钙盐沉积,进入矿化期;4周时钙结节染色检测,细胞集落中央区形成明显的钙化结节,大量钙盐沉积,表明细胞进入基质矿化期。而对照组培养的细胞均无相应变化。
本实验虽在体外提取出兔脂肪干细胞并进行成骨诱导培养,但对于脂肪干细胞的鉴定未进行更明确的指标测定。下一步研究希望能够利用脂肪干细胞与支架材料复合,构建新型仿生性材料,并进一步开展其在修复骨质缺损方面的动物实验研究。

图5 细胞结节中央为红色团块(茜素红染色,×40)

图6 对照组细胞结节中央未见红色团块(茜素红染色,×40)
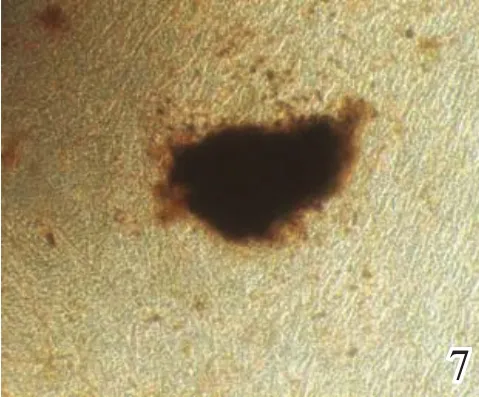
图7 细胞结节中央为黑色团块(Von Kossa染色,×40)

图8 对照组细胞结节中央无黑色团块(Von Kossa染色,×40)
[1]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[2]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
[3]Yannaki E,Papayannopoulou T.Stem cells have an identity crisis[J].Haema,2001,4(3):158-166.
[4]Morasso MI,Tomic-Canic M.Epidermal stem cells:the cradle of epidermal determination,differentiation and wound healing[J].Biol Cell,2005,97(3):173-183.
[5]Berninger B,Hack MA,Gotz M.Neural stem cells:on where they hide,in which disguise,and how we may lure them out[J].Handb Exp Pharmacol,2006,174:319-360.
[6]Casteilla L,Planat-Benard V,Laharrague P,et al.Adiposederived stromal cells:Their identity and uses in clinical trials,an update[J].World J Stem Cells,2011,3(4):25-33.
[7]Tobita M,Orbay H,Mizuno H.Adipose-derived stem cells:current findings and future perspectives[J].Discov Med,2011,11(57):160-170.
[8]李传将,王万明.兔脂肪组织来源干细胞体外生长特性及培养的适宜条件[J].中国组织工程研究与临床康复,2009,13(19):3685-3688.
[9]张胜利,邓展生,李宝军,等.大鼠脂肪间充质干细胞的成骨分化[J].中国组织工程研究与临床康复,2007,11(6):1022-1024.
[10]Jung H,Kim HH,Lee DH,et al.Transforming growth factor-beta 1 in adipose derived stem cellsconditioned medium is a dominantparacrine mediator determines hyaluronic acid and collagen expression profile[J].Cytotechnology,2011,63(1):57-66.
[11]Shoji T,Ii M,Mifune Y,et al.Local transplantation of human multipotentadipose-derived stem cellsaccelerates fracture healing via enhanced osteogenesis and angiogenesis[J].Lab Invest,2010,90(4):637-649.
[12]Kim DH,Je CM,Sin JY,et al.Effect of partial hepatectomy on invivo engraftment after intravenous administration of human adipose tissue stromal cells in mouse[J].Microsurgery,2003,23(5):424-431.
[13]王燕,陈光辉,邵建华,等.大鼠脂肪组织源性间充质干细胞的分离及向心肌细胞的诱导分化[J].山东大学学报:医学版,2005,43(7):578-581.
