纳米混悬剂研究概况及在药物中的应用*
2011-08-06汤丽华
汤丽华,易 涛
澳门科技大学,中药质量研究国家重点实验室;澳门药物及健康应用研究所,澳门 0853
提高溶解度和生物利用度是研究难溶性药物的重要课题,是药剂现代化亟待解决的问题。运用现代技术并结合材料(辅料)的不同性质,将难溶性药物制成不同剂型,从而提高难溶性药物的溶解度和生物利用度。目前,采用共溶剂增溶技术,环糊精包合技术,乳剂、微乳及固相分散技术,微粉化,促渗透剂和固体脂质纳米粒等都能提高难溶性药物的生物利用度。但这些方法存在一定的局限性,如共溶剂存在有机溶剂毒副作用、配伍时药物析出等问题;环糊精包合技术对药物分子的大小有特殊要求等;乳剂分散技术则要求药物在油相中有较高的溶解度等;微粉化技术只是增加了药物的溶出速度而没有增加药物的溶解度等;固体脂质纳米粒载药量低,物理状态复杂以及在储存和使用过程中不稳定等。纳米混悬剂作为一种制剂技术,不仅适用于水难溶性化合物,同时适用于油难溶的化合物。纳米混悬剂能提高药物的溶解度和生物利用度,为解决难溶性药物制剂的制备提供了新的思路和方法。
1 纳米混悬剂研究概况
纳米混悬剂(nanosuspension),是 20世纪末发展起来的一种新型纳米给药系统。纳米混悬剂是由纯药物粒子加入少量表面活性剂作为稳定剂,在分散介质中高度分散,形成亚微粒交替分散系统,粒径一般在10~1000 nm。纳米混悬剂作为中间体,能制成不同剂型。目前,纳米混悬剂主要的给药途径是口服给药、注射给药、吸入给药等。口服给药的药物粒径小,比表面积大,载药量高,能增加药物吸收速率,提高生物利用度;对黏膜的黏附性较强,可延长胃肠道滞留时间。注射给药的药物载药量高,表面活性剂含量较少,安全性较高;粒径较小避免阻塞毛细血管;避免了首过代谢,且可靶位给药。吸入给药的药物粒径小,有较强的生物黏附性;对肺泡巨噬细胞靶向给药,增加呼吸道的药物吸收[1-2]。
2000年由Wyeth公司生产的西罗莫司(Rapamune)是第一个上市的纳米混悬剂产品。目前美国已上市的药物有阿瑞吡坦(Emend)、醋酸甲地孕酮等;白消安(Busulfan)、银、磷酸钙、布地奈德(Budesonide)、紫杉醇(Abraxane)等已处于临床研究(见表 1)[3]。
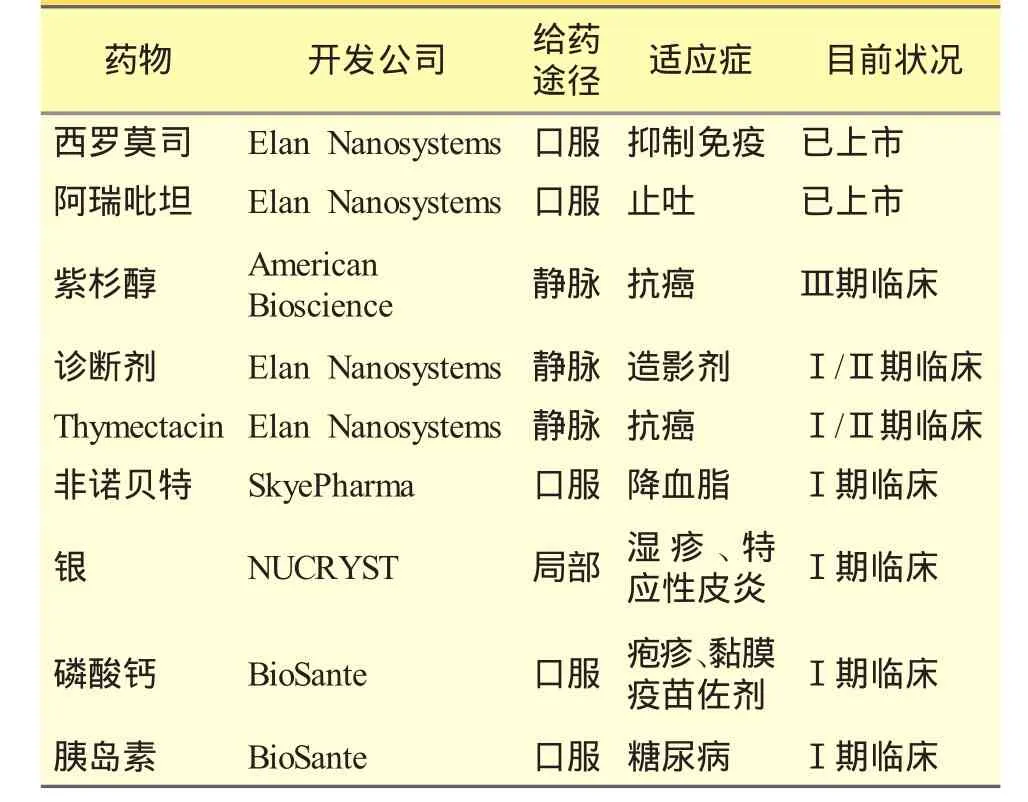
表1 已上市和开发中的纳米混悬剂制剂[2]
2 纳米混悬剂的制备方法
纳米混悬剂的制备主要是有两个途径:将溶液中药物分子聚集形成纳米范围粒径的结晶(Bottomup technologies)和将大颗粒药物结晶分散到纳米范围内(Top-up technologies)[4]。 纳米混悬剂的制备方法主要有沉淀法(Precipitation)、媒介研磨法(Media milling)、高压均质法 (High pressure homogeniza tion)、乳化法(Emulsification)、超临界流体色谱法(Super critical fluid chromatography)等(见图 1),此外喷雾干燥、冻干等技术也在研究中[5]。

图1 纳米混悬剂制备方法的流程图[6]
2.1 沉淀法
沉淀法是将难溶性的药物溶于一种有机溶剂中,然后在搅拌下加到能混溶的非溶剂中,使药物迅速达到过饱和而析出细小颗粒,形成胶体分散体。沉淀法分为两步:一是结晶核的形成;二是结晶核的生长。通过控制搅拌速率、非溶剂-溶剂的体积比、药物含量和温度等参数可获得粒径大小合适且均一的混悬液。该技术的优点是程序简单,仪器便宜,易于大规模生产。缺点是药物必须溶于至少一种溶剂,而这溶剂与非溶剂互溶;药物结晶的生成受表面活性剂的限制。目前,市场上有用沉淀法制备的纳米结晶产品,例如Soliqs(Ludwigshafen,Germany)公司的NanoMorph®技术。
2.2 高压均质法
高压均质法主要有两种方法:微射流技术(Microfluidisation)和活塞空隙均质法(Piston-gap homogenination)。微射流技术基于喷气气流原理,药物混悬液和表面活性剂以高速通过特定形态的匀浆腔时,粒子径因碰撞和剪切作用力而减小[7]。活塞空隙均质法可使用水性介质或有机溶剂-水的混合介质,通过高压泵将药物混悬液和表面活性剂倒入可调缝隙的均质阀中,瞬间降压的物料以极高的流速喷出,碰撞在阀组件的碰撞环上,产生剪切、撞击和空穴3种效应,达到细化和均质的作用[8]。这种技术在20世纪90年代由Muller等创造的,商标为DissoCubes®,最近公布为Skyephram有限公司拥有专利[9]。
高压均质法的优点是适用于多种药品;能制成极稀和高浓度的纳米混悬剂;技术简单;可无菌生产;生产污染低。缺点是大量同质化周期;先决条件是在药物微粒状态和同质化前的混悬形成;产品可能由于均质机壁上的金属离子而受污染。
2.3 媒介研磨法
经典的Nanocrystals®技术采用珠或珍珠研磨达到粒径减小。研磨媒介、分散介质、稳定剂和药物倒进研磨腔。由球磨珠运动和研磨介质产生的剪切力,使粒子的粒径减小。决定粒子粒径的因素是研磨珠的运动程度、研磨介质的大小和研磨温度等。该技术的优点是易于大规模生产;批次间的变化少;可处理大量药品。缺点是研磨媒介残留;研磨费时;长期的研磨可导致非结晶形成而不稳定。
2.4 乳化法
乳化法制备纳米混悬剂是首先将药物溶解于不与水混溶的有机溶剂中制成O/W型乳剂,即乳滴内相包裹难溶性药物;然后通过各种方式(如:减压蒸馏、超声破碎、匀质化、微流化、对流匀质等)使有机溶剂挥发,药物析出。通过控制乳滴大小可得到药物粒子的纳米混悬剂[10]。乳化法只适用于一些有机溶剂能溶解的药物,不能用于水溶性和有机溶剂溶解性均差的药物,且该法不可避免地存在着有机溶剂残留和后处理问题,对环境污染较大[11]。
2.5 其他方法
超临界流体快速膨胀法(RESS)是利用超临界流体对难溶性药物的高溶解性,当超临界流体状态迅速膨胀到低压、低温的气体状态时,溶质的溶解度急剧下降,致使其迅速成核和生长成为微粒[12]。
3 纳米混悬剂在药物中的应用与评价
国外从20世纪末就开始对纳米混悬剂进行研究,国内近几年有关的研究也相继增多,特别在药物的研究应用受到广泛关注。针对具有较好药理作用但其有效成分的溶解度低及口服生物利用度低的中药,结合纳米混悬剂的制备方法和特点,医药学者对药物纳米混悬剂的研究报道越来越多,以下是对部分药物的纳米混悬剂进行阐述。
3.1 水飞蓟素
水飞蓟宾是从菊科植物水飞蓟的果实中提取出来的黄酮木脂类化合物,能较好地治疗急慢性肝炎、肝硬化和中毒性肝损伤,但其水溶性极差,口服生物利用度低。赵晓宇[13]等采用沉淀法制备水飞蓟素纳米混悬剂,以5%甘露醇作为冻干载体制备混悬剂冻干粉。其粒径为100~300 nm,3个月内粒径没有明显的改变,证明其纳米混悬剂的稳定性较好;在pH3~8水溶液中水飞蓟宾的含量无变化。水飞蓟素纳米混悬剂相关的体外释药、体内分布及生物利用度等评价在实验研究中。汪巍等[14]通过自微乳化和高速分散法相结合制备水飞蓟宾纳米混悬剂,用冷冻干燥法制成水飞蓟宾纳米混悬剂冻干粉,考察其在大鼠体内的药动学行为。水飞蓟宾纳米混悬剂的平均粒径为(268.90±9.20)nm。水飞蓟宾纳米混悬剂改变了水飞蓟宾在大鼠体内的药物动力学行为,水飞蓟宾溶液剂及纳米混悬剂的体内消除半衰期 (t1/2) 分别为 (3.05±0.06)h和 (6.14±0.42)h,延长其在体内作用时间,提高了载药量,且理化性质稳定,表面活性剂用量少,安全性能高。
3.2 冬凌草甲素
冬凌草甲素为唇形科香茶菜属植物冬凌草的主要活性成分,为贝壳杉烯二萜类化合物,由于其水溶性差,体内半衰期短等,其应用受到一定限制。Gao等[15]采用高压均质法将冬凌草甲素制成纳米结晶,粒径大约为322.7 nm。冬凌草甲素片48 h的溶解度为(99±2)μg·mL-1,其纳米混悬剂在 4 h 内的浓度为(170±10)μg·mL-1,即纳米混悬剂显著增加了其饱和溶解度和溶出速率。
3.3 紫杉醇和多烯紫杉醇
紫杉醇系从红豆杉属植物中分离得到的一种具有独特抗癌作用的二萜类化合物,由于其水溶性差而限制了其临床应用。李学明等[16]采用重结晶结合高压均质法制备紫杉醇纳米混悬剂,其粒径为214.4 nm,与紫杉醇注射液相比较,紫杉醇纳米混悬剂在小鼠肝、脾、脑组织中的药物含量显著增加,相对于一般剂型,纳米混悬剂更容易透过血脑屏障进入脑组织;在心脏、肾脏的浓度降低,减小了紫杉醇对心脏和肾的毒性。多烯紫杉醇是在对紫杉醇结构改造过程中合成出来的紫杉醇衍生物,其为水难溶性药物,是广谱、强效抗癌药,临床应用的注射液引起严重的过敏反应。李林穗等[17]采用沉淀-高压均质法制备多烯紫杉醇纳米混悬剂,平均粒径为(184±80)nm,药物浓度达到 5 mg·mL-1,其饱和溶解度为20.4μg·mL-1,是药物粗颗粒的 3.15 倍;并进行理化性质考察,48 h的体外累计溶出百分率是药物粗颗粒的3倍以上,提高了制剂的生物安全性,可供静脉注射使用。
3.4 姜黄素
姜黄素是姜科植物姜黄的主要活性成分,可抑制肿瘤细胞的生长,且抗癌谱广、毒副作用小,但其不稳定、水溶性差、生物利用度低。张华等[18]采用溶剂蒸发技术制备姜黄素白蛋白纳米混悬剂,体系中白蛋白既作为载体又作为冻干保护剂,其平均粒径为245.2 nm,考察其体外释药性能,由于纳米粒的高度分散性和巨大的表面积,提高了姜黄素的溶出速率,72 h体外累计释药率为96%。
3.5 灯盏花素
灯盏花素是从菊科飞蓬属植物短亭飞蓬灯盏细辛中提取的黄酮类混合物,主要用于治疗脑供血不足、脑出血所致后遗症、冠心病、心绞痛等。但其在Beagle 犬口服的绝对生物利用度仅为(0.40±0.19)%[19]。佘佐彦等[20]采用自乳化溶剂扩散工艺制备灯盏花素纳米混悬剂。用超滤法测定其溶解度和溶出度,进行了灯盏花素纳米混悬剂及粗混悬剂大鼠体内的药动学研究。结果表明,灯盏花素纳米混悬剂的粒径为 (293.11±55.86)nm,溶出度和溶解度显著增加;大鼠灌胃绝对生物利用度从(1.3±0.9)%提高到(14.4±3.7)%。
3.6 槲皮素
槲皮素是一种天然的黄酮类化合物,化学名为3,3’,4’,5,7-五羟基黄酮, 广泛分布于多种植物中,具有扩张冠状动脉、抗炎、抗氧化、抗肝癌等药理作用。其难溶于水,药物溶出、吸收受限制,生物利用度低。Sun等[21]采用沉淀法和高压均质法制备槲皮素的纳米混悬剂,其平均粒径为393.5 nm,槲皮素的纳米混悬剂的溶出度是原药粉的70倍,溶解度也有所增加。
4 结 语
纳米混悬剂在中药中的应用越来越广泛,特别对难溶性中药制成纳米混悬剂有较多的优势。药物制成纳米结晶能提高药物溶解度,增加药物的溶出速率;增加物理稳定性,避免Ostwald熟化;处方中表面活性剂的含量很少,提高药物制剂的安全性;增加药物颗粒表面积,增加与胃肠道生物膜的黏附性,从而延长了药物在胃肠道的滞留时间和吸收时间;减少药物的用药量;提高药物制剂的稳定性;作为一种中间体,可制成不同剂型如片剂、胶囊、丸剂、注射剂及气雾剂等;通过控制纳米混悬剂中药物颗粒的粒径和/或进行表面修饰,实现靶向给药等。
虽然纳米混悬剂的优点很多,但是在中药中的应用存在一些问题。如中药的成分复杂,作用多效性,现在的研究学者只是对中药中有效成分(单一成分)进行研究,没有发现学者对中药复方制备成纳米混悬剂进行研究;有待研究纳米混悬剂贮存过程中的晶体生长的物理稳定性问题;制备过程中介质与设备的溶蚀、脱落的污染等问题需解决。
[1]朱建芬,吴祥根.纳米混悬剂的制备方法及在药剂学中应用的研究进展 [J].中国医药工业杂志,2006,37(3):196-200.
[2]熊若兰,陆伟根.纳米混悬剂研究进展[J].世界临床药物,2007,28(2):117-21.
[3]Keck CM,Müller RH.Drug nanocrystals of poorly soluble drugs produced by high pressure homogenization[J].Eur J Pharm Biopharm,2006,6(2):3-16.
[4]王懿睿,杜 光.难溶性药物纳米混悬剂制备工艺及其应用[J]. 中国医院药学杂志,2007,27(11):1573-6.
[5]MoschwitzerJ,MullerRH.New method forthe effective production of ultrafine drug nanocrystals[J].J Nanosci Nanotechnol,2006,6(9/10):3145-53.
[6]Patil Sonal A,Rane Bhushan R,Bakliwal Sunil R,et al.Nano suspension:at a glance[J].Int J Ph Sci,2011,3(1):947-60.
[7]张 熹,金 方.纳米结晶在难溶性药物口服给药中的应用[J]. 中国医药工业杂志,2009,40(11):851-5.
[8]艾秀娟,陈建海,平 渊,等.高压均质技术在纳米制剂制备中的应用[J]. 医药导报,2007,26(9):1055-8.
[9]Patravale VB,Date AA,Kulkarni RM.Nanosuspension:a promising drug delivery strategy[J].J Pharm Pharmacol,2004,56(7):827-40.
[10]王懿睿,杜 光.难溶性药物纳米混悬剂制备工艺及其应用[J]. 中国医院学杂志,2007,27(11):1573-6.
[11]孙晓革.纳米混悬剂及其制剂研究进展[J].中国药业,2010,19(13):84-6.
[12]陈 莉,汤 忞,陆伟根.纳米混悬剂粒径稳定性及其控制策略[J]. 世界临床药物,2010,31(4):245-9.
[13]赵晓宇,王国华,张保献,等.水飞蓟素纳米混悬剂冻干粉的制备及表征 [J].中国中药杂志,2009,34(12):1503-8.
[14]汪 巍,赵 暖,栾立标,等.水飞蓟宾纳米混悬剂的制备及大鼠体内药动学研究 [J].抗感染药学,2009,6(3):153-7.
[15]Gao L,Zhang DR,Chen MH,et al.Preparation and characterization ofan oridonin nanosuspension for solubility and dissolution velocity enhancement[J].Drug Dev Ind Pharm,2007,33(12):1332-9.
[16]李学明,程晓丹,王永禄,等.紫杉醇纳米混悬剂的制备及其在动物体内药动学与组织分布研究 [J].中国药学杂志,2011,46(9):680-5.
[17]李林穗,王东凯.静脉注射多烯紫杉醇纳米混悬剂的制备及性质考察[J].中国新药杂志,2010,19(17):1613-20.
[18]张 华,张良珂,袁 佩,等.姜黄素白蛋白纳米混悬剂的制备和体外释药研究 [J].中国中药杂志,2011,36(2):132-5.
[19]操 锋,郭健新,平其能,等.灯盏乙素脂类前药的合成、理化性质及降解研究 [J].药学学报,2006,41(7):595-602.
[20]佘佐彦,柯 学,平其能,等.灯盏花素纳米混悬剂的制备及其大鼠体内药物动学研究 (英文)[J].中国天然药物,2007,5(1):50-5.
[21]Sun M,GaoY,PeiY,etal.Developmentof nanosuspension formulation for oral delivery of quercetin[J].J Biomed Nanotechnol,2010,6(4):325-32.
