γ-聚谷氨酸生产的影响因素及其应用
2011-08-05朱丹邹水洋
朱丹 邹水洋
(东莞理工学院 化学与环境工程学院,广东东莞 523808)
γ-聚谷氨酸 (poly-γ-glutamic acid,简称γ-PGA) 是由L-谷氨酸或D-谷氨酸通过γ-酰胺键结合形成的一种水溶性的生物高分子材料。由枯草芽孢杆菌发酵生产的γ-PGA的结构式如下[1]:
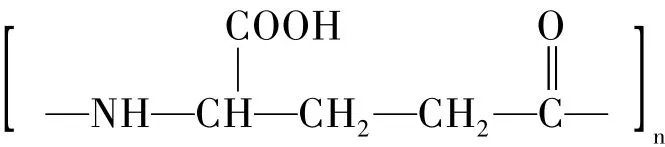
图1 γ-PGA的结构式
γ-PGA最早发现于1913年,是一些芽孢杆菌荚膜结构的主要成分,随后1937年Ivãnovics等发现了炭疽芽孢杆菌的荚膜含有γ-PGA,而自从1942年Bovamick等发现γ-PGA作为种发酵产物能自由地分泌到枯草芽孢杆菌的生长培养基中后,人们发现多种芽孢杆菌都能在胞外产生γ-PGA[2]。
其分解温度为235.8℃,熔点为223.5℃。由芽孢杆菌产生的γ-PGA的平均分子量在1×105~8×106之间,而多分散性在2~5之间。相对分子量越大,其流变性很难控制也很难被化学试剂修饰,因而限制了γ-PGA的应用。目前用水解法、降解法及生物降解法,可得到不同分子量的γ-聚谷氨酸[1]。
1 γ-PGA的生产方法
γ-PGA的生产方法有以下四种:化学合成法、提取法、酶转化法和微生物发酵合成法。前三种方法工艺较复杂,成本高,不适合实际生产应用[3-4]。利用传统菌株进行微生物发酵合成 γ-PGA是最常用的方法。自γ-PGA被发现以来,众多学者相继开展了γ-PGA高产菌株的选育、代谢途径、发酵工艺、分离提纯以及应用的研究,但迄今为止仍处于实验室阶段,小试生产方法归纳起来主要有分批发酵法、连续发酵法、液体两相发酵法、搅拌罐反应器自循环发酵法、固体发酵法和固定化酶法等,分批发酵法简单方便,易操作和控制,周期较短,因此在实验室研究中较为广泛[3]。党建宁等则研究了补料分批发酵方式对聚谷氨酸产量的影响,在较低玉米糖化液、氮源、前体物浓度条件下进行全组分补料,结果比分批发酵方式的γ-PGA产量提高了43.1%(质量分数)[5]。本课题组利用纳豆芽孢杆菌进行液态与固态发酵生产γ-PGA的系列研究,并达到了较高的生产水平 (研究结果另文发表)。
1.1 γ-PGA的主要生产菌株
γ-PGA的生产菌主要是芽孢杆菌属的菌株,包括各种 (纳豆)枯草芽孢杆菌 (Bacillus subtilis)、地衣芽孢杆菌 (B.licheniformis)、炭疽芽孢杆菌 (B.anthracis)。根据细胞生长的营养要求是否需要 L-谷氨酸,可以把γ-PGA生产菌分为两大类:一类是培养时需要 L-谷氨酸才能积累 γ-PGA;一类是培养时不需要 L-谷氨酸也能积累 γ-PGA[1,6-7]。主要菌种如表1所示。

表1 γ-PGA的主要生产菌株
1.2 碳源对生产γ-PGA的影响
作为微生物生长所必需的物质,碳源是微生物生长的碳架和能量来源,且能通过某种代谢途径转化成谷氨酸参与γ-PGA的合成。PGA生产菌所需的碳源约是所合成的PGA总量的2~20倍[2]。Goto和Kunioka报道枯草芽孢杆菌IFO3335生产γ-PGA时,柠檬酸是最佳的碳源。Gross和同事们用地衣芽孢杆菌ATCC9945a生产γ-PGA,柠檬酸也作为最佳碳源。徐虹等研究枯草芽孢杆菌NX-2生产γ-PGA时添加的多种碳源,在有葡萄糖或者蔗糖存在的条件下,γ-PGA产量很高,达到约30 g/L。乳糖对NX-2生长有好处,但对于γ-PGA的产生没有作用。甘油也是一种很好的碳源。当添加了30 g/L的甘油,就能积累24.3 g/L γ-PGA。但有趣的是,NX-2不能利用柠檬酸作为碳源生产γ-PGA,推测NX-2是缺少了一些糖合成途径的酶,所以它不能在TAC循环中利用柠檬酸作为细胞生产的碳源,γ-PGA合成系统也不能形成,因此,没有γ-PGA产生[8]。张艳丽等用纳豆芽孢杆菌QY-09生产γ-PGA时也添加了不同种类的碳源,结果以葡萄糖为碳源时,γ-PGA的产量最高,且葡萄糖浓度在10~50 g/L范围内,γ-PGA的产量随葡萄糖浓度增加而增加,但是葡萄糖浓度进一步增加,产量会降低且出现多糖副产物[9]。
1.3 L-谷氨酸对生产γ-PGA的影响
γ-PGA产生菌有两种,L-谷氨酸依赖型和L-谷氨酸非依赖型,但是文献中报道的最多的仍然是以L-谷氨酸依赖型作为生产实用菌。在这些菌株中,谷氨酸的作用是不同的。对于枯草芽孢杆菌MR-141,谷氨酸作为原料合成γ-PGA,但对于IFO3335,在γ-PGA合成途径中,谷氨酸则作为激活酶而不是原料。徐虹等研究NX-2生产γ-PGA时L-谷氨酸的作用,发现缺少谷氨酸时,没有γ-PGA产生。γ-PGA数量的增加随着培养基中添加的谷氨酸的量的增加而增加。奇怪的是γ-PGA中的谷氨酸单体和残留在发酵液中的谷氨酸的总量比添加的谷氨酸要多的多,γ-PGA的产量也超过葡萄糖转变而来的谷氨酸的总量。从这个结果可以推断在γ-PGA中的谷氨酸单体有两个来源:一是培养基中参与合成的谷氨酸,另一个来源是葡萄糖经糖酵解和三羧酸循环合成的谷氨酸[8]。
1.4 氮源对生产γ-PGA的影响
氮源能提供细胞原生质和其他结构物质中的氮素,因此合适的氮源对γ-PGA的发酵生产也具有重要作用。张艳丽等经过研究发现酵母膏为氮源时γ-PGA的产量最高,蛋白胨次之,但从经济角度考虑选定蛋白胨为氮源[9]。
1.5 pH值对生产γ-PGA的影响
pH值对细胞的生长及γ-PGA的生产都是一个重要的环境因子。经研究发现γ-PGA的产量取决于胞内谷氨酸盐的含量,而增加胞内谷氨酸盐的一个有效的途径就是增加胞外谷氨酸盐的利用率,谷氨酸盐的转化系统对pH值也很敏感。因为整个发酵过程不能总是保持最佳pH值,并且细胞生长和培养基的利用所需的最佳pH值不同,所以吴群等用枯草芽孢杆菌CGMCC 0833生产γ-PGA时,采用了两个阶段的pH值移位控制战略。在最初的24 h,pH值控制在7.0以获得最大生物量,然后pH值降为6.5以获得谷氨酸盐的高转化率和γ-PGA的高产[10]。
1.6 金属离子对生产γ-PGA的影响
金属离子是微生物正常代谢所必不可少的一类营养物质,它在维持参与γ-PGA的合成过程中的酶的活性中心构象以及保持酶的活性中有重要作用。张艳丽等研究了金属离子对纳豆芽孢杆菌QY-09生产γ-PGA的作用,发现适量的金属离子对合成γ-PGA有促进作用,且该菌株对MgSO4的浓度变化最敏感[9]。梁金钟等研究发现,Ca2+、Na+、Mg2+、K+、Mn2+等离子对枯草芽孢杆菌 B-115生产 γ-PGA合成酶系都有着极其重要的影响[11]。可见对于金属离子的添加不但要考虑对γ-PGA生产的影响,还要考虑对菌株生长的影响。同时,他们还发现适量的氨基酸、有机酸和维生素等添加物也能提高 γ-PGA的产率[12]。
1.7 发酵时间对生产γ-PGA的影响
发酵时间也是生产γ-PGA时要考虑的一个因素。因为γ-PGA是一种可生物降解的水溶性分子,以γ-PGA作为唯一碳源和氮源对可降解γ-PGA的菌株进行筛选,结果筛选出至少12株可降解 γ-PGA的菌株[13]。由此发酵过程中要把握发酵生产的时间,以免时间过长导致γ-PGA被降解。
1.8 NaCl的添加对生产γ-PGA的影响
在自然环境中,产生γ-PGA是纳豆芽孢杆菌对环境缺水的一种适应机制,环境缺水的重要信号往往是外界环境渗透压的提高。李大力等[14]在发酵液中添加浓度小于50 g/L的 NaCl时,纳豆芽孢杆菌产γ-PGA的产量有显著提高,分子量分布加大,但分子结构没有改变。
2 γ-PGA的分离提纯
通过微生物发酵得到高黏度的发酵液,γ-PGA可使用有机溶剂沉淀法、化学沉淀法和膜分离沉淀法等方法获得。
2.1 有机溶剂沉淀法和化学沉淀法
有机溶剂沉淀法是指利用离心或凝聚菌体的方法除去发酵液中的菌体,在上清液中加入低级醇类(如甲醇、乙醇)来沉淀得到 γ-PGA,经冷冻干燥得到白色结晶。而化学沉淀法是用饱和的 CuSO4、NaCl溶液代替低级醇类盐析沉淀γ-PGA[3]。发酵结束后,发酵液为淡黄色黏稠状液体,具有很高的黏度,给菌液分离带来一定的难度,所以需要对发酵液进行预处理,即通过将发酵液调为酸性降低其黏度,以便菌液分离。
2.2 膜分离沉淀法
有机溶剂沉淀法会消耗大量的有机溶剂,为了节省有机溶剂的用量,Do等对原工艺进行了改进,发明了一种有效的手段从高粘性的培养液中分离和提取多聚谷氨酸的方法。这种方法分为2个步骤:首先将发酵液pH调至3,当使黏度降为原发酵液的1/6时,进行离心,使离心能量降为原来的17%后,将去菌液pH回调至5,用中空纤维膜进行超滤,使发酵液由原来的20 g/L浓缩到60 g/L,并将提取所需的乙醇用量减少到原用量的1/4,从而大幅度降低了成本[3]。但这种调节pH值的方法因为加酸或加碱处理发酵液都会使 γ-PGA的分子结构发生改变,降低分子量[15],所以只适用于生产低分子量的产物。
2.3 离子交换法
目前,利用离子交换法提取纯化的γ-PGA研究比较少见,但20世纪80年代以来,国内外对离子交换层析法提取有机酸的研究很多[16],现时该法最为广泛地应用于氨基酸分离纯化。由于γ-PGA主链上有大量游离羧基存在,因此笔者认为采用阴离子交换树脂进行离子交换层析来纯化γ-PGA值得研究。
3 γ-聚谷氨酸的应用
γ-聚谷氨酸被广泛用于医药、食品加工、农业、绿化以及水处理等多种领域,具有极大的开发价值和应用前景。
3.1 γ-PGA在医药中的应用
γ-PGA具有良好的生物可降解性和生物亲和性,其降解产物能通过正常的新陈代谢或被机体吸收利用或被排处体外,因此可作为药物载体提供药物缓释性和靶向性。例如γ-PGA作为抗肿瘤药物的载体,Cell Therapeutics公司开发的聚谷氨酸紫杉醇PG-TXL(CT-2103),是通过天然紫杉醇和谷氨酸多聚体共价结合形成的,具有良好的水溶性,显示出了比不溶性紫杉醇更显著的抗肿瘤活性[1]。γ-PGA作为生物粘合剂可用于控制组织的持续性渗血或密封气体和机体内液体的渗漏,也可用于大动脉切割的修补,是一种新型、安全无害的生物胶带[17]。
3.2 γ-PGA在食品中的应用
在淀粉类食品中加入γ-PGA可以防止食品老化,增强质地,维持外形。还用作冰淇凌的稳定剂、果汁的增稠剂、各种食品的苦味祛除剂、保健食品、安定剂或作为添加剂改善口感。γ-PGA还能增加细胞内和细胞外 Ca2+的可溶性,促进Ca2+在肠内的吸收[17]。
3.3 γ-PGA在日用品和化妆品中的应用
在化妆品药典上,γ-PGA的国际命名是:纳豆胶 (Natto Gum)。γ-PGA水胶为无色无味透明柔软胶质,由于其三度空间的格子结构,具有高超的吸水和缓释能力。因此γ-PGA可作为化妆品支持材料、皮肤保湿剂、表皮因子缓释剂、天然美容面膜等。利用γ-PGA还可生产一种新型护发液,这种护发液涂抹在头发表层,形成薄膜不仅能防止头发内水分蒸发,而且其中的黏性成分还能发挥类似胶水的作用,修复即将脱落的毛鳞片[17]。
3.4 γ-PGA在农业中的应用
由于γ-PGA的生物可降解性和高吸水性,向人们展示了其在固沙植被领域的广阔应用前景。日本九州大学农学系教授袁敏夫等人,以日本的纳豆丝 (聚谷氨酸)为原料,开发出了一种吸水性极强的纳豆树脂 (可吸自重5000倍的水),从而使沙漠及缺水地区绿化有了理想的种子包衣材料。只要用这种树脂把植物种子包起来,在沙漠及缺水地区种植,可以很快发芽,效果十分理想。在肥料、杀虫剂、除草剂、驱虫剂等使用时,加入适量的聚谷氨酸盐可以延长这些药物在作用对象表面的停留时间,不易因干燥、下雨而被冲刷掉[17]。
3.5 γ-PGA在水处理中的应用
水处理剂中常采用絮凝技术,这是一种处理效率高、经济又简便的物化处理技术。其中聚丙烯酰胺(简称PAM)及其衍生物是有机合成高分子絮凝剂的典型代表。PAM本身没有毒性,但聚合单体丙烯酰胺不仅具有强烈的神经毒性,而且是强致癌物质。现在许多国家和领域已禁止或限量使用此类絮凝剂。具有强吸水性的可降解天然高分子材料γ-PGA得到了人们的关注[18]。
3.6 γ-PGA在其他领域中的应用
γ-PGA是一种阴离子物质,经研究发现其结合的金属包括:Ni2+、Cu2+、Mn2+、Cr3+等。Bhattacharyya等报道用廉价微生物滤膜共价连接γ-PGA后具有很高的吸收重金属的能力[1]。研究指出γ-PGA的羧基经酯化后可作为极好的热塑性塑料。而γ-PGA和α-苯甲酯能形成纤维素和膜,具有极好的力度、透明度和弹性[2]。
4 结语
目前,日本、韩国和美国等一些国家对γ-PGA发酵的研究已经处于世界领先水平,很多相关的生产工艺和技术已形成专利。其中,日本明治制果公司已实现了γ-PGA商业化生产,并逐步推广其应用[19]。而我国近几年才注意到γ-PGA的重要性,在聚合氨基酸的研究开发尚处于起步阶段,只有少数科研单位进行聚氨基酸的研究和开发,且研究的深度和广度等均与国外有较大差距,研究工作仅限于实验室,离产业化有较大距离,因此,建立完整、系统、大规模的γ-PGA的微生物生产方法是今后亟待解决的课题之一。笔者认为,在培养基方面,可以用一些替代性培养基或利用废液来替代目前传统的培养基,以达到增加产量降低成本的目的。因为γ-PGA吸水性强,不利于脱水和回收利用,而且γ-PGA在水中带负电荷,只能吸附正电荷的物质,目前在应用上γ-PGA作为絮凝剂的研究大部分都是单独使用,限制了γ-PGA的絮凝作用。所以可以对γ-PGA进行改性,使其带上部分正电荷,应用范围更广。
[1]刘晓鸥,李睿颖,徐勇虎,等.聚谷氨酸的生物合成及应用前景[J].食品工程,2009(1):23-26.
[2]陈咏竹,孙启玲.γ-多聚谷氨酸的性质、发酵生产及应用[J].微生物学通报,2004,31(1):122-126.
[3]黄金,陈宁.聚谷氨酸的性质与生产方法[J].氨基酸和生物资源,2004,26(4):44-48.
[4]石峰.微生物制备γ-聚谷氨酸的研究[D].浙江:浙江大学生物工程研究所,2006.
[5]党建宁,梁金钟.γ-多聚谷氨酸摇瓶补料分批发酵的研究[J].食品与发酵科技,2009,45(4):42-51.
[6]Ito Y,Tanaka T,Ohnachi T.Glutamic Acid Independent Production of Poly(γ-glutamic acid)by B.subtilis TAM-4[J].Biosci Biotechnol Biochem,1996,60:1239-1242.
[7]Cheng C,Asada Y,Aaida T.Production of γ-Poly Glutamic Acid by Bacillus subtilis A35 under Denitrifyling Conditions[J].Agric Biol Chem,1989,53:2369-2375.
[8]Xu Hong,Jiang Min,Li Hui,et al.Efficient production of poly(γ-glutamic acid)by newly isolated Bacillus subtilis NX-2[J].Process Biochemistry,2005,40(2):519-523.
[9]张艳丽.γ-聚谷氨酸的产生菌分离鉴定及其生物合成条件的研究[D].青岛:青岛大学,2009.
[10]Wu Qun,Xu Hong,Ouyang Pingkai.Kinetic analysis and pH-shift control strategy for poly(γ-glutamic acid)production with Bacillus subtils CGMCC 0833[J].Biochemical Engineering Journal,2010,50:24-28.
[11]梁金钟,王风青.微生物发酵法合成高分子聚合物γ-PGA的研究[J].北京工商大学学报:自然科学版,2011,29(1):24-29.
[12]王宏丽,梁金钟.添加物对枯草芽孢杆菌γ-聚谷氨酸合成代谢的影响[J].生物加工过程,2010,8(1):45-49.
[13]Shi Feng,Xu Zhinan,Cen Peilin.Microbial production of natural poly amino acid[J].Science in China Series B:Chemistry,2007,50(3):291-303.
[14]李大力,詹长娟,郄丽,等.盐浓度对纳豆芽孢杆菌发酵产γ-聚谷氨酸影响的研究[J].化学与生物工程,2007,24(2):50-51.
[15]惠明,田青,张彬,等.pH值对聚谷氨酸发酵液粘度及聚合物结构的影响[J].食品与发酵工业,2006,32(10):5-8.
[16]何炳林,钱庭宝.树脂在生化物质分离纯化上的应用[J].氨基酸杂志,1982(3):21-44.
[17]李晶博,李丁,邓毛程,等.γ-聚谷氨酸的特性、生产及应用[J].化工进展,2008,27(11):1789-1799.
[18]王虹.γ-聚谷氨酸及其在水处理中的应用[J].化工时刊,2009,23(2):59-61.
[19]陆树云.γ-聚谷氨酸的生物合成及提取工艺研究[D].南京:南京工业大学,2006.
