COPD基因和基因组学研究进展
2011-08-02罗自强中南大学湘雅医学院生理学系湖南长沙4003
虢 毅 邓 昊 罗自强 (中南大学湘雅医学院生理学系,湖南 长沙 4003)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)是一种以气流受限为特征的慢性气道疾病,气流受限不完全可逆,呈进行性发展,包括肺气肿、慢性支气管炎和末梢气道疾病。COPD位居常见病死亡原因第四位,WHO报导2030年COPD将成为世界第三大致死疾病〔1〕。COPD发病机制复杂,与多个基因变异及环境因素相互作用有关〔2〕。吸烟是COPD的主要环境危险因素,然而重度吸烟者仅10% ~20%发病,且少数终生不吸烟者患COPD〔3〕,故COPD具有内在遗传易感性。人类基因组计划和国际人类基因组单体型图项目(HapMap)完成,以及后基因组新技术开展使COPD遗传研究取得了一定进展。本文就COPD基因和基因组学最新研究进展作一综述。
1 候选基因研究(candidate genes study)
该方法主要通过病例对照和家系研究检测涉及COPD的病理生物学途径基因,并鉴定疾病的遗传风险因素。但仅能研究功能较清楚的、对COPD发生有促进或抑制作用的基因,而未涉及大量未知功能的基因。
基于对COPD病理遗传机制理解,目前研究的候选基因主要是参与水解和抗水解、氧化和抗氧化、炎症反应、有毒物质代谢、气道高反应性和主动防御机制等的基因〔2,3〕。普遍公认的COPD候选基因是酯酶抑制剂1基因(protease inhibitor 1,PI;又称α1-抗胰蛋白酶基因或SERPINA1)。PI基因位于14q32.1,编码丝氨酸蛋白酶抑制剂,抑制蛋白水解来保护肺,约1% ~2%的COPD是由α1-抗胰蛋白酶遗传缺陷所引起〔4〕。PI变异可增加COPD患病风险6~50倍,是目前报道的最高风险〔5〕。
人类未鉴定基因(Human Unidentified Gene-Encoded,HUGE)蛋白质数据库中共有94个基因和89个代谢通路与COPD表型相关,427个哮喘相关基因中有35个与COPD相关。表1总结了至少有3篇阳性文献的COPD候选基因。绝大多数相关性研究重复性较差,类似其他复杂人类疾病〔6〕。Hersh等通过家系研究和病例对照研究12个COPD相关基因29个变异,发现表面蛋白B基因的Thr131Ile变异、血红素氧合酶基因启动子短串联重复(GT)、肿瘤坏死因子(tumor necrosis factor,TNF)启动子变异-308G>A、微粒体环氧化物酶基因“快”等位基因型 His139Arg与 COPD 相关〔7〕。
Smolonska等对近20年来COPD候选基因研究文献进行数据分析,发现仅5个变异〔3个转化生长因子β1(TGFβ1)变异、谷胱甘肽转移酶(GSTM1)无效等位基因和白介素1受体拮抗剂基因(IL1RN)串联重复数目变异〕与 COPD显著相关〔8〕。Castaldi等对涉及72个基因的COPD病例对照研究文献进行meta 分 析,仅 TGFβ1 rs1800470、GSTM1 Null allele、SOD3 rs1799896和TNF rs1800629与COPD显著相关〔9〕。出现结果不一致的原因有人群差异(表型定义差异、正常对照或COPD亚型和/或种族差异)、人群分层、多重检测、抽样误差或样本数小、缺乏效力、数据解释不正确、基因分型错误和遗传覆盖不全等。遗传和环境异质性也会造成实验结果不一致〔2,3〕。
2 全基因组连锁分析(Genome-wide linkage analysis)
全基因组连锁分析的目标是确定疾病易感基因的染色体区域。该方法不需要疾病或表型的生物学先验知识,并可得到染色体区间进行基因精细定位。但COPD为迟发性疾病,具有家系数据收集复杂性。目前全基因组连锁研究主要探讨气道阻塞的基因位点,大多集中在肺通气功能测量,而不是COPD本身。
相关主要连锁研究包括两个健康人群(弗雷明汉心脏研究和国家心脏、肺、血液研究所家系心脏研究)和两个COPD患者人群(波士顿早发型COPD研究和犹他州遗传家系研究)〔2,3〕。研究中发现与第1秒用力呼气量/用力肺活量(FEV1/FVC)比率最强烈连锁证据分别在4号和2号染色体长臂。两个健康人群的连锁分析主要确定了染色体6q、21p和4p上的强烈的连锁信号以及18号染色体上的暗示性连锁信号。波士顿早发型COPD研究资料主要用于确定相关位点,对参与研究的72个家系585成员进行了四次全基因组筛查。第一次发现12q、19和22号染色体与COPD相关。第二次发现2q与FEV1/FVC比率相关。第三和四次研究中,使用后支气管舒张值FEV1/FVC和最大气流量(FEF)25%~75%等指标,发现2q和12p与早发型COPD强相关。犹他州遗传家系研究也在染色体2q和5q观察到FEV1/FVC的暗示性连锁的标记。随后Celedon等应用额外标记精细定位了染色体19q区域〔10〕。进一步研究在总计4个独立的人群证实SERPINE2与COPD表型显著相关,其中大部分 SNP位于染色体2q上观察到的连锁信号区域〔11,12〕。因此SERPINE2被视为定位克隆确定的第一个COPD易感基因。但Chappell等在更高检测效力的病例对照研究中无法重复此结果〔13〕。
一些研究者进行了后续研究以寻找疾病或易感基因。COPD相关基因大量报道是由于基因组中海量基因和大量易感位点的发现。疾病表型基因虽然处于连锁峰下,但主要是这些基因凑巧在与疾病表型连锁的染色体区域被发现,遗传变异能否解释连锁信号仍然未知。少数基因处于连锁峰可作为最可能的候选基因而被研究。Hersh等最近对波士顿早发型COPD研究确定的染色体2q上连锁区域进行精细定位和人群扫描,鉴定DNA双链断裂修复基因(X-ray repair,complementing defective,in Chinese hamster 5,XRCC5)为 COPD 易感基因〔2,3,14〕。COPD病因学中影响蛋白酶和抗蛋白酶之间的平衡是一个长期的假设,在弗雷明汉心脏研究确定了染色体6q上的强烈的连锁信号〔2,3,15〕,因此位于 6q 的第二信使操纵钙通道蛋白(the secreted modular calcium-binding protein 2,SMOC2)基因可考虑为COPD候选基因。Wilk等发现SMOC一些单核苷酸多态性(SNP)和单体型与肺功能相关,但SMOC变异无法解释染色体6q上观察到的强烈连锁信号〔16〕。染色体19q13上TGFβ1 SNP在两个独立的人群中均与COPD表型相关,同样也没有证据表明TGFβ1遗传变异造成连锁峰〔10〕。
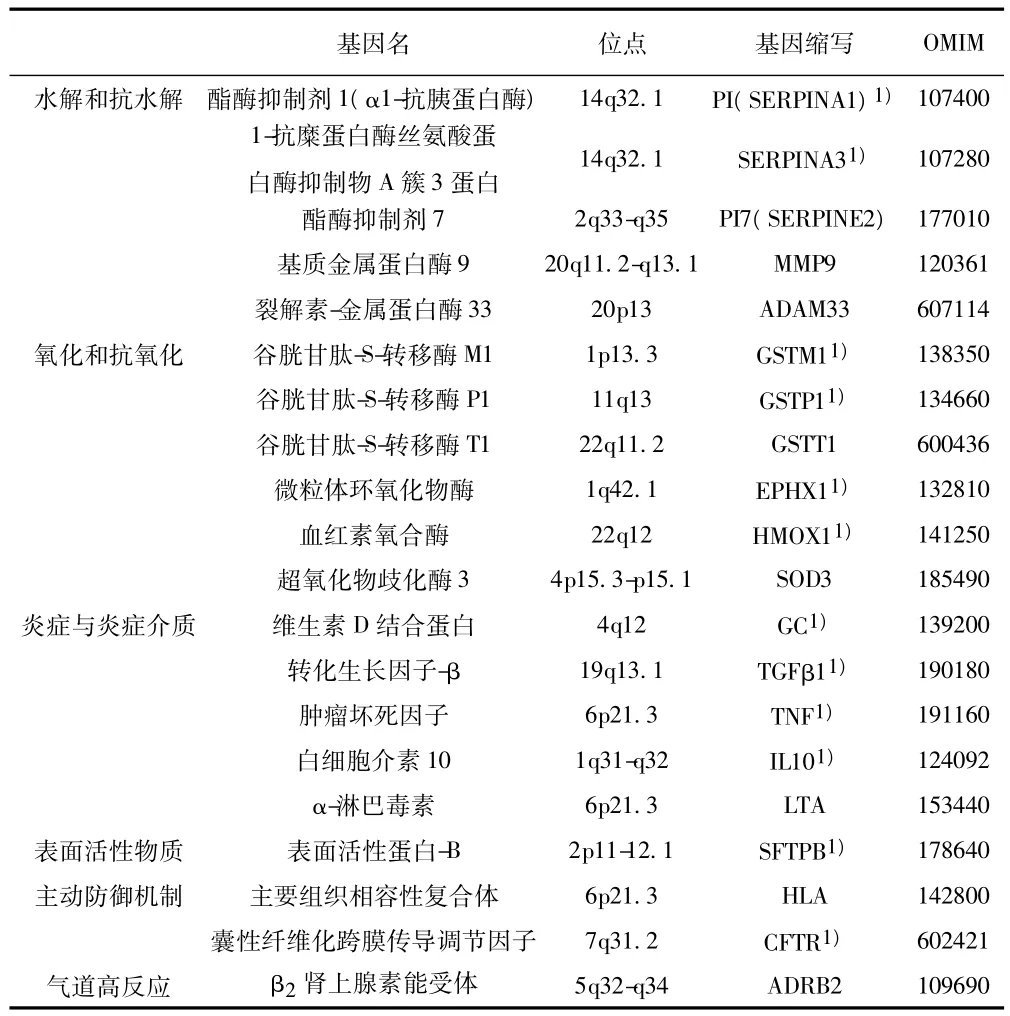
表1 COPD候选基因(发表阳性报道数至少3篇)〔3,4〕
气流阻塞是哮喘患者的主要特点,哮喘和COPD是不同的病理生理过程并且机制不明。哮喘和COPD气道对阻塞的贡献难以量化,但导致气流受限有可能存在共同的基因。在哮喘家系中应用全基因组扫描已鉴定与肺功能连锁的位点,包括中国家系中16p和10p、法国家系中6q和21q、荷兰家系中2q、澳大利亚家系中20q和12q以及哥斯达黎加家系中5p〔2〕,可能涉及COPD发病。
3 全基因组关联研究(genome-wide association studies,GWAS)
人类基因组计划和HapMap的完成使复杂疾病遗传学的GWAS成为现实。候选基因和家系连锁的研究受限于感兴趣的基因组区域,而GWAS对整个基因组成千上万个SNP研究,以确定那些与疾病症状同时出现的SNP。GWAS作为一种复杂疾病遗传研究新方法已取得一定进展,如年龄相关性黄斑变性、糖尿病、克罗恩病和哮喘等〔17,18〕。
目前GWAS仅2篇文献涉及COPD,但有4篇文献涉及肺通气功能(COPD重要表型)。Pillai等首次对来自挪威823个COPD患者和810个吸烟对照进行分析,发现15号染色体上一个SNP(rs8034191)与COPD显著相关,这一结果在其他三个研究人群得到验证。另一位于4号染色体上Hh相互作用蛋白(hedgehog interacting protein,HHIP)基因也与FEV1/FVC相关,可能是 COPD重要风险位点〔19,20〕。rs8034191附近有多个基因,其中包括几个烟碱型乙酰胆碱受体的亚基(CHRNA3和CHRNA5)和铁结合蛋白(iron-binding protein,IREB2)〔19〕。最近有三个独立的报告报道这个位点也与肺癌易感性相关,并且与周边血管疾病和尼古丁成瘾相关,暗示此位点也许因为吸烟而与COPD和肺癌都相关〔20〕。第二次对3个人群2 940个COPD患者和1380个对照GWAS发现4q22.1位点多肽荧光标记(family with sequence similarity 13,member A,FAM13A)基因与COPD相关〔21〕,结果在最近关于肺功能的 GWAS中得到证实〔22〕。FAM13A可能在信号转导方面有一定作用。对Pillai等报道的CHRNA3-CHRNA5-IREB2位点和HHIP基因进行了基因分型未发现统计学差异〔19,21〕。
前两次肺功能的GWAS均在弗雷明汉心脏研究中心进行。第一次研究涉及10种肺量测定法和70 987个常染色体SNP。依据全基因组显著性严格标准,未发现SNP与肺功能表型相关。然而,还是支持一些已报道的COPD相关基因,如CFTR、SOD3和GC基因。但这些候选基因中SNP覆盖率特别低,作为证据并不理想〔23〕。第二次研究包括7 691名参与者,主要研究表型为FEV1/FVC〔24〕。人群研究中4q的4个SNP与FEV1/FVC显著相关,其中一个SNP在家系研究中也与FEV1/FVC相关。同一区域的SNP在三个独立人群研究中也显示与COPD相关的证据〔19〕。几个最强烈相关的SNP位于4q31,与HHIP基因接近,但是该区域的功能性变异未鉴定。未发现弗雷明汉人群与CHINA 3/5区域显著相关。Hancock等对4个组群20 890个欧洲后裔多个GWAS结果进行数据分析,对吸烟状态进行人群分层,发现8个与FEV1/FVC相关的基因位点(HHIP、GPR126、ADAM19、AGER-PPT2、FAM13A、PTCH1、PID1和 HTR4),1 个与 FEV1 相关的位点 INTS12-GSTCD-NPNT〔22〕。最近一次肺功能GWAS确定了5个新的肺功能相关位点和候选基因:4q24(GSTCD)、2q35(TNS1)和5q33(HTR4)与FEV1相关,6p21(AGER和DAMM2)和15q23(THSD4)与FEV1/FVC相关〔25〕。此并未观察到CHRNA3-CHRNA5-CHRNB4位点与吸烟暴露、肺癌、肺道上皮疾病和 COPD 相关〔19,25〕。
COPD GWAS处于起步阶段,统计学上最可能相关是4号和15号染色体〔19〕。GWAS可提供更大的分辨率和更大的能力来找到共同的易感性变异〔18〕,COPD和COPD相关表型(肺通气功能等)的GWAS的研究可能为COPD病理生理学提供新的思路。
4 基因表达研究(gene-expression studies)
全基因组表达研究能同时分析数千基因和/或基因簇的基因表达模式,筛选可能的COPD候选基因。人类COPD肺组织的全基因组表达研究很少,各研究在样本类型、实验设计以及数据分析方法等方面均有所差别。对4个人类COPD肺组织的全基因组表达研究结果进行分析,发现在单个研究中鉴定的基因在生物学意义上高度重叠,但表达差异的基因大多不能重复〔26〕。Steiling等总结文献中COPD气道基因和MicroRNA的表达差异,提出气道基因表达差异可深化COPD临床表型异质性的理解〔27〕。Bhattacharya等在有或无COPD的群组分析中鉴定了220个基因,它们在肺组织的表达与COPD相关表型相关〔28〕,而另一基因表达研究中,表达差异性可作为吸烟者中重度COPD与轻微或无COPD的生物学标记〔29〕。
吸烟可造成遍布整个呼吸道的上皮细胞的“分子损害区域”,因此有一些研究集中在正常和COPD吸烟者的气道上皮细胞基因表达图谱。气道上皮基因表达反应了吸烟的宿主反应和损害程度,这些研究可能促进对COPD发病相关进程的了解〔20〕。Pierrou等在正常和有COPD的吸烟者支气管气道中鉴定了200个氧化应激相关基因的差异表达〔30〕,其中很多曾发现在COPD肺组织中差异表达〔29,30〕。DeMeo等检测了 COPD相关的889个SNP,发现15q25.1上IREB2(iron regulatory protein 2)基因变异与COPD显著相关,COPD肺组织标本中mRNA和蛋白表达增加〔31〕。Tilley等发现Notch通路基因在吸烟COPD患者小气道细胞中下调〔32〕。
总之,人类基因组计划和Hap Map完成提供了全基因组水平上研究COPD遗传机制的平台。COPD遗传学研究在过去几年取得了一定进展,候选基因研究、全基因组连锁分析和全基因组关联研究都是剖析COPD遗传机制的重要手段,但COPD气道和肺组织的全基因组表达研究较少。候选基因和全基因组研究的整合最终将产生一个全面的COPD分子蓝图,从而对COPD发病机制提供新的思路,促进病理遗传学治疗靶点鉴定和临床应用。
1 World Health Organization(WHO).Global burden of disease:2004 update〔Internet〕.Geneva:WHO;2008(accessed 2010 June 10)pp.23.Available from:http://www.who.int/healthinfo/global_burden_disease/2004_report_update/en/index.html.
2 Bossé Y.Genetics of chronic obstructive pulmonary disease:a succinct review,future avenues and prospective clinical applications〔J〕.Pharmacogenomics,2009;10(4):655-67.
3 Seifart C,Plagens A.Genetics of chronic obstructive pulmonary disease〔J〕.Int J Chron Obstruct Pulmon Dis,2007;2(4):541-50.
4 Ganrot PO,Laurell CB,Eriksson S.Obstructive lung disease and trypsin inhibitors in alpha-1-antitrypsin deficiency〔J〕.Scand J Clin Lab Invest,1967;19(3):205-8.
5 Chappell S,Daly L,Morgan K,et al.Cryptic haplotypes of SERPINA1 confer susceptibility to chronic obstructive pulmonary disease〔J〕.Hum Mutat,2006;27(1):103-9.
6 Lohmueller KE,Pearce CL,Pike M,et al.Meta-analysis of genetic association studies supports a contribution of common variants to susceptibility to common disease〔J〕.Nat Genet,2003;33(2):177-82.
7 Hersh CP,Demeo DL,Lange C,et al.Attempted replication of reported chronic obstructive pulmonary disease candidate gene associations〔J〕.Am J Respir Cell Mol Biol,2005;33(1):71-8.
8 Smolonska J,Wijmenga C,Postma DS,et al.Meta-analyses on suspected chronic obstructive pulmonary disease genes:a summary of 20 years'research〔J〕.Am J Respir Crit Care Med,2009;180(7):618-31.
9 Castaldi PJ,Cho MH,Cohn M,et al.The COPD genetic association compendium:a comprehensive online database of COPD genetic associations〔J〕.Hum Mol Genet,2010;19(3):526-34.
10 Celedon JC,Lange C,Raby BA,et al.The transforming growth factor-β(TGFβ1)gene is associated with chronic obstructive pulmonary disease(COPD)〔J〕.Hum Mol Genet,2004;13(15):1649-56.
11 DeMeo DL,Mariani TJ,Lange C,et al.The SERPINE2 gene is associated with chronic obstructive pulmonary disease〔J〕.Am J Hum Genet,2006;78(2):253-64.
12 Zhu G,Warren L,Aponte J,et al.The SERPINE2 gene is associated with chronic obstructive pulmonary disease in two large populations〔J〕.Am J Repir Crit Care Med,2007;176(2):167-73.
13 Chappell S,Daly L,Morgan K,et al.The SERPINE2 gene and chronic obstructive pulmonary disease〔J〕.Am J Hum Genet,2006;79(1):184-6.
14 Hersh CP,Pillai SG,Zhu G,et al.Multistudy fine mapping of chromosome 2q identifies XRCC5 as a COPD Susceptibility Gene〔J〕.Am J Respir Crit Care Med,2010;182(5):605-13.
15 Wilk JB,DeStefano AL,Joost O,et al.Linkage and association with pulmonary function measures on chromosome 6q27 in the Framingham Heart Study〔J〕.Hum Mol Genet,2003;12(21):2745-51.
16 Wilk JB,Herbert A,Shoemaker CM,et al.Secreted modular calciumbinding protein 2 haplotrpes are associated with pulmonary function〔J〕.Am J Respir Crit Care Med,2007;175(6):554-60.
17 Manolio TA,Brooks LD,Collins FS.A HapMap harvest of insights into the genetics of common disease〔J〕.J Clin Invest,2008;118(5):1590-605.
18 Hirschhorn JN,Daly MJ.Genome-wide association studies for common diseases and complex traits〔J〕.Nat Rev Genet,2005;6(2):95-108.
19 Pillai SG,Ge D,Zhu G,et al.A genome-wide association study in chronic obstructive pulmonary disease(COPD):identification of two major susceptibility Loci〔J〕.PLoS Genet,2009;5(3):1-8.
20 Silverman EK,Spira A,Paré PD.Genetics and genomics of chronic obstructive pulmonary disease〔J〕.Proc Am Thorac Soc,2009;6(6):539-42.
21 Cho MH,Boutaoui N,Klanderman BJ,et al.Variants in FAM13A are associated with chronic obstructive pulmonary disease〔J〕.Nat Genet,2010;42(3):200-2.
22 Hancock DB,Eijgelsheim M,Wilk JB,et al.Meta-analyses of genome-wide association studies identify multiple loci associated with pulmonary function〔J〕.Nat Genet,2010;42(1):45-52.
23 Wilk JB,Walter RE,Laramie JM,et al.Framingham Heart Study genome-wide associateion:results for pulmonary function measures〔J〕.BMC Med Genet,2007;8(suppl 1):s8.
24 Wilk JB,Chen TH,Gottlieb DJ,et al.A genome-wide association study of pulmonary function measures in the Framingham Heart Study〔J〕.PLoS Genet,2009;5(3):1-8.
25 Repapi E,Sayers I,Wain LV,et al.Genome-wide association study identifies five loci associated with lung function〔J〕.Nat Genet,2010;42(1):36-44.
26 Zeskind JE,Lenburg ME,Spira A.Translating the COPD transcription:insights into pathogenesis and tools for clinical management〔J〕.Proc Am Thorac Soc,2008;5(8):834-41.
27 Steiling K,Lenburg ME,Spira A.Airway gene expression in chronic obstructive pulmonary disease〔J〕.Proc Am Thorac Soc,2009;6(8):697-700.
28 Bhattacharya S,Srisuma S,Demeo DL,et al.Molecular biomarkers for quantitative and discrete COPD phenotypes〔J〕.Am J Respir Cell Mol Biol,2009;40(3):359-67.
29 Spira A,Beane J,Pinto-Plata V,et al.Gene expression profiling of human lung tissue from smokers with severe emphysema〔J〕.Am J Respir Cell Mol Biol,2004;31(6):601-10.
30 Pierrou S,Broberg P,O'Donnell RA,et al.Expression of genes involved in oxidative stress responses in airway epithelial cells of smokers with chronic obstructive pulmonary disease〔J〕.Am J RespirCrit Care Med,2007;175(6):577-86.
31 DeMeo DL,Mariani T,Bhattacharya S,et al.Integration of genomic and genetic approaches implicates IREB2 as a COPD susceptibility gene〔J〕.Am J Hum Genet,2009;85(4):493-502.
32 Tilley AE,Harvey BG,Heguy A,et al.Down-regulation of the notch pathway in human airway epithelium in association with smoking and chronic obstructive pulmonary disease〔J〕.Am J Respir Crit Care Med,2009;179(6):457-66.
