丹参酮ⅡA抑制大鼠心室成纤维细胞增殖的机制
2011-08-02孙红霞北华大学医学院吉林吉林3203
于 静 孙红霞(北华大学医学院,吉林 吉林 3203)
心肌纤维化(MF)表现为心室成纤维细胞(CFb)过度增殖和分泌大量胶原纤维,引起间质纤维化并参与心室重塑。近年来文献报道,一氧化氮(NO)等生物活性物质与MF的发生发展密切相关〔1〕。研究还证实氧化还原反应参与了 MF的形成〔2〕。丹参酮ⅡA(TanshinoneⅡA,TSN)是常用的活血化瘀中药丹参的提取物,具有抑制CFb增殖和间质纤维蛋白分泌作用〔3〕。本实验在细胞水平上观察 TSN对血管紧张素Ⅱ(AngⅡ)诱导CFb增殖,以及对羟脯氨酸(Hyp)、NO水平、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量的影响,探讨其抑制MF的作用机制。
1 材料与方法
1.1 材料与细胞 TSN(中国药品生物制品检定所生产,编号110766-200416);胰蛋白酶,宝泰克生物试剂;AngⅡ、四氮唑盐(MTT)、碘化丙啶均为Sigma公司产品;NO试剂盒为南京建成生物技术公司产品;IMDM培养基购自HyClone Utah公司;胎牛血清(FCS),杭州四季青;Heraeus型CO2培养箱;SUNRISE TECAN FO39300型自动酶联检测仪(澳大利亚);EPICS-ProfileⅡ型流式细胞分析仪。日本Olympus倒置显微镜;超净工作台。出生1~3 d的Wistar大鼠心室,胰酶消化,收集细胞,置于含100 ml/L FCS的IMDM培养液中,在50 ml/L CO2、37℃、饱和湿度条件下培养60~90 min。采用差速贴壁法分离CFb,加入含100 ml/L FCS的IMDM继续培养。经倒置显微镜、透射电镜、免疫组化纤维黏连蛋白染色阳性和平滑肌肌动蛋白染色阴性鉴定为所需的CFb,纯度达98%,生长近融合时按1∶3传代,实验采用2~4代细胞。
1.2 分组 分5组,对照组:含有IMDM的培养液;AngⅡ组:培养液中加入终浓度为10-7mol/L的AngⅡ;TSN组1:培养液中同时加入10-7mol/L TSN和10-7mol/L AngⅡ;TSN组2:培养液中同时加入10-6mol/L TSN和10-7mol/L AngⅡ;TSN组3:培养液中同时加入10-5mol/L TSN和10-7mol/L AngⅡ。
1.3 MTT比色法测定CFb的增殖活力 各组细胞接种于96孔培养板,每组细胞9复孔,各处理组作用36 h。于培养结束前4 h加入5 g/L MTT 10 μl,待形成蓝紫色的结晶沉淀后加入二甲基亚砜(DMSO)150 μl使沉淀降解,在酶联免疫检测仪上490 nm波长处测定光吸收值(A值),用只加培养液不加细胞的空白孔调零。
1.4 Hyp法检测心室中胶原含量 各处理组作用36 h,按照南京建成生物工程研究所提供的药盒及说明测定Hyp含量,所得值/0.134即为心肌中胶原蛋白的含量。
1.5 NO活性测定 10-5mol/L TSN剂量组分别作用24、36、48、60 h。采用硝酸还原酶法测定NO,检测细胞培养液中NO2-含量,通过显色深浅读取吸光度。样品NO含量按公式〔(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×100 μmol/L〕计算。
1.6 比色法测定CFb中SOD活性和MDA含量 各处理组作用24 h,取100 μl上清液,532 nm 处,1 cm 光径,蒸馏水调零,按照试剂盒说明操作,测各管吸光度值。
1.7 统计学处理 应用SPSS16.0统计软件,结果数据以表示,多组间比较采用方差分析,组间比较采用t检验。
2 结果
2.1 观察CFb生长形态变化 各处理组作用36 h后,放置在倒置显微镜下观察CFb形态变化。对照组胞质丰富,细胞呈梭型且连接丰富;AngⅡ组CFb增生呈火焰状,细胞生长密集;TSN组细胞密度明显降低,间隙逐渐增大。见图1。
2.2 MTT法检测CFb的增殖活力 AngⅡ能够明显提高CFb对MTT的代谢率,MTT值明显升高,与对照组相比有显著性差异(P<0.01),说明AngⅡ对CFb有促增殖作用。加入不同剂量的TSN后,MTT值明显低于AngⅡ组,有显著性差异(P<0.01,P<0.05),且此抑制作用具有剂量依赖性。见表1。
2.3 Hyp法测定CFb胶原含量 AngⅡ组胶原含量升高,与对照组相比差异显著(P<0.05);TSN作用后,呈明显的量效依赖性胶原含量下降,与AngⅡ组相比有显著性差异(P<0.05,P<0.01)。见表1。
2.4 CFb培养液中NO系统活性测定 AngⅡ组NO水平明显减少,与对照组比较差异显著(P<0.05,P<0.01);TSN可呈时间依赖性升高CFb中NO含量,与AngⅡ组相比差异显著(P<0.05)或非常显著(P<0.01);TSN 60 h组与TSN 24 h组相比差异非常显著(P<0.01)。见图2。
2.5 CFb中SOD活性和MDA含量 与对照组相比,AngⅡ组SOD值明显减少(P<0.05),MDA显著升高(P<0.01),TSN各剂量组可不同程度地升高SOD活性,降低MDA含量,与AngⅡ组相比差异显著(P<0.05,P<0.01)。见表2。
表1 各组细胞增殖活力(OD值)及胶原含量(,n=8)
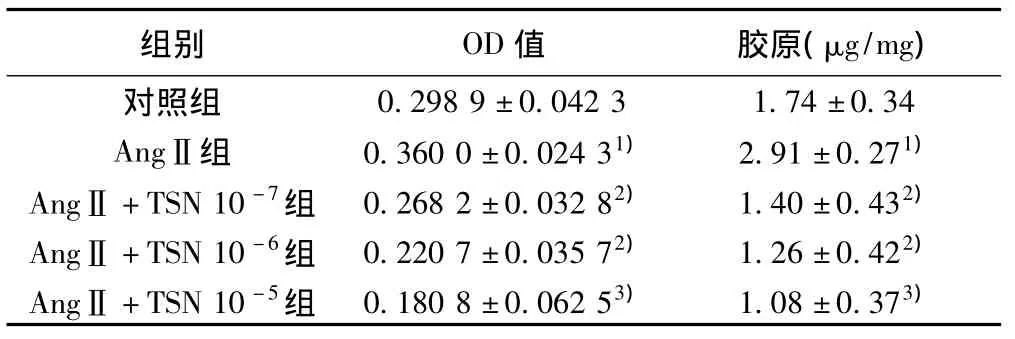
表1 各组细胞增殖活力(OD值)及胶原含量(,n=8)
与对照组比较:1)P<0.05;与AngⅡ组比较:2)P<0.05,3)P<0.01
组别 OD值 胶原(μg/mg)0.298 9±0.042 3 1.74±0.34 AngⅡ组 0.360 0±0.024 31) 2.91±0.271)AngⅡ +TSN 10-7组 0.268 2±0.032 82) 1.40±0.432)AngⅡ +TSN 10-6组 0.220 7±0.035 72) 1.26±0.422)AngⅡ +TSN 10-5组 0.180 8±0.062 53) 1.08±0.373)对照组
表2 各组SOD活性及MDA含量比较(,n=6)
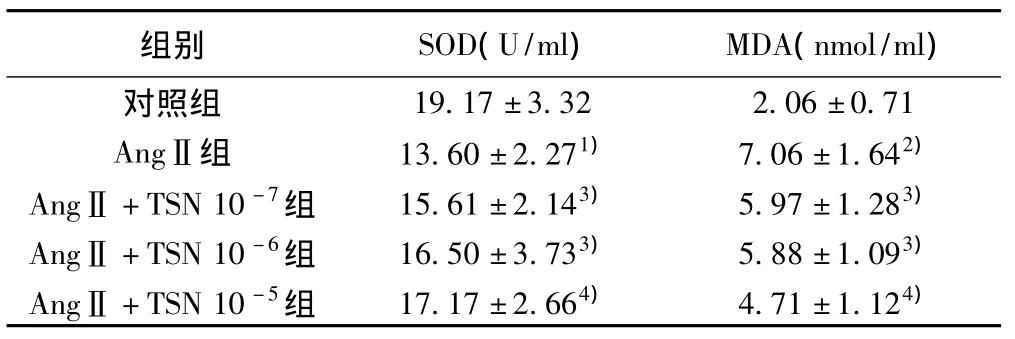
表2 各组SOD活性及MDA含量比较(,n=6)
与对照组比较:1)P<0.05,2)P<0.01;与AngⅡ组比较:3)P<0.05,4)P<0.01
组别 SOD(U/ml) MDA(nmol/ml)19.17±3.32 2.06±0.71 AngⅡ组 13.60±2.271) 7.06±1.642)AngⅡ +TSN 10-7组 15.61±2.143) 5.97±1.283)AngⅡ +TSN 10-6组 16.50±3.733) 5.88±1.093)AngⅡ +TSN 10-5组 17.17±2.664) 4.71±1.124)对照组
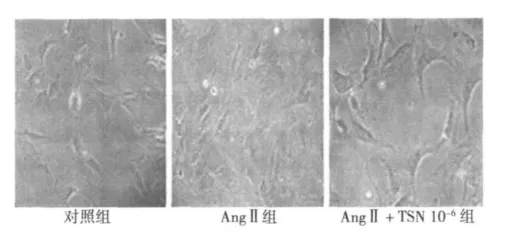
图1 各组CFb生长形态变化(×200)
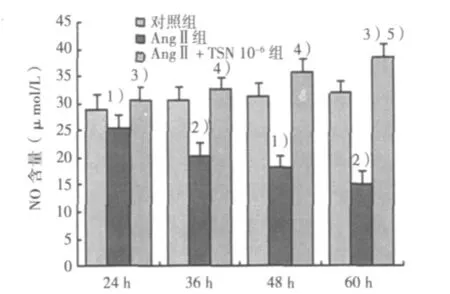
图2 各组细胞作用不同时间NO含量比较
3 讨论
高血压、心肌梗死、糖尿病等多种疾病可引起CFb增殖并转化为肌成纤维细胞,使细胞外基质(ECM)大量合成与分泌,沉积于心脏间质部位,产生MF,导致心功能严重受损〔4〕。因此调控成纤维细胞增殖及分化可能是防治MF、改善心脏病预后的关键措施之一〔5〕。本实验结果显示,给予TSN后,可使AngⅡ作用下的CFb MTT-OD值显著降低,胶原蛋白含量下降。
在调节MF的生物活性因子中,NO受到重视。心肌局部内皮素、NO等生物活性因子是心肌间质CFb增生和MF的重要中介因子〔6〕。心血管系统中,NO除可抑制心肌细胞凋亡〔7〕,还与心室肥厚的发生、发展有着密切的关系〔8〕。在体研究证实,NO生成不足可加速由AngⅡ持续输注引起的纤维化,并使其加重〔9〕。近年来研究显示,内源性的NO可通过自分泌和(或)旁分泌的途径抑制CFb增殖和胶原合成,降低细胞外胶原沉积,其生成增加可拮抗AngⅡ所致的MF,延缓并逆转心室肥厚,改善心肌纤维化〔10〕。TSNⅡA是丹参的重要心血管活性成分,具有改善微循环、抗缺氧、抗缺血作用〔11〕,但TSN作用下的CFb NO活性变化及其与MF的关系报道不多。有资料显示,正常大鼠的CFb能够分泌一定量的NO〔12〕。本实验结果表明:AngⅡ组NO水平明显下降,用药后TSN各剂量组NO水平升高,与AngⅡ组相比差异显著,且NO水平随TSN作用时间增加而升高,呈明显的时间依赖性。
近几年的研究显示,氧化应激反应参与心室重构〔2〕,AngⅡ可作为一种内在的氧化剂,促使氧化应激的发生,在高血压、糖尿病等疾病引起的心脏损害中发挥重要作用〔13〕。Nakagami等〔14〕用AngⅡ诱导新生鼠心肌细胞肥大,研究发现肥厚反应由介导,抗氧化剂能减轻氧化应激,所有反应可被AT1R阻断剂所阻断。提示AngⅡ与AT1R结合后,可激活还原型辅酶Ⅱ(NADPH)氧化酶产生,同时体内SOD、GSH-Px等抗氧化系统清除氧自由基能力减弱,导致氧自由基堆积。本文结果表明,AngⅡ组SOD活性明显降低,MDA水平明显升高,与对照组相比差异显著。TSN干预组能显著提高SOD活性、降低MDA水平,说明TSN通过其抗氧化作用抑制AngⅡ诱导的氧化应激反应,从而抑制MF的发生。
1 詹昌德.一氧化氮在防止心肌肥厚反应中的作用及机制〔J〕.生理科学进展,2000;31(4):322-5.
2 顾玉梅,吴 扬.氧化应激在心肌肥厚中的作用及其机制〔J〕.南通大学学报(医学版),2005;25(3):233-5.
3 Cai H,Zhao ZM,Xiu CY.Effect of TaishinoneⅡA on cardiac fibroblast proliferation and transforming growth factor β1 induced by lysophosphatidic acid〔J〕.Med Postgraduate Bull,2008;21(2):621-4.
4 MacKenna D,Summerour SR,Villarreal FJ.Role of mechanical factors in modulating cardiac fibroblast function and extracellular matrix synthesis〔J〕.Cardiovasc Res,2000;46(2):257-63.
5 Leask A.TGF beta,cardiac fibroblasts,and the fibrotic response〔J〕.Cardiovasc Res,2007;74(2):207-12.
6 李保玉,金 毅,王景华,等.ET-NO系统与心肌胶原代谢的关系〔J〕.临床与实验病理学杂志,1999;15(1):57-9.
7 Iwai-Kanai E,Hasegawa K,Fujita M,et al.Basic fibroblast growth factor protects cardiac myocytes from iNOS-mediated apoptosis〔J〕.J Cell Physiol,2002;190(1):54-62.
8 Okruhlioova L,Tribulova N,Bernalova I,et al.Induction of angiogenesis in NO-deficient rat heart〔J〕.Physiol Res,2000;49(1):71-6.
9 Tian B,Liu J,Bitterman P,et al.Angiotensin Ⅱ modulates nitric oxide induced cardiac fibroblast apoptosis by activation of AKT/PKB〔J〕.Am J Physiol Heart Circ Physol,2003;285(3):1105-12.
10 Weber KT.Fibrosis and hypertensive heart disease〔J〕.Curr Opin Cardiol,2000;15(4):264-72.
11 张冬梅,秦 英,牛福玲,等.丹参酮ⅡA对AngⅡ诱导的心肌成纤维细胞增殖及Ⅰ型胶原合成的影响〔J〕.辽宁中医杂志,2008;35(12):1934-6.
12 李爱国,赵连友,郑强荪,等.阿伐他汀对成年大鼠心肌成纤维细胞分泌内皮素-1及一氧化氮合酶/一氧化氮系统活性的影响〔J〕.医学研究生学报,2003;16(10):733-5.
13 Ando K.Oxidative stress〔J〕.Nippon Rinsho,2003;61(7):1130-7.
14 Nakagami H,Takemoto M,Liao JK.NADPH oxidase-derived superoxide anion mediates angiotensin Ⅱ-induced cardiac hypertrophy〔J〕.J Mol Cell Cardiol,2003;35(7):851-9.
