蟾蜍灵联合奥沙利铂对胃癌MGC803细胞增殖抑制及凋亡的影响
2011-08-02朱志图郁云龙李恩泽刘阳阳哈敏文刘云鹏
朱志图 王 锴 郁云龙 李恩泽 刘阳阳 哈敏文 刘云鹏
(辽宁医学院附属第一医院肿瘤科,辽宁 锦州 121001)
胃癌是世界发病率列为第四的恶性肿瘤,虽然早期胃癌根治性手术后的5年生存率超过90%,但是晚期患者的预后较差,5年生存率不足10%〔1〕。在我国,大约2/3的患者确诊时已属晚期,不能手术切除,放化疗是治疗晚期胃癌的主要手段,但化疗带来的毒副反应一直是临床难题。蟾蜍灵是中药蟾酥的毒性配基之一,研究发现蟾蜍灵具有抗肿瘤的作用〔2〕。奥沙利铂广泛用于结直肠癌,近年来发现对胃癌也具有较好疗效。目前国内外关于蟾蜍灵联合其他化疗药治疗胃癌的基础研究较少,本实验采用蟾蜍灵联合奥沙利铂作用于胃癌MGC803细胞,观察两药联合对胃癌细胞体外生长抑制及诱导凋亡作用,探讨其作用机制,旨在为临床化疗方案的选择提供实验依据。
1 材料与方法
1.1 细胞、药物、试剂 胃癌MGC803细胞株由中国医科大学肿瘤实验室惠赠;蟾蜍灵购于Sigma公司,用无水乙醇配成0.01 mol/L贮存液,-20℃冻存,实验时用磷酸盐缓冲液(PBS)稀释成所需浓度,乙醇终浓度<0.01%,预实验表明,该浓度乙醇对细胞增殖无影响;奥沙利铂(50 mg/支)购于齐鲁制药有限公司;RPMI1640培养基购于Gibco公司;胎牛血清购于中国医学科学院血液学研究所;碘化丙啶(PI)、噻唑蓝(MTT)购于Sigma公司;Bax和Bcl-2单克隆抗体武汉博士德公司。
1.2 MTT法检测蟾蜍灵和奥沙利铂单药及联合用药后细胞增殖抑制率 取处于对数生长期的细胞,0.25%胰酶消化制成单细胞悬液,调整密度为3×104/ml,接种于96孔培养板中,每孔180 μl,实验组加用不同浓度的单药或联合药物,对照组加入RPMI 1640培养基,继续培养24、48、72 h,终止培养前4 h每孔加入MTT液20 μl,到预定时间后加二甲基亚砜(DMSO)液200 μl,振荡后酶联免疫检测仪570 nm处测定各孔吸光度值。按细胞增殖抑制率计算公式计算细胞增殖抑制率,计算药物抑制细胞增殖50%的浓度(IC50)及联合指数。每组实验重复3次。细胞增殖抑制率(%)=1-(实验组平均OD值/对照组平均OD值)×100%。
1.3 流式细胞术分析周期阻滞及凋亡百分率 分别收集对照组及处理组细胞,1 000 r/min离心5 min,冷 PBS洗涤,加入70%的冷乙醇4℃过夜,1 000 r/min再离心5 min,后加入终浓度为10 mg/ml的PI,避光反应30 min后进行流式细胞仪测定,采用Cell Quest进行细胞各期的百分比分析,判定凋亡细胞百分率。
1.4 Western印迹法检测蛋白的表达 将对照组和处理组的细胞加RIPA裂解液在冰上裂解30 min,12 000 r/min离心30 min,取上清,采用Lowry法进行蛋白定量。与3×样品缓冲液混合后,煮沸5 min。取50 μg蛋白样品在15%的十二烷基硫酸钠(SDS)-聚丙烯凝胶中电泳约3 h,然后转印至硝酸纤维素膜上2 h。用5%脱脂奶粉封闭1 h后,按预染Marker标记的分子量剪裁转印膜,分别加入Bax抗体(1∶300)、Bcl-2(1∶300)抗体及β-actin抗体(1∶1 000),过夜。Tris盐水缓冲液(TTBS)洗4次后加入辣根过氧化物酶标记的二抗(1∶800)作用30 min,发光免疫分析(ECL)法显色后GIS数码系列凝胶图像分析系统拍照,采用Image J软件分析处理。
1.5 统计学方法 应用SPSS16.0软件进行分析,资料数据以表示,采用单因素方差分析和t检验。
2 结果
2.1 不同浓度蟾蜍灵和奥沙利铂单药及联合用药对胃癌MGC803细胞的抑制作用 蟾蜍灵和奥沙利铂单用或联用均对MGC803生长有抑制作用,二者单用或联用的抑制作用随着药物浓度和作用时间增加而增强,呈时间-剂量依赖方式,不同浓度、不同时间点之间抑制率比较,差异有统计学意义(P<0.05),联合用药时IC50均较单药低,联合指数(CI)<1,提示两药有协同作用。见表1,表2;图1。
表1 药物对MGC803细胞增殖抑制作用(,n=3)
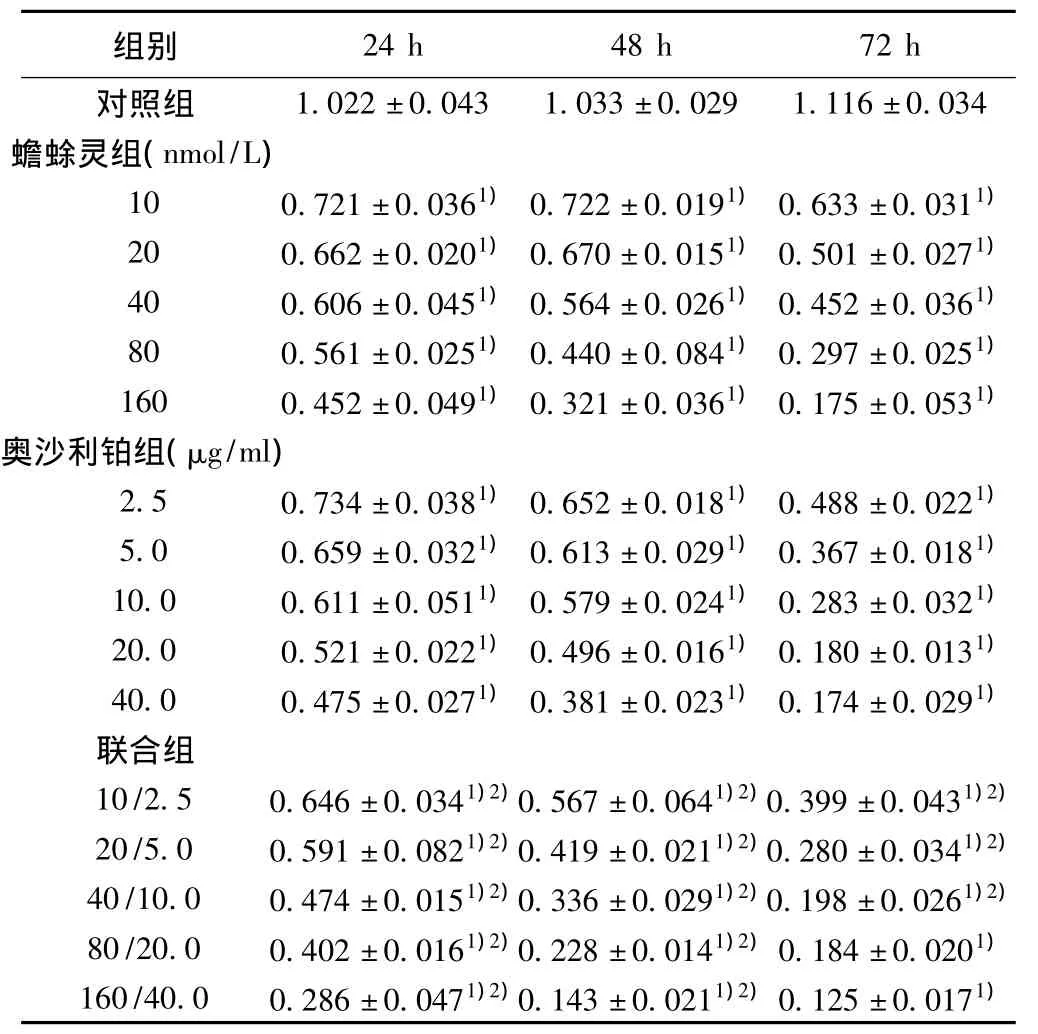
表1 药物对MGC803细胞增殖抑制作用(,n=3)
与对照组比较:1)P<0.05;与单药组比较:2)P<0.05
1.022±0.043 1.033±0.029 1.116±0.034蟾蜍灵组(nmol/L)10 0.721±0.0361)0.722±0.0191)0.633±0.0311)20 0.662±0.0201)0.670±0.0151)0.501±0.0271)40 0.606±0.0451)0.564±0.0261)0.452±0.0361)80 0.561±0.0251)0.440±0.0841)0.297±0.0251)160 0.452±0.0491)0.321±0.0361)0.175±0.0531)奥沙利铂组(μg/ml)2.5 0.734±0.0381)0.652±0.0181)0.488±0.0221)5.0 0.659±0.0321)0.613±0.0291)0.367±0.0181)10.0 0.611±0.0511)0.579±0.0241)0.283±0.0321)20.0 0.521±0.0221)0.496±0.0161)0.180±0.0131)40.0 0.475±0.0271)0.381±0.0231)0.174±0.0291)联合组10/2.5 0.646±0.0341)2)0.567±0.0641)2)0.399±0.0431)2)20/5.0 0.591±0.0821)2)0.419±0.0211)2)0.280±0.0341)2)40/10.0 0.474±0.0151)2)0.336±0.0291)2)0.198±0.0261)2)80/20.0 0.402±0.0161)2)0.228±0.0141)2)0.184±0.0201)160/40.0 0.286±0.0471)2)0.143±0.0211)2)0.125±0.0171)24 h 48 h 72 h对照组组别

表2 各组IC50及CI值
2.2 蟾蜍灵和奥沙利铂单药及联合诱导MGC803细胞周期阻滞及凋亡 10 nmol/L蟾蜍灵、10 μg/ml奥沙利铂及两药联合分别作用细胞24 h后,流式细胞术检测联合组出现亚二倍体凋亡峰(sub-G1峰),与对照组、单药组比较差异有统计学意义(P <0.05),见图1;表3。

表3 药物作用细胞24 h周期分布(%)
2.3 蟾蜍灵和奥沙利铂单药及联合对凋亡蛋白Bax、Bcl-2蛋白的影响 蟾蜍灵、奥沙利铂单药作用于MGC803细胞24 h后,Western印迹结果显示Bax及Bcl-2蛋白表达无明显变化,而联合组Bcl-2蛋白表达下降到对照组的57.14%,Bax蛋白表达上调至对照组的145.94%,Bax/Bcl-2比值增加到对照组的2.56倍,差异均有统计学意义(P<0.05)。见图2。

图1 流式细胞术检测药物诱导细胞凋亡

图2 Western印迹检测Bcl-2、Bax蛋白表达
3 讨论
蟾蜍灵是传统中药蟾酥中蟾毒的主要成分,有强心、麻醉等作用,近年来国内外学者研究证明蟾蜍灵可以抑制白血病细胞及实体瘤细胞〔3,4〕增殖并诱导其周期阻滞和凋亡。奥沙利铂是一种新型的铂类抗癌药,治疗晚期或转移性胃癌活性高且疗效较好,但其神经毒性等不良反应亦困扰临床,有报道其慢性神经毒性发生率为65% ~98%,急性神经毒性可达100%〔5〕,且缺乏有效的预防和治疗方法,已证实奥沙利铂与氟尿嘧啶、顺铂、伊立替康等有协同增效作用〔6〕,但与蟾蜍灵联合疗效尚未见报道。
本文首次采用蟾蜍灵和奥沙利铂单药及联合用药作用于胃癌MGC803细胞,结果发现两药单药均可抑制细胞生长,呈时间剂量依赖效应。两药联合组抑制率高于单药组,计算24、48、72 h各组IC50得出的两药CI都小于1,显示联合用药具有协同作用。基于MTT结果,应用小剂量蟾蜍灵及奥沙利铂作用细胞24 h,流式细胞术显示两单药未引起明显细胞凋亡,而小剂量联合用药可诱导细胞凋亡,与单药组对比有统计学差异,同样显示两药有协同作用。
抗癌药物作用肿瘤细胞在低浓度表现为周期抑制,高浓度时表现为细胞凋亡。蟾蜍灵作用细胞周期阻滞的报道不一,Li〔7〕发现20 nmol/L蟾蜍灵可引起胃癌细胞 G2/M期阻滞,80 nmol/L时诱导细胞凋亡。奥沙利铂是作用于DNA化学结构的细胞毒类药物,研究发现奥沙利铂可引起胃癌细胞G0/G1、S期阻滞〔8,9〕,提示奥沙利铂为细胞周期非特异性化疗药物。蟾蜍灵与奥沙利铂抗癌作用机制及对细胞阻滞周期不同,符合联合化疗原则。本实验奥沙利铂组S期细胞增多,且联合组出现明显亚二倍体凋亡峰,提示两药可能通过使细胞停滞于S、G2/M期,当细胞DNA合成和有丝分裂均受阻时,细胞增殖受到抑制,细胞凋亡则会增加。
Bcl-2家族被认为是细胞凋亡基因家族中重要的调控基因,自1985年Tsujim等首次发现Bcl-2基因至今已发现20种因子,根据结构和功能的不同,分为三大类,其中包括Bax亚家族,Bax通过与Bcl-2形成同二聚体或异二聚体对细胞凋亡进行调节,二者的比例决定了细胞的凋亡,当Bax增多时,形成Bax-Bax同二聚体可使线粒体膜通透性增加,细胞色素C(Cyt-C)从线粒体释放到胞浆增多,后者通过作用于凋亡蛋白激活因子-1,继而激活凋亡蛋白酶如半胱氨酸蛋白酶(Caspases),从而诱导细胞凋亡〔10〕,而当Bcl-2过量时,形成Bax-Bcl-2的异二聚体,可干扰线粒体膜通道的形成,维持线粒体外膜的完整性,阻止Cyt-C与半胱天冬氨酸激活蛋白(Smac)/低等电点凋亡抑制蛋白(IAP)结合蛋白(DIABIO)(Smac/DIABLO)的释放,从而保护细胞免于凋亡〔11〕。蟾蜍灵和奥沙利铂促凋亡的过程均由Bcl-2家族参与〔12,13〕,本研究发现蟾蜍灵与奥沙利铂联合作用24 h后,Bax蛋白表达上调,Bcl-2蛋白表达下降,提示药物可能通过上调Bax、下调Bcl-2发挥促进细胞凋亡的作用,与学者Wang的报道相似〔14〕。本研究为临床联合用药提供一些实验依据,但具体用药剂量、时间及先后顺序和凋亡确切机制仍需进一步研究,其药物疗效、不良反应有待临床验证。
1 Yang L.Incidence and mortality of gastric cancer in China〔J〕.World J Gastroenterol,2006;12(1):17-20.
2 韩鸿彬,陈嘉勇.华蟾酥抗肿瘤作用及其机制的研究进展〔J〕.中国肿瘤生物治疗杂志,2005;12(2):160-2.
3 Huang C,Chen A,Guo M,et al.Membrane dielectric responses of bufalin-induced apoptosis in HL-60 cells detected by an electrorotation chip〔J〕.Biotechnol Lett,2007;29(9):1307-13.
4 Takai N,Ueda T,Nishida M,et al.Bufalin induces growth inhibition,cell cycle arrest and apoptosis in human endometrial and ovarian cancer cells〔J〕.Int J Mol Med,2008;21(5):637-43.
5 Kemeny N,Garay CA,Gurtler J,et al.Randomized multicenter phase Ⅱtrail of bolus plus infusional fluorouracil/leucovorin compared with fluorouracil/leucovorin plus oxaliplatin as third-line treatment of patients with advanced colorectal cancer〔J〕.J Clin Oncol,2004;22(23):4753-61.
6 白 桦,申维玺,李先明,等.紫杉醇或草酸铂联合氟脲嘧啶/亚叶酸治疗晚期胃癌的对比研究〔J〕.中国肿瘤临床,2007;34(18):1039-40.
7 Li D,Qu X,Hou K,et al.PI3K/Akt is involved in bufalin-induced apoptosis in gastric cancer cells〔J〕.Anticancer Drugs,2009;20(1):59-64.
8 Tanaka R,Ariyama H,Qin B,et al.Synergistic interaction between oxaliplatin and SN-38 in human gastric cancer cell lines in vitro〔J〕.Oncol Rep,2005;14(3):683-8.
9 Qin B,Tanaka R,Shibata Y,et al.In-vitro schedule-dependent interaction between oxaliplatin and 5-fluorouracil in human gastric cancer celllines〔J〕.Anticancer Drugs,2006;17(4):445-53.
10 Sawa H,Kobayashi T,Mukai K,et al.Bax overexpression enhances cytochrome c release from mitochondria and sensitizes KATOIII gastric cancer cells to chemotherapeutic agent-induced apoptosis〔J〕.Int J Oncol,2000;16(4):745-9.
11 Donovan M,Cotter TG.Control of mitochondrial integrity by Bcl-2 family members and caspase-independent cell death〔J〕.Biochim Biophys Acta,2004;1644(2-3):133-47.
12 Watabe M,Kawazoe N,Masuda Y,et al.Bcl-2 protein inhibits bufalininduced apoptosis through inhibition of mitogen-activated protein kinase activation in human leukemia U937 cells〔J〕.Cancer Res,1997;57(15):3097-100.
13 Hayward RL,Macpherson JS,Cummings J,et al.Enhanced oxaliplatininduced apoptosis following antisense Bcl-xl down-regulation is p53 and Bax dependent:Genetic evidence for specificity of the antisense effect〔J〕.Mol Cancer Ther,2004;3(2):169-78.
14 Wang Z,Zhou J,Fan J,et al.Oxaliplatin induces apoptosis in hepatocellular carcinoma cells and inhibits tumor growth〔J〕.Expert Opin Investig Drugs,2009;18(11):1595-604.
