热休克蛋白70对内毒素致门静脉高压性胃病大鼠胃黏膜损伤的保护作用研究*
2011-08-02孙晓宁董丽伟黄白丽吴克利
蓝 程,孙晓宁,董丽伟,袁 素,黄白丽,吴克利
(海南省人民医院消化内科,海南 海口 570311)
临床上相当部分肝硬化门静脉高压患者的上消化道出血并非食管胃底静脉曲张破裂而是胃黏膜病变所致,即门静脉高压性胃病(portal hypertension gastropathy,PHG)[1]。有时PHG甚至引起致命性大出血。在门静脉高压这一血流动力学变化的基础上,胃黏膜防御因素和损伤因素的失衡是PHG的重要发病机制。人们推测肝硬化门静脉高压时,肠源性内毒素可能通过破坏胃黏膜屏障,产生多种病理损伤因子而导致 PHG[2]。热休克蛋白(heat shock proteins,HSP)是机体在应激状态下合成增加的一类保护性蛋白,其中HSP70是加强胃黏膜防御能力的主要的HSP之一[3]。HSP70在PHG胃黏膜损伤中的作用目前报道较少,本文就此作一探讨。
材料和方法
1 动物和主要试剂
Wistar雄性大鼠60只,体重200-250 g,购自重庆医科大学实验动物中心;大肠杆菌内毒素(第二军医大学微生物教研室提供);重组杀菌性/通透性增加蛋白BPI21(XOMA);HSP70 ELISA试剂盒(上海沪峰生物科技有限公司);肿瘤坏死因子 α(tumer necrosis factor α,TNF - α)ELISA 试剂盒(深圳晶美生物工程有限公司)。
2 方法
2.1 PHG模型的制作 用60%CCL4植物油溶液3 mL/kg BW给大鼠皮下注射,每3 d 1次。正常饮食,第12周肝硬化模型制成,1周后进行门静脉压力测定。以氯氨酮40 mg/kg腹腔注射麻醉后正中切口开腹,分离门静脉主干,以26号套管针穿刺,接测压管测定门静脉压力(portal vein pressure,PVP)。
2.2 热处理诱导HSP70 采用Itoh等[4]的方法,略作改进。大鼠腹腔内注射1%戊巴比妥钠(50 mg/kg BW)麻醉后,置于预加热至50℃的恒温烤箱内,使其肛温达42-42.5℃,并维持15 min,室温下恢复24 h。
2.3 实验分组 随机抽取10只大鼠作为正常对照组,正常饮食,其余50只随机分为PHG组(n=10),PHG+内毒素组(n=10);PHG+BPI21组(n=10)和热处理组(n=20),并进行PHG造模。PHG+内毒素组于造模过程第6周腹腔内注射内毒素(3 mg/kg),PHG+BPI21组于造模过程第6周尾静脉注射内毒素拮抗剂BPI21(2 mg/kg)。热处理组又进一步随机分为A、B组,每组各10只。热处理A组(n=10)大鼠于制作PHG模型的第4、6、8周每周进行1次热处理;热处理B组(n=10)大鼠于制作PHG模型后第1-3周,每周进行1次热处理。
2.4 血浆内毒素、胃黏膜HSP70和TNF-α水平的测定 实验结束后处死动物,采集血浆及胃组织标本,取胃组织超声粉碎后提取上清液,-20℃保存备测。参照ELISA试剂盒说明书步骤,测定外周血和胃黏膜局部 HSP70和TNF-α水平。偶氮显色法测定血浆内毒素水平。
2.5 胃黏膜病理变化的观察 实验结束后处死动物,取胃组织,常规包埋,石蜡切片,HE染色,光学显微镜下观察胃黏膜组织学变化,以病理积分表示。胃黏膜病理积分参考Mascuda等[5]的标准:正常为0分;表层上皮损伤为1分;上皮层黏膜充血水肿为2分;中/下层黏膜充血、水肿、出血为3分;黏膜上层腺体结构紊乱或坏死为4分;深层坏死或溃疡为5分。每张切片的累计积分最大不超过15分。
3 统计学处理
结 果
1 造模情况
共42只大鼠成功制备肝硬化PHG模型,其中PHG组8只,PHG+内毒素组8只;PHG+BPI21组9只,热处理A组9只、热处理B组8只,造模成功率84%。PHG组1只大鼠造模未成功,1只大鼠在造模中途死亡。PHG+内毒素组2只大鼠及PHG+BPI21组1只大鼠均为造模中途死亡。热处理A组1只大鼠在热处理时死亡;热处理B组1只大鼠造模未成功,1只大鼠在造模中途死亡。
PHG组大鼠肝脏呈黄褐色无光泽,体积缩小,表面呈大小不等的结节样改变,门静脉明显增粗、迂曲,组织学证实肝硬化形成。PHG组门静脉压力水平较正常对照组明显增高[(17.21±4.72)cmH2O vs(8.15±2.80)cmH2O,P <0.01](1 cmH2O=0.098 kPa),且胃黏膜可见明显损伤。由此可见,成功制备了肝硬化PHG大鼠模型。
2 PHG时胃黏膜HSP70、TNF-α及血浆内毒素水平的变化
与正常对照组相比,PHG组大鼠胃黏膜HSP70水平明显降低而TNF-α水平明显升高(P<0.01),2组大鼠外周血中HSP70及TNF-α水平无明显差异(P>0.05)。PHG组大鼠血浆内毒素水平明显升高(P<0.01),见表1。
3 外源性内毒素及BPI21对PHG大鼠血浆内毒素、胃黏膜HSP70、TNF-α水平及胃黏膜组织病理变化的影响
与PHG组相比,PHG+内毒素组大鼠胃黏膜TNF-α及血浆内毒素水平明显升高(P<0.05),PHG+BPI21组大鼠胃黏膜TNF-α及血浆内毒素水平则明显降低(P<0.05),2组大鼠的胃黏膜HSP70水平无显著变化(P>0.05),见表1。与PHG组相比,PHG+内毒素组大鼠胃黏膜炎症、出血明显加重,甚至出现坏死及溃疡,病理积分显著增加(P<0.05);PHG+BPI21组大鼠胃黏膜炎症细胞浸润及出血坏死灶明显减少,病理积分显著减少(P<0.05),见表1、图1。
4 热处理对PHG大鼠血浆内毒素、胃黏膜HSP70、TNF-α水平及胃黏膜组织病理变化的影响
与PHG组相比,热处理A组大鼠胃黏膜TNF-α明显降低而HSP70升高(P<0.05),血浆内毒素没有变化;热处理B组大鼠胃黏膜HSP70升高(P<0.05),胃黏膜TNF-α降低(P<0.05),血浆内毒素无显著变化(P>0.05)。与PHG组相比,热处理A组胃黏膜炎症细胞浸润及出血坏死灶明显减少,病理积分显著减少(P<0.05),热处理B组胃黏膜损伤无显著变化(P>0.05),见表2、图2。
表1 内毒素对PHG大鼠血浆内毒素、胃黏膜HSP70、TNF-α水平及胃黏膜组织病理变化的影响Table1.Effect of endotoxin on the levels of plasma endotoxin,gastric mucosal HSP70 and TNF-α,and the pathological changes of gastric mucosa in rats with PHG()
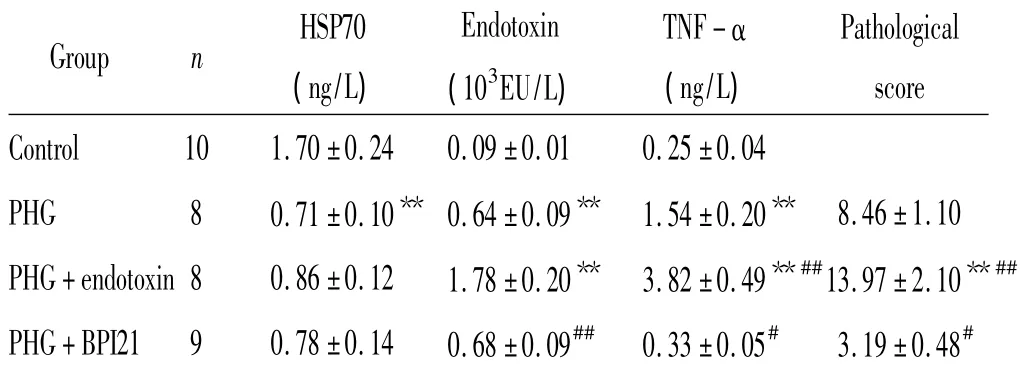
表1 内毒素对PHG大鼠血浆内毒素、胃黏膜HSP70、TNF-α水平及胃黏膜组织病理变化的影响Table1.Effect of endotoxin on the levels of plasma endotoxin,gastric mucosal HSP70 and TNF-α,and the pathological changes of gastric mucosa in rats with PHG()
**P <0.01 vs control group;##P <0.01 vs PHG group.
HSP70EndotoxinTNF-αPathological Group n 3(ng/L)(10EU/L)(ng/L)score Control 10 1.70 ±0.24 0.09±0.01 0.25 ±0.04 PHG 8 0.71±0.10** 0.64±0.09** 1.54±0.20** 8.46±1.10 PHG+endotoxin 8 0.86 ±0.12 1.78±0.20** 3.82 ±0.49**##13.97 ±2.10**##PHG+BPI21 9 0.78 ±0.14 0.68±0.09## 0.33 ±0.05# 3.19 ±0.48#
表2 热处理对PHG大鼠血浆内毒素、胃黏膜HSP70、TNF-α水平及胃黏膜组织病理变化的影响Table2.Effect of heat treatment on the levels of plasma endotoxin,gastric mucosal HSP70 and TNF-α,and the pathological changes of gastric mucosa()
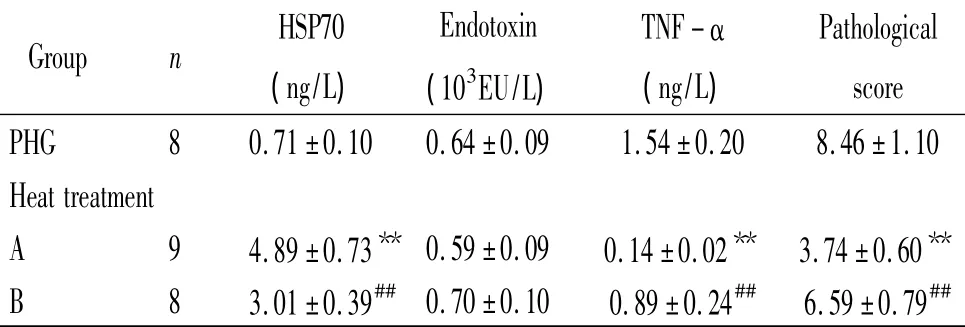
表2 热处理对PHG大鼠血浆内毒素、胃黏膜HSP70、TNF-α水平及胃黏膜组织病理变化的影响Table2.Effect of heat treatment on the levels of plasma endotoxin,gastric mucosal HSP70 and TNF-α,and the pathological changes of gastric mucosa()
**P <0.01 vs PHG group;##P <0.01 vs heat treatment A group.
HSP70EndotoxinTNF-αPathological Group n 3(ng/L)(10EU/L)(ng/L)score PHG 8 0.71±0.10 0.64±0.09 1.54±0.20 8.46±1.10 Heat treatment A 9 4.89±0.73** 0.59±0.09 0.14±0.02** 3.74±0.60**B 8 3.01±0.39## 0.70±0.10 0.89±0.24## 6.59±0.79##
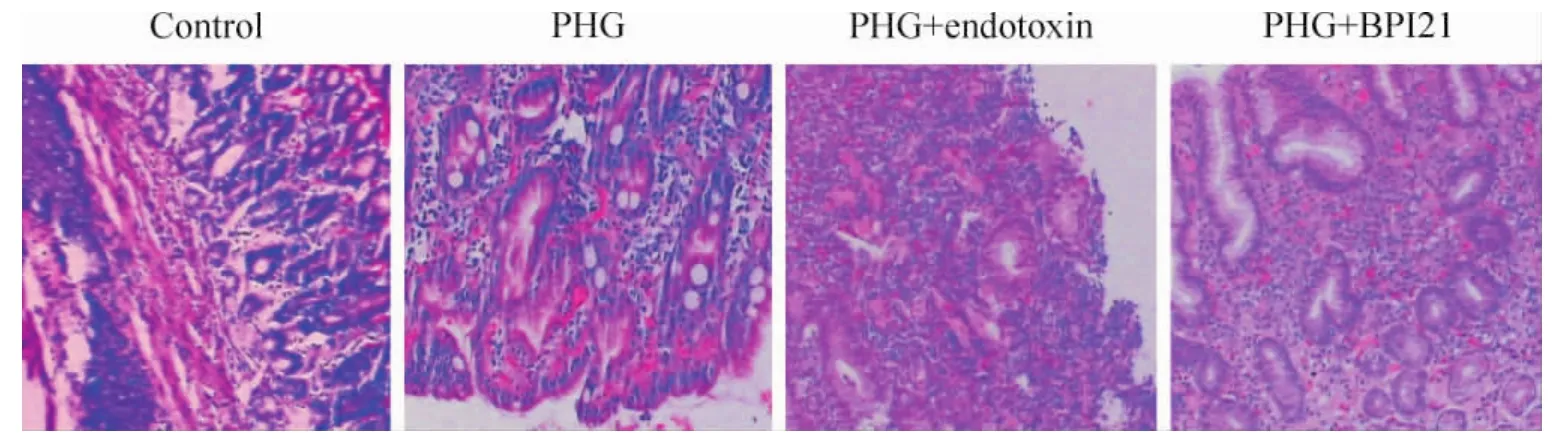
Figure1.Effect of endotoxin on the pathological changes of the gastric mucosa from rats with PHG(HE,×100).图1 内毒素对PHG大鼠胃黏膜组织病理变化的影响
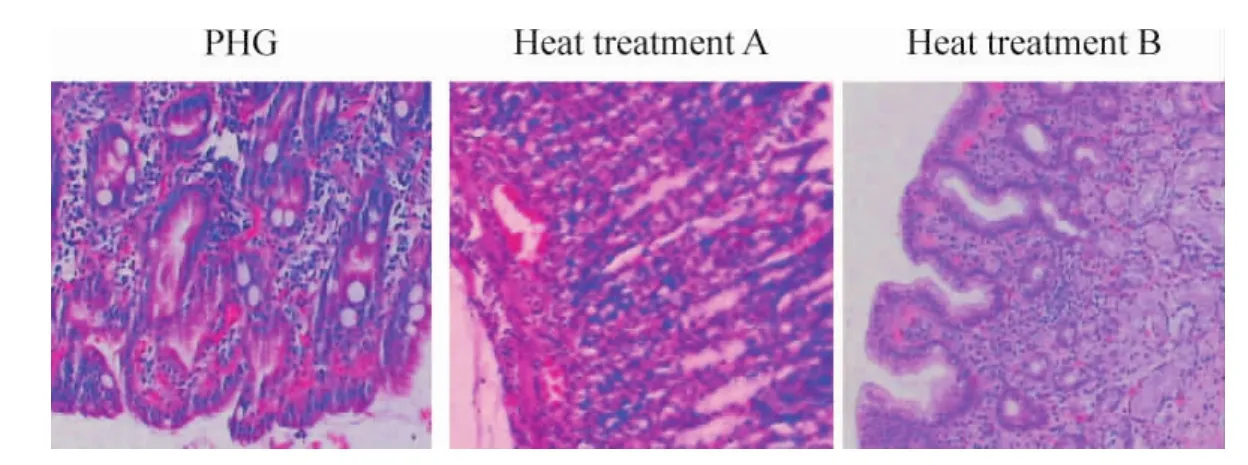
Figure2.Effect of heat treatment on the pathological changes of the gastric mucosa from rats with PHG(HE,×100).图2 热处理对PHG大鼠胃黏膜组织病理变化的影响
讨 论
胃黏膜防御因素与损伤因素失衡是PHG胃黏膜损伤的重要原因。内毒素不仅在肝硬化门静脉高压血流动力学异常中发挥重要作用,而且可能是直接损伤胃黏膜的重要因素[6]。研究表明,在应激、非甾体类抗炎药损伤等病理条件下,HSP是保护胃黏膜的重要因素[7-9]。HSP70是HSP家族的重要成员,关于HSP70在PHG胃黏膜损伤中的作用及其机制目前国内外报道较少。
本文结果显示,PHG组大鼠胃黏膜HSP70水平明显降低,热处理组PHG大鼠胃黏膜HSP70水平增加,胃黏膜损伤明显减轻,提示HSP70可能是PHG时胃黏膜的保护因素。令人感兴趣的是,在PHG造模过程中进行热处理(即热处理A组),胃黏膜损伤的改善明显优于成模之后(热处理B组),说明HSP70可能并不是PHG胃黏膜损伤的唯一保护因素,在PHG形成过程中及早诱导HSP70非常重要。
我们对HSP70保护PHG胃黏膜损伤的机制进行了初步探讨。PHG时,血浆内毒素明显升高,与PHG胃黏膜病理改变一致。正常大鼠和PHG大鼠注射内毒素后,血浆内毒素均明显升高,但只有PHG大鼠的胃黏膜病理改变明显加重,提示门静脉高压这一血流动力学改变增加了胃黏膜对内毒素损伤的敏感性。内毒素拮抗剂BPI21能竞争抑制内毒素与靶细胞受体作用,有效拮抗创伤、休克后肠源性内毒素血症/细菌易位诱发的多脏器功能障碍[10]。PHG大鼠注射BPI21后,其胃黏膜损伤明显改善。这表明,PHG时内毒素是胃黏膜损伤的重要致病因素。对PHG大鼠进行热处理后,胃黏膜HSP70明显增加,血浆内毒素水平没有明显变化,提示HSP70对PHG胃黏膜的保护作用不是通过直接抑制内毒素水平实现的,其作用可能发生于内毒素后的某些环节。
胃黏膜防御机制与黏膜上皮细胞所处的局部微环境密切相关,包括黏液层、细胞再生、黏膜血流以及局部化合物、细胞因子等。TNF-α是重要的炎症递质之一,其水平改变可引起局部炎症反应及器官的损害。PHG时TNF-α通过调节氧化氮合酶与前列环素的生成而起作用,还可增加血管通透性而加重胃部病变[11,12]。本研究中PHG大鼠血浆内毒素和胃黏膜TNF-α水平显著升高,外源性内毒素注射使PHG大鼠胃黏膜TNF-α明显升高,而内毒素拮抗剂BPI21没有影响PHG大鼠的血浆内毒素水平,却降低了胃黏膜TNF-α水平,胃黏膜损伤的变化与局部细胞因子的变化是一致的。提示TNF-α可能是导致PHG胃黏膜损伤的重要因子。
热预处理诱导HSP70增加,血浆内毒素没有变化,TNF-α相应降低,其降低的程度与胃黏膜的病理损伤一致,说明HSP70在PHG时可能通过TNF-α发挥胃黏膜保护作用。Byrne等[13]报道胃黏膜细胞表达HSP70保护了胃黏膜免于大量应激产生的NO引起的损伤。Suemasu等[14]认为HSP70通过抑制促凋亡基因Bax的活化来减缓非甾体抗炎药吲哚美辛诱导的病变。此外,HSP在缺血再灌注损伤、氧化损伤等应激反应中能阻止自由基对细胞膜损伤和蛋白质氧化[15]。我们的研究提示PHG时可能存在一个TNF-α的途径。至于HSP如何引起TNF-α减少则是需要进一步研究的问题。
总之,本文结果证实HSP70对PHG胃黏膜损伤具有保护作用,其机制可能与HSP70抑制胃黏膜TNF-α有关,这为临床治疗PHG胃黏膜损伤提供了新的线索。
[1]Perini RF,Camara PR,Ferraz JG.Pathogenesis of portal hypertensive gastropathy:translating basic research into clinical practice[J].Nat Clin Pract Gastroenterol Hepatol,2009,6(3):150 -158.
[2]Nolan JP.The contribution of gut- derived endotoxins to liver injury[J].Yale J Biol Med,1979,52(1):127 -133.
[3]Choi SR,Lee SA,Kim YJ,et al.Role of heat shock proteins in gastric inflammation and ulcer healing[J].J Physiol Pharmacol,2009,60(Suppl 7):5 -17.
[4]Itoh YH,Noguchi R.Pre-treatment with mild wholebody heating prevents gastric ulcer induced by restraint and water-immersion stress in rats[J].Int J Hyperthemia,2000,16(2):183-191.
[5]Mascuda E,Kawano S,Nagano K,et al.Role of endogenous endothelin in pathogenesis of ethanol-1 induced gas-tric mucosal injury in rats[J].Am J Physiol,1993,265(3 Pt 1):474-481.
[6]李 红,赵龙凤,韩德五.内毒素血症在大鼠肝硬化发生发展中的作用[J].中国病理生理杂志,2001,17(4):353-355.
[7]Konturek JW,Fischer H,Konturek PC,et al.HSP70 in gastric adaptation to asprin in HP infection[J].J Physiol Pharmacol,2001,52(1):153 -164.
[8]Nagahashi S,Suzuki H,Miyazawa M,et al.Ammonia aggravate stress induced gastric mucosal oxidative injury through the cacellation of cytoprotective HSP70[J].Free Radic Biol Med,2002,33(8):1073 - 1081.
[9]张君岚,黄善生,凌亦凌.不同家族热休克蛋白的生理功能及病理意义[J].中国病理生理杂志,1998,14(5):549-552.
[10]Yao YM,Bahrami S,Leichtfried G,et al.Pathogenesis of hemorrhage-induced bacteria/endotoxin translocation in rats:effects of recombinant bactericidal/permeability increasing protein[J].Ann Surg,1995,221(4):398 -405.
[11]Ferraz JG,Tigley AW,Appleyard CB,et al.TNF-alpha contributes to the pathogenesis of ethanol-induced gastric damage in cirrhotic rats[J].Am J Physiol,1997,272(4 Pt 1):G809-G814.
[12]Munoz J,Albillos A,Perez-Paramo M,et al.Factors mediating the hemodynamic effects of tumor necrosis factorα in portal hypertensive rats[J].Am J Physiol,1999,276(3 Pt 1):G687-G693.
[13]Byrne CR,Hanson PJ.Induction of heat shock protein 72 by a nitric oxide donor in guinea-pig gastric mucosal cells[J].Eur J Pharmacol,1998,353(1):117 -122.
[14]Suemasu S,Tanaka K,Namba T,et al.A role for HSP70 in protecting against indomethacin-induced gastric lesions[J].J Biol Chem,2009,284(29):19705-19715.
[15]Kalmar B,Greensmith L.Induction of heat shock proteins for protection against oxidative stress[J].Adv Drug Deliv Rev,2009,61(1):310 -318.
