带有穿膜肽PTD的重组Oct4的制备及活性鉴定*
2011-08-02李红阳李晓霞余榕捷刘晓飞王静静陈建苏
李红阳,李晓霞,余榕捷,刘晓飞,王静静,苏 航,陈建苏△
(暨南大学1第一临床医学院 ,2医学院眼科,3再生医学教育部重点实验室,4生物工程研究所,广东 广州 510632)
蛋白质转导结构域(protein transduction domain,PTD)是一段富含碱性氨基酸的短肽。本实验所用到的穿膜肽PTD来源于HIV1 Tat蛋白,它由11个氨基酸残基(YGRKKRRQRRR)组成,能够介导蛋白穿越细胞膜,实现蛋白在细胞与细胞之间传递。
Oct4(也被称为Oct3)是POU家族的转录因子,由pou5f1基因编码,在全能胚胎干细胞(totipotent embryonic stem cells)和生殖细胞中表达,在维持多能性发挥独特的作用[4]。本研究在重组蛋白Oct4的基础上,利用重叠延伸PCR技术成功加入穿膜肽PTD和6个组氨酸蛋白纯化标签,有利于获得高纯度蛋白,使重组蛋白能更顺利通过胞膜进入细胞及细胞核,为重组蛋白有效诱导IPSCs奠定基础。
材料和方法
1 材料
1.1 菌株、引物、载体、细胞 含有Oct4基因的质粒菌株pCX-OKS-2A购自Addgene.net;菌株E.coli strain ER2566和原核表达质粒pKYB购自New England Biolabs(NEB);菌株DH5α为本实验室保存;引物由Invitrogen合成;中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞株购于国家实验细胞资源共享平台(北京细胞中心)。
1.2 试剂 限制酶Nde I和Xho I购自New England Biolabs(NEB);Taq酶和T4连接酶购自大连TaKaRa;PCR purification kit、Gel extraction kit 和Plasmid Miniprep kit购自Qiagen;小分子DNA marker(marker II&DL2000)购自Tiangen;低分子量蛋白标准(97-14.4 kD)购自Tiangen;IPTG购自Promega;HiTrap Chelating HP亲合层析柱购自GE;咪唑购自Merck;6×His抗体(Ⅰ抗)及HRP标记的Ⅱ抗均购自Santa Cruz;神经肽maxadilan(MAX)蛋白由本实验室合成[5];荧光素蛋白标记试剂盒购自喜润生化试剂公司。
2 方法
2.1 重组质粒pKYB-PTD-Oct4的构建 用质粒提取试剂盒提取pKYB质粒及含转录因子Oct4基因的菌株pCX-OKS-2A,利用引物悬挂延伸PCR法在Oct4基因的N端与C端分别加上编码穿膜肽PTD的序列(TATGGCCGTAAAAAACGTCGTCAGCGTCGTCGT)及6个组氨酸识别标签。采用3条引物做2次PCR得到PTD-Oct4重组基因。3条引物分别 为:F1,5’-XXXXXXCATATGTATGGCCGTAAAAAACGTCGTCAGCGTCGTCGT - 3’;F2,5’-AAAAAACGTCGTCAGCGTCGTCGTGCTGGACACCTGG-CTTCAGACTTC - 3’;F3,5’ -XXXXXXCTCGAGTTATCAATGATGATGATGATGATGGTTTGAATGCATGGGAGAGCCCAG-3’。用Nde I和 Xho I 2种酶分别对PTD-Oct4重组基因和pKYB的质粒进行双酶切,使用T4 DNA连接酶,得到重组质粒pKYBPTD-Oct4,相关构建示意图见图1。
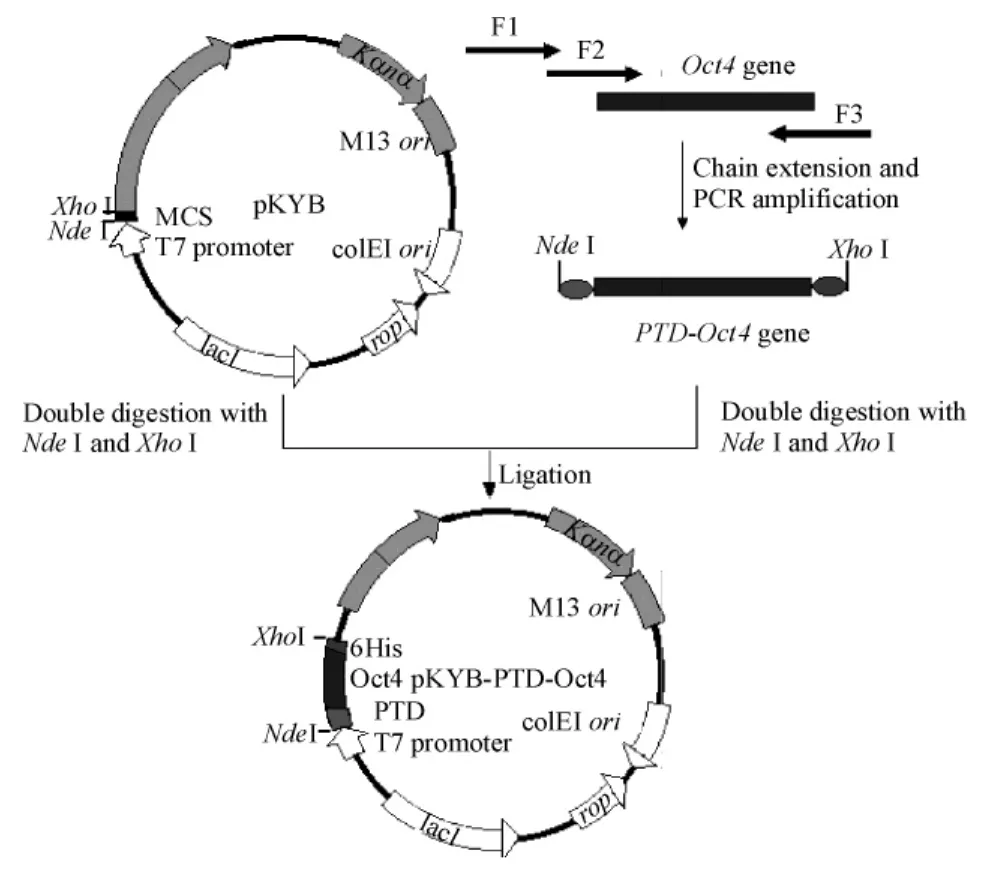
Figure1.Construction of expression plasmid pKYB-PTDOct4.图1 重组质粒pKYB-PTD-Oct4的设计及合成示意图
2.2 重组质粒鉴定与转化 连接产物转化E.coli DH5α,提取单克隆质粒进行PCR鉴定。鉴定引物为:上游引物F1(序列同上);下游引物OctJD5’-GCTTTCCACTCGTGCTCCTGC -3’;设计阳性克隆可扩增300 bp大小的片段。阳性克隆进一步通过酶切鉴定与测序鉴定确认。提取含正确阳性克隆的质粒并将其转化表达宿主菌ER2566中,得到原核表达菌株pKYB-PTD-Oct4-ER2566。
2.3 重组蛋白PTD-Oct4的诱导表达及纯化
转轮除湿是采用固体吸附剂对空气进行除湿,潮湿空气通过转轮的除湿区域,空气中的水蒸汽被固体吸附剂吸收,形成干燥的送风,在再生区域,固体吸附剂失去水分,实现再生。转轮除湿效果好,出风含湿量小,缺点在于转轮再生时需要消耗大量的热源,耗能高,适用于需要低湿的环境。
① 诱导浓度筛选 设置IPTG诱导浓度为0.2、0.4、0.6、0.8 mmol/L,30℃诱导3 h,高速离心收集菌体,用超声破碎并制样,使用SDS-PAGE(12%分离胶)检测重组Oct4蛋白的诱导表达情况,可溶性融合蛋白含量最高者即为最佳IPTG诱导浓度。
②洗柱浓度的筛选 设置咪唑缓冲液的浓度分别为20、40、60、80 mmol/L,洗杂蛋白,收集洗柱流出液制样,样品用SDS-PAGE(12%分离胶)检测,洗出杂蛋白最多且无目的蛋白或目的蛋白损失最少者,为最佳洗柱咪唑浓度。
③重组蛋白的制备及Western blotting鉴定 用上述条件诱导并纯化蛋白,经上样,洗脱杂蛋白后,用500 mmol/L咪唑洗脱得到目的蛋白,将所得蛋白用蒸馏水透析20-23 h、真空冷冻10-12 h得到干燥蛋白,利用抗6个聚合组氨酸的抗体(Bioworld)进行Western blotting鉴定。
2.4 重组蛋白活性测定
①荧光法检测重组蛋白穿膜能力 采用荧光素蛋白标记试剂盒标记重组蛋白,具体操作为:将重组蛋白PTD-Oct4干粉用PBS溶解并与异硫氰酸荧光素(fluorescein isothiocyanate,FITC)(激发波长为490 nm,发射波长为525 nm)按1∶8(V/V)混合,标记,过凝胶柱纯化,去掉未结合的FITC。计算蛋白标记效率(单位:A495/g),公式如下:
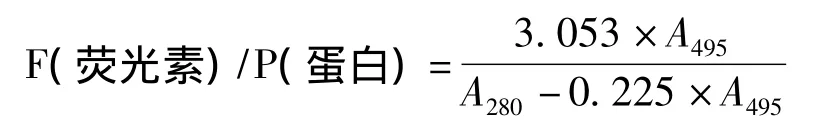
标记蛋白在24孔板(每孔加入200 μL标记液)中与CHO细胞37℃孵育1 h,阴性对照孔中加FITC标记的已被本实验室证明其不具有穿膜活性的MAX[5]。用 PBS清洗4次,每次10 min,加入冰预冷的甲醇400 μL,-20℃固定5 min,10%甲醛室温固定10 min后再用PBS清洗3次(以上步骤需避光操作),用倒置荧光显微镜观察重组蛋白穿膜效果。
②计算重组蛋白穿膜效率 将经上述处理的CHO细胞用细胞裂解剂RIPA裂解,收集细胞裂解液,以RIPA为空白对照,用多标记检测仪(Victor 3 Perkin Elmer)检测细胞裂解液中A495吸收值。按公式计算蛋白穿膜效率:进入细胞蛋白量=A495/蛋白标记效率;蛋白穿膜效率=进入细胞的标记蛋白量/加入的标记蛋白总含量。每组实验重复3次,结果以均数±标准差()表示,采用两样本均数的t检验,用SPSS统计软件进行分析。
③FRET检测重组蛋白与DNA结合特异性 荧光共振能量转移(fluorescence resonance energy transfer,FRET)在本实验中首次用来检测重组细胞因子与目的DNA结合的生物活性。其具体的原理为:异硫氰酸荧光素FITC(激发波长490 nm,发射波长525 nm)标记重组的细胞因子PTD-Oct4;花青素类染料Cy3(激发波长550 nm,发射波长565 nm)标记含有Oct4因子特异结合DNA区域ATGCAAAT[6]。当细胞因子PTD-Oct4与含有结合区域ATGCAAAT的DNA片段特异结合(两者距离<0.05 nm)时,FITC接受490 nm激发光而将其能量传给 Cy3,扫描450-650 nm发射光谱,检测Cy3的发射光谱变化,判断细胞因子PTD-Oct4是否与目的DNA结合。
化学合成2条寡核苷酸序列:5’-ATGCATGCAAATATGCAAAT-3’和 5’-CAGT ATTTGCATATTTGCAT-3’,经过95 ℃ 5 min,55 ℃ 5 min,0℃ 5 min,从而获得含有Oct 4因子特异结合区域ATGCAAAT的双链DNA片段。结合实验设非Oct4因子特异结合DNA片段ATGCCCCCAGTCACCCTAGC为阴性对照。将10 μL FITC标记的PTDOct4加入石英比色皿中,再加入500 μL PBS,随后每次加入20 μL 5’端CY3标记的Oct4特异结合DNA双链(30 mmol/L),连续加入,然后用荧光/磷光/发光分光光度计进行检测,发射波长为450 nm,检测波长范围450-650 nm。
结 果
1 质粒pKYB-PTD-Oct4的构建
1.1 PCR鉴定质粒pKYB-PTD-Oct4 利用引物F1和OctJD对重组子通过PCR扩增进行初步鉴定,可以看出2、4、5、6、7泳道与1泳道的以含有 Oct4基因的pCX-OKS-2A质粒为模板的PCR产物相同,均在300 bp附近有明显扩增带,见图2。选送4、6、7号单克隆进一步测序鉴定。
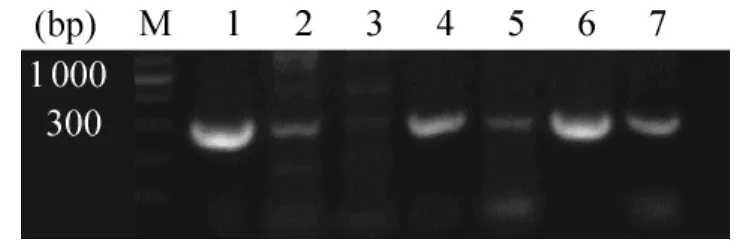
Figure2.PCR identification of pKYB-PTD-Oct4 prokaryotic expression vector.M:marker;Lane 1:PCR amplification product using pCX-OKS-2A as a the template;Lane 2,4,5,6,7:identification of the positive clones;Lane 3:identification of the negative clone.图2 重组表达载体pKYB-PTD-Oct4的PCR鉴定
1.2 重组质粒pKYB-PTD-Oct4酶切鉴定 重组质粒pKYB-PTD-Oct4经Nde I和Xho I双酶切鉴定结果,酶切片段大小分别在1000 bp、6000 bp附近,分别与目的基因PTD-Oct4(1.1 kb)和表达载体pKYB(6.0 kb)大小一致,见图3。
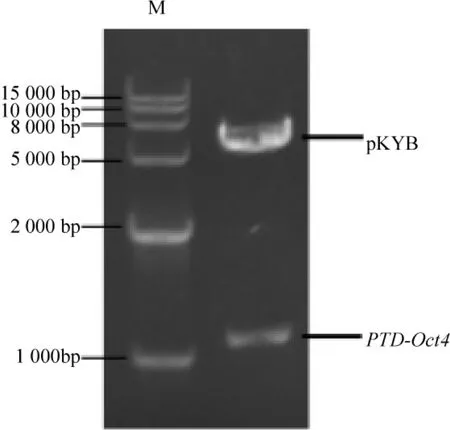
Figure3.Identification of pKYB-PTD-Oct4 digested by Nde I and Xho I.图3 重组表达质粒pKYB-PTD-Oct4的Nde I和 Xho I的酶切鉴定
1.3 重组质粒pKYB-PTD-Oct4测序鉴定 测序结果表明Oct4基因已按设计插入表达载体pKYB,重组质粒pKYB-PTD-Oct4构建成功。
2 表达菌pKYB-PTD-Oct4-ER2566诱导表达的IPTG诱导浓度筛选
设置不同的IPTG诱导浓度进行筛选,结果显示0.4 mmol/L的工作浓度的IPTG足以诱导PTDOct4的有效可溶性表达。
3 镍(Ni2+)柱亲和层析纯化PTD-Oct4蛋白咪唑浓度筛选
采用HiTrap Chelating HP亲合层析柱对可溶性蛋白进行纯化,设置梯度浓度的咪唑进行洗脱,从而筛选最佳的洗柱浓度。结果显示咪唑最佳洗柱浓度为60 mmol/L,此时杂蛋白已基本被洗去,获得的重组蛋白PTD-Oct4基本无杂蛋白污染。
4 重组蛋白PTD-Oct4的Western bloting鉴定
根据以上优化的诱导及纯化条件,用500 mL摇瓶进行扩大培养,Ni2+柱纯化获得的重组PTD-Oct4融合蛋白,见图4A,经过透析、冻干后制备蛋白干粉。用6个组氨酸的抗体进行Western blotting检测,结果显示成功获得重组蛋白PTD-Oct4,见图4B。
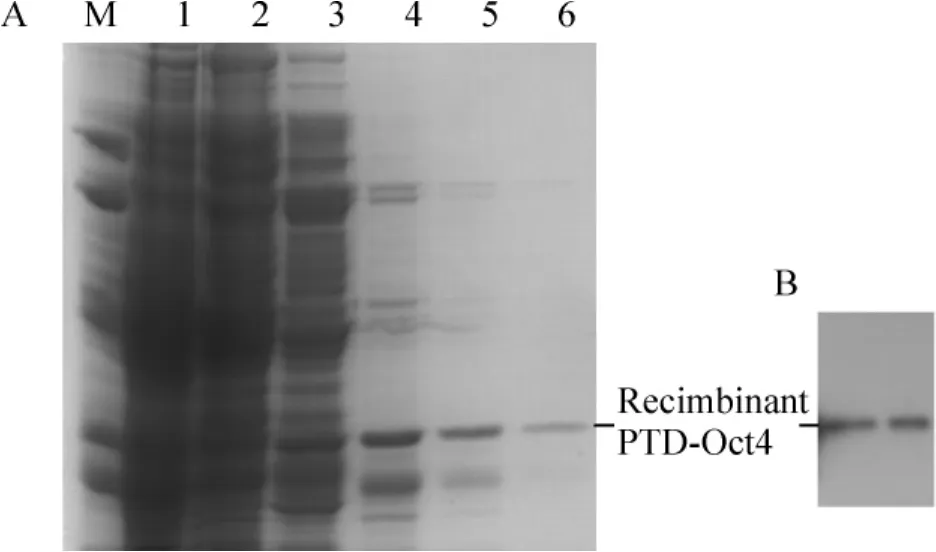
Figure4.Purification of PTD- Oct4 by Ni2+affinity chromatography(A)and Western blotting identification of PTD-Oct4(B).M:marker;Lane 1:uninduced cells;Lane 2:deposit of induced cells(induced with 0.4 mmol/L IPTG);Lane 3:supernatant of induced cells;Lane 4:40 mmol/L imidazole wash;Lane 5:60 mmol/L imidazole wash;Lane 6:the target protein PTD-Oct4 eluted with 100 mmol/L imidazole.图4 镍柱亲和层析纯化PTD-Oct4蛋白和PTD-Oct4的Western blotting鉴定
5 重组PTD-Oct4蛋白活性测定
5.1 重组PTD-Oct4蛋白穿膜能力检测 PTD能够介导蛋白穿透细胞膜,实现蛋白在细胞与细胞之间传递。将重组PTD-Oct4进行FITC标记后与CHO细胞孵育,荧光显微镜检测,见图5,可见PTD-Oct4组在细胞内有大量荧光,并聚集在细胞核中,而在不能穿膜的MAX组细胞内没有显著的荧光信号,此实验结果表明重组PTD-Oct4能够顺利进入细胞,并定位细胞核。

Figure5.Investigation of penetrating ability of the fusion protein PTD-Oct4(×100).A:CHO cells incubated with PTD-Oct4 labeled with FITC;B:CHO cells incubated with MAX.图5 重组蛋白PTD-Oct4穿细胞膜的荧光显微镜观察
5.2 穿膜效率检测 按照方法2.4②测定FITC标记蛋白进入细胞的效率,结果重组PTD-Oct4进入细胞效率为(28.3±2.4)%;没有带入膜信号的MAX进入细胞效率为(7.6±1.9)% ,见图6。两组均数比较,P<0.01,显著差异,表明重组PTD-Oct4能够有效进入细胞。
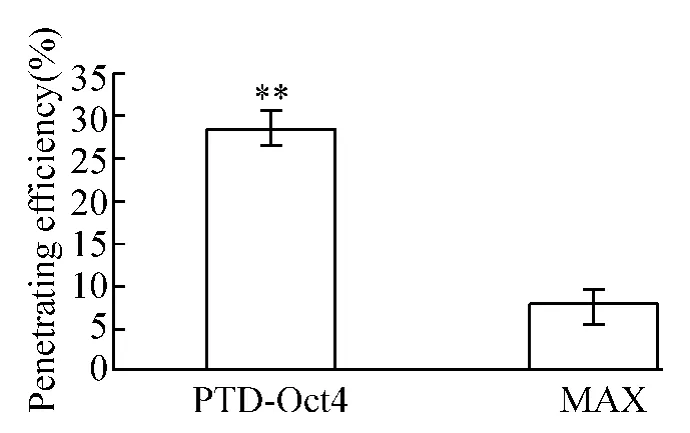
Figure6.Penetrating efficiency of the fusion protein PTD -Oct4..n=3.**P<0.01 vs MAX.图6 重组蛋白PTD-Oct4穿细胞膜效率测定
6 蛋白PTD-Oct4特异结合DNA序列
在重组PTD-Oct4蛋白中加入Oct4特异结合序列双链(ATGCATGCAAATATGCAAAT),随着双链DNA浓度的增加,515 nm处激发光明显减弱,而在565 nm处发射光逐渐增强且呈浓度依赖形式(▼);FITC标记的重组PTD-Oct4中加入非Oct4特异结合序列(ATGCCCCCAGTCACCCTAGC),随着寡链DNA浓度增加,发射光虽然有低水平的非特异性波动,但没有显著的增加(▽),见图7。此实验结果表明重组PTD-Oct4因子能够特异识别并结合目的DNA序列,具有预期的生物学活性。
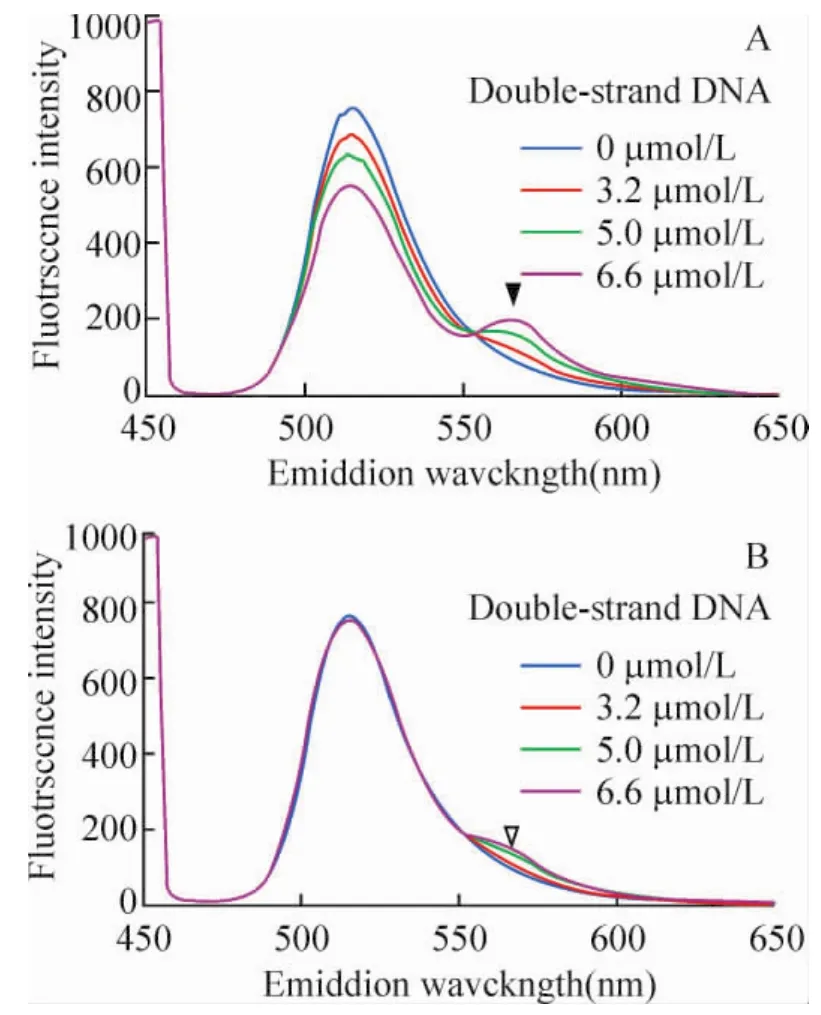
Figure7.The FRET scanned spectrum of PTD-Oct4 and its target DNA sequence.A:the Oct4 target DNA labeled with Cy3 was gradually added to the recombinant PTD-Oct4;B:the Oct4 nontarget DNA was used as negative control.图7 FRET检测重组蛋白PTD-Oct4和目的DNA序列的结合活性
讨 论
1997年,Wilmut等[7]利用核转移技术将乳腺细胞核转移至去核的生殖细胞核内,发育出与供体羊基因一致的Dolly羊,进一步促进了基因转移、干细胞生殖发育等的研究。2003年Chen等[8]将人皮肤细胞核与去核的兔卵母细胞融合,成功获得融合胚胎,并发育至囊胚阶段,证明可对人体细胞核进行重新编程研究。相关干细胞研究面临着严重的伦理道德挑战,因此不得不寻求其它途径解决。2006年Takahashi等[1]等首次诱导分化出与胚胎干细胞类似的IPSCs。从此,拉开了从体细胞向干细胞逆向转化的序幕。胚胎源性人类多能干细胞和重编程的(reprogrammed)体细胞来源的人类多能干细胞的共同特征包括无限增殖和持久、广泛地向各种类型细胞分化的潜能。至今为止,已经有多种细胞为种子细胞并成功重编程诱导为IPSCs,例如:角质细胞、肝脏细胞、黑色素细胞、神经细胞等[9-12]。Kim 等[13]在重组的4因子蛋白C端连接细胞穿膜肽(cell-penetrating peptide,CPP),这样的融合蛋白可穿透细胞膜进入细胞内部,执行其重编程的功能。成功蛋白诱导人成纤维细胞重编程为IPSCs,但是诱导 IPSCs的效率很低,仅有0.001%,而且蛋白容易失活。即使这样,从IPSCs临床应用的安全角度来看,它仍然是目前最安全的方法。
FITC荧光素蛋白标记依靠其N=C=S基团与蛋白-NH2基团偶联,从而标记在待测蛋白上。然后用490 nm激发光激发,经525 nm滤光片即可观察荧光信号。FRET作为一种高效的光学“分子尺”,在生物大分子相互作用、免疫分析、核酸检测等方面有广泛的应用。本研究采用的将FITC荧光标记了的重组蛋白PTD-Oct4与Cy3标记了的Oct4特异结合双链ATGCAAAT序列结合后,观测能量共振转移了之后的发射光谱,发现在515 nm处FITC的荧光明显减弱,于此同时,565 nm处的Cy3发射光明显增强。所以FITC作为此次能量共振的供体成功将发射光能量共振转移激发能量受体Cy3,说明被FITC标记的重组蛋白与目的基因片段靠得足够近,与Ellington等[14]的理论相印证,即重组蛋白PTDOct4对DNA片段有很强的结合活性。Cremazy等[15]分别用荧光染料Sytox Orange和绿色荧光蛋白GFP进行标记,并运用FRET-FLM技术在原位检测到DNA和组蛋白H2B相互作用。目前为止,未见运用FRET法体外检测核转录因子与特异核酸序列结合活性的方法的报道。我们采用FRET对重组PTD-Oct4结合特异DNA序列的活性成功进行检测,FITC与Cy3这2个荧光发色基团能够顺利进行荧光能力共振转移,且证明了体外运用进行蛋白与DNA双链的结合反应的可行性,具有广泛应用的价值。
另外,未带PTD的MAX进入细胞效率为(2.7±1.9)%,不能忽视MAX被检测进入细胞的原因:(1)可能是由于FITC与CHO细胞孵育完后,洗涤游离FITC时不彻底;(2)有少量胞膜受损细胞,少量MAX经受损细胞膜进入细胞内;(3)是否因无法实现目标蛋白特异性地定点标记,无法保证被标记的蛋白保持其原有的活性,被FITC标记的蛋白结构发生了改变,(4)其它未知原因,需要进一步探讨验证。
本研究以Oct4为研究对象,通过PCR的方法得到Oct4基因,在原核表达载体中表达的生物大分子不能穿透细胞膜进入细胞中,因此研究将Oct4基因与穿膜肽基因PTD融合,使其表达产物能够穿过细胞膜与核膜进入细胞核,发挥转录活性;还成功鉴定了重组蛋白PTD-Oct4的正确表达、顺利纯化且具有高效生物活性,为体外重组蛋白诱导IPSCs的产生与应用奠定基础。
[1]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663 - 676.
[2]Yu J,Vodyanik MA,Smuga-Otto K,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318(5858):1917 -1920.
[3]Zhou H,Wu S,Joo JY,et al.Generation of induced pluripotent stem cells using recombinant proteins[J].Cell Stem Cell,2009,4(5):381 -384.
[4]Zangrossi S,Marabese M,Broggini M,et al.Oct-4 expression in adult human differentiated cells challenges its role as a pure stem cell marker[J].Stem Cells,2007,25(7):1675-1680.
[5]曾 乐,余榕捷,徐明芳,等.重组PTD-maxadilan的制备与鉴定[J].生物工程学报,2009,25(11):1739-1745.
[6]Klemm JD,Rould MA,Aurora R,,et al.Crystal structure of the Oct-1 POU domain bound to an octamer site:DNA recognition with tethered DNA-binding modules[J].Cell,1994,77(1):21 -32.
[7]Wilmut I,Schnieke AE,McWhir J ,et al.Viable offspring derived from fetal and adult mammalian cells[J].Nature,1997 ,385(6619):810-813.
[8]Chen Y,He ZX,Liu A,et al.Embryonic stem cell generated by nuclear transfer of human somatic nuclei into rabbit oocytes[J].Cell Res,2003,13(4):251 -263.
[9]Aasen T,Raya A,Barrero MJ,et al.Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes[J].Nat Biotechnol,2008,26(11):1276 -1284.
[10]Maherali N,Ahfeldt T,Rigamonti A,et al.A high-efficiency system for the generation and study of human induced pluripotent stem cells[J].Cell Stem Cell,2008,3(3):340-345.
[11]Eminli S,Utikal J,Arnold K,et al.Reprogramming of neural progenitor cells into induced pluripotent stem cells in the absence of exogenous Sox2 expression[J].Stem Cells,2008,26(10):2467-2474.
[12]Aoi T,Yae K,Nakagawa M,et al.Generation of pluripotent stem cells from adult mouse liver and stomach cells[J].Science,2008,321(5889):699-702.
[13]Kim D,Kim CH,Moon JI,et al.Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins[J].Cell Stem Cell,2009,4(6):472-476.
[14]Ellington AD,Szostak JW.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990,346(6287):818-822.
[15]Cremazy FG,Manders EM,Bastiaens PI,et al.Imaging in situ protein-DNA interactions in the cell nucleus using FRET -FLIM[J].Exp Cell Res,2005,309(2):390 -396.
