黄芪多糖对早期糖尿病肾病大鼠足细胞nephrin和podocin表达的影响*
2011-08-02李志杰刘煜敏陆海英李亚丽
李志杰,张 悦,刘煜敏,陆海英,李亚丽,张 燕
(上海中医药大学1科技实验中心,2基础医学院,3护理学院,上海 201203)
糖尿病肾病(diabetic nephropathy,DN)又称糖尿病肾小球硬化症,其特点主要以肾小球血管受损、硬化为主,临床上表现为尿蛋白排泄量增加[1]。大量研究表明,肾小球脏层上皮细胞即足细胞损伤是形成DN蛋白尿的关键因素[2,3]。而维持足细胞结构和功能的主要裂孔隔膜蛋白分子(nephrin和podocin)表达改变是足细胞损伤的重要标志。黄芪多糖(Astragalus polysaccharin,APS)是从补气中药黄芪中提取的有效成分。临床与实验证明黄芪多糖可以通过多条途径对DN发挥治疗作用[4,5],但是通过稳定足细胞标志蛋白nephrin和podocin的表达而发挥保护作用未见报道。本研究旨在通过观察nephrin和podocin在DN大鼠肾小球足细胞中表达的变化,探讨黄芪多糖对DN肾脏的保护作用及机制。
材料和方法
1 材料
1.1 动物 健康SPF级雄性SD大鼠24只,体重(220±20)g,由上海斯莱克实验动物有限责任公司提供,动物许可证号为SCXK(沪)2007-0005。
1.2 药物与试剂 黄芪多糖购于森馨生物,纯度70%。链脲佐菌素(streptozocin,STZ)购于 Sigma,批号为119K1591。山羊抗兔nephrin抗体、山羊抗兔podocin抗体购于Abcam。小鼠来源GAPDH(甘油醛-3-磷酸脱氢酶)购于上海康成公司。HRP标记的山羊抗小鼠Ⅱ抗、HRP标记的山羊抗兔Ⅱ抗购于晶美生物工程有限公司。PVDF膜购于Millipore。其它试剂均为国产分析纯。
1.3 主要仪器 强生稳步型血糖测试仪(强生中国有限公司),酶标仪(BioTek PowerWave XS2),电泳装置(Bio-Rad),倒置荧光显微镜(Olympus CKX41),全自动荧光成像系统(HR 16)。
2 方法
2.1 糖尿病肾病模型的制备和分组 动物适应性喂养1周后,禁食12 h,按60 mg·kg-1对造模大鼠(16只)行一次性腹腔注射STZ(0.1 mol·L-1柠檬酸盐缓冲液,pH 4.5,新鲜配制)。正常对照组(8只)大鼠注射等量柠檬酸盐缓冲液。各组大鼠给予标准饮食喂养,自由饮水。1周后尾静脉取血,空腹血糖≥16.7 mmol·L-1为糖尿病大鼠。将成模大鼠随机分为STZ组(8只)和STZ+APS组(8只)。黄芪多糖按 400 mg·kg-1·d-1灌服,连续 8 周。正常对照组、STZ组灌服等量生理盐水。
2.2 标本收集 在实验结束前1 d代谢笼收集24 h尿液并记录24 h尿量。大鼠处理前称重,以20%乌拉坦1.5 g·kg-1的剂量腹腔注射麻醉,腹主动脉取血,分离血清,-20℃保存。取双侧肾脏,用滤纸吸干肾表面血液后称重,取部分肾组织固定于甲醛中用于石蜡切片;其余肾组织置液氮中冷冻后以-80℃冰箱保存备用。
3 测定的指标
3.1 一般情况观察 观察大鼠精神状态、活动状况、毛发及体重、排便情况。
3.2 肾指数的测定 将大鼠麻醉后处死,迅速剖腹取两侧肾,用滤纸吸干肾表面血液后称重。肾指数=两侧肾重量和(g)/体重量(kg)×100%。
3.3 血糖 分别于黄芪多糖干预后第2、5、8周尾静脉取血检测血糖。
3.4 各组大鼠24 h尿蛋白总量的测定 按照试剂盒说明书(BBC法)步骤测定24 h尿蛋白总量。
3.5 血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCr)的测定 血清尿素氮、血清肌酐按试剂盒说明书分别采用脲酶法和苦味酸法(除蛋白)检测。
3.6 肾脏病理检查 取肾皮质,10%甲醛固定,乙醇脱水、二甲苯透明、石蜡包埋、制成3 μm石蜡切片,HE染色后光镜观察。
3.7 肾组织nephrin及podocin蛋白表达的分析
①肾组织总蛋白的提取及蛋白定量 取-80℃保存的肾组织约100 mg,置入1.5 mL的Eppendorf管中,加入预冷的裂解缓冲液1 mL,于冰浴中用超声破碎仪匀浆3次,后置于冰上20 min;4℃、12000 r/min离心15 min;吸取上清置于另一1.5 mL Eppendorf管中,-80℃保存2 d,解冻后12000 r/min离心15 min,取上清即为所提取的蛋白溶液。取少量上清按照BCA蛋白定量试剂盒操作步骤进行定量。将所有蛋白样品调至等浓度,充分混合加2×LB上样缓冲液后于100℃煮沸变性5 min,保存于-20℃冰箱。剩余蛋白分装后-80℃低温储存。
②Western blotting检测nephrin及podocin蛋白表达取出已变性的蛋白样品。每孔加50 μg蛋白样品电泳,积层胶电压80 V,分离胶电压120 V。电泳结束后转膜1-2 h(经甲醇处理的PVDF膜),将转有蛋白的膜置于5%BSA封闭1 h后,置于I抗(nephrin、podocin I抗分别用封闭液 1∶400、1∶2000 稀释,GAPDH内参照按1∶5000稀释)中,置4℃冰箱中振荡过夜,1×TTBS洗3次,每次10 min。置HRP标记的Ⅱ抗(用封闭液1∶5000稀释)中孵育2 h,1×TTBS洗3次,每次10 min,在暗室取ECL剂A和B各1 mL,混合后覆盖膜上,1.5 min后弃去化学发光试剂,将膜放入暗盒内,用X光胶片进行曝光、显影及定影。条带相对灰度值:目的条带灰度值/同个样品GAPDH灰度值。
4 统计学处理
结 果
1 一般情况
正常对照组大鼠精神状况良好,毛皮有光泽,动作自如反应灵敏。STZ组大鼠精神萎靡,反应迟钝,活动倦怠,毛发杂乱泛黄无光泽偶有脱毛,尿量多,每天换垫料1-2次,体重下降明显;STZ+APS组大鼠反应较灵敏,毛色可,尿多、体重较STZ大鼠有所增加。
2 各组大鼠体重和肾指数的比较
与正常对照组比较,STZ组大鼠体重明显降低、肾指数明显升高(P<0.01);与STZ组比较,STZ+APS组大鼠体重明显升高、肾指数明显降低 (P<0.05),见表 1。
表1 各组大鼠体重和肾指数比较Table1.Comparison of the body weight and renal index in rats of different groups(.n=8)

表1 各组大鼠体重和肾指数比较Table1.Comparison of the body weight and renal index in rats of different groups(.n=8)
**P <0.01 vs control;#P <0.05 vs STZ group.
Group Body weight(g)Renal index Control 519.0 ±52.6 5.5 ±1.4 STZ 221.0 ±19.4** 15.2 ±2.8**STZ+APS 261.0 ±25.4**# 12.1 ±2.0**#
3 各组大鼠血糖的比较
STZ组大鼠在造模成功后,随时间的推移血糖逐渐稳定;而STZ+APS组大鼠随着黄芪多糖干预时间的延长,血糖逐渐降低,第8周时大鼠血糖明显下降(P <0.05),见表2。
表2 黄芪多糖对各组大鼠血糖的影响Table2.The effect of APS on blood glucose concentration in diabetic rats(mmol/L..n=8)
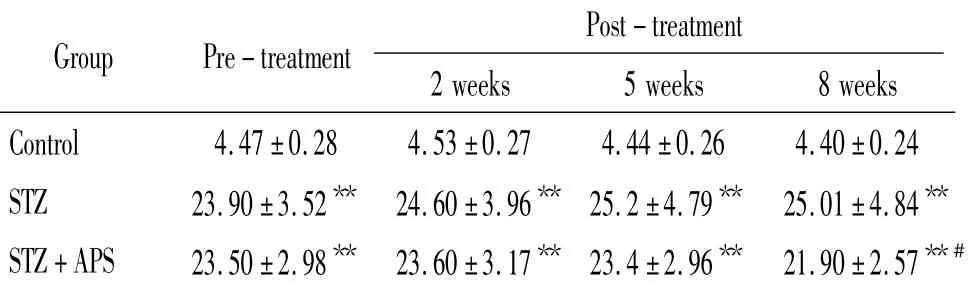
表2 黄芪多糖对各组大鼠血糖的影响Table2.The effect of APS on blood glucose concentration in diabetic rats(mmol/L..n=8)
**P <0.01 vs control;#P <0.05 vs STZ group
Post-treatment Group Pre-treatment2 weeks 5 weeks 8 weeks Control 4.47 ±0.28 4.53±0.27 4.44±0.26 4.40 ±0.24 STZ 23.90±3.52** 24.60±3.96** 25.2±4.79** 25.01±4.84**STZ+APS 23.50±2.98** 23.60±3.17** 23.4±2.96** 21.90±2.57**#
4 各组大鼠24 h尿蛋白总量及血液生化指标比较
STZ组大鼠24 h尿蛋白总量明显高于正常对照组(P<0.01),黄芪多糖干预后,大鼠24 h尿蛋白总量明显低于STZ组(P<0.05)。与正常对照组比较,STZ组大鼠血尿素氮、血肌酐有明显增高(P<0.01),而黄芪多糖干预后,大鼠血尿素氮和血肌酐均有明显下降(P<0.05),见表3。
表3 各组大鼠24 h尿蛋白总量,尿素氮和肌酐比较Table3.Comparison of the 24-hour total urine protein,BUN and SCr in rats of different groups(.n=8)
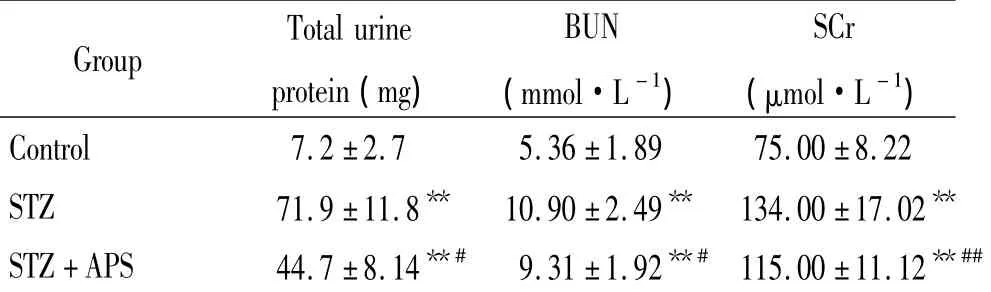
表3 各组大鼠24 h尿蛋白总量,尿素氮和肌酐比较Table3.Comparison of the 24-hour total urine protein,BUN and SCr in rats of different groups(.n=8)
**P <0.01 vs control;#P <0.05 vs STZ group.
Total urineBUNSCr Group protein(mg)(mmol·L -1)(μmol·L -1)Control 7.2 ±2.7 5.36 ±1.89 75.00 ±8.22 STZ 71.9 ±11.8** 10.90 ±2.49** 134.00 ±17.02**STZ+APS 44.7 ±8.14**# 9.31 ±1.92**# 115.00 ±11.12**##
5 各组大鼠肾组织病理变化
HE染色可见正常对照组大鼠肾组织形态正常,小球形态规则,小管排列紧密整齐,肾小管上皮细胞形态正常,见图1A、B。STZ组大鼠肾小球肥大、毛细血管基底膜增厚,系膜基质增生,肾小管上皮细胞空泡样变,可见蛋白管型,见图1C、D。STZ+APS组大鼠肾小球形态基本正常,仅有少量肾小管上皮细胞空泡样变,病变明显轻于STZ组,见图1E、F。
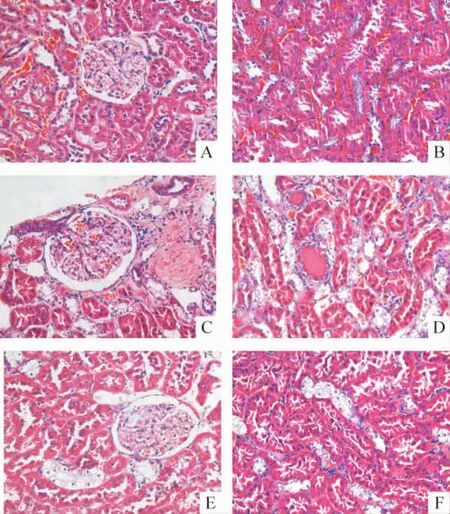
Figure1.The pathological changes of rat kidney tissues in different groups(HE staining,×400).A,B:control group;C,D:STZ group;E,F:STZ+APS group.图1 各组大鼠肾组织病理变化
6 黄芪多糖对DN大鼠nephrin和podocin表达的影响
STZ组大鼠肾组织nephrin的水平明显低于正常对照组(P<0.01),STZ+APS组大鼠肾组织nephrin表达明显高于STZ组(P<0.05),见图2。糖尿病大鼠肾组织podocin表达明显低于正常对照组(P<0.01),STZ+APS组大鼠肾组织podocin表达明显高于STZ组(P<0.05),见图3。
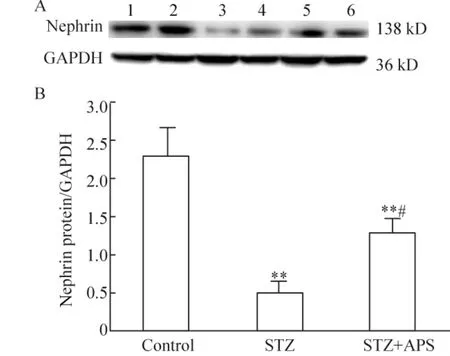
Figure2.Protein expression of nephrin was detected by Western blotting.The GAPDH was used as self- control.A:the result of Western blotting;B:the ratio of nephrin protein band density to GAPDH band density.Lane 1,2:control group;Lane 3,4:STZ group;Lane 5,6:STZ+APS group..n=4.**P<0.01 vs control group;#P <0.05 vs STZ group.图2 各组大鼠肾组织nephrin蛋白表达的比较
讨 论
糖尿病肾病属中医消渴并发水肿的范畴。在中医学中虽无糖尿病肾病的病名,但对本病的病机及症状早有论述。按其发病机制、临床表现隶属于“虚劳”、“肾劳”、“水肿”、“胀满”、“吐逆”、“肾消”、“关格”等范畴。黄芪味甘,性微温,归肺、脾经。具有补气升阳,益气固表,敛疮生肌,利水消肿之功效。《名医别录》记载:“治丈夫虚劳,五劳羸瘦、止渴、腹痛泄痢,益气,利阴气”,历代医家均用之治消渴。研究者统计治疗消渴的方剂,古方中使用黄芪者占20.5%,现代方使用黄芪者占63.8%,利用司氏归纳法分析多个治疗糖尿病的方剂发现,药物应用次数最多是黄芪[6]。
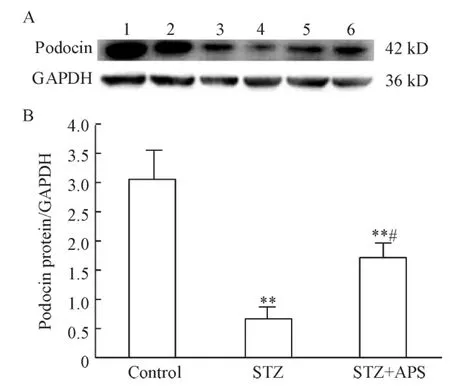
Figure3.Protein expression of podocin was detected by Western blotting.The GAPDH was used as self- control.A:the result of Western blotting;B:the ratio of podocin protein band density to GAPDH band density.Lane 1,2:control group;Lane 3,4:STZ group;Lane 5,6:STZ+APS group..n=4.**P<0.01 vs control;#P <0.05 vs STZ group.图3 各组大鼠肾组织podocin蛋白表达的比较
糖尿病肾病是糖尿病常见的微血管并发症,其发生发展是遗传易感性及高血糖之间长期相互作用,多因素共同参与的结果,基本病理改变为肾小球基底膜增厚和系膜区大量基质样物质增生,临床表现为持续的尿蛋白排泄增加。足细胞结构及功能的改变是蛋白尿产生的病理基础,并成为糖尿病肾病持续进展的关键因素[7,8]。肾小球疾病引起足突融合、裂孔隔膜结构紊乱后,多种足细胞特异性标志蛋白(如:nephrin与podocin)随之发生改变,从而影响足细胞结构和功能。Nephrin是组成裂孔隔膜的主要成分,并特异性表达于裂孔隔膜上的一种跨膜蛋白。Toyoda等[9]利用原位杂交的方法检测到糖尿病肾病患者足细胞nephrin mRNA表达明显减少,且与糖尿病肾病蛋白尿的进展呈负相关。Barutta等[10]利用RT-PCR方法检测到STZ诱导的实验性糖尿病小鼠肾组织nephrin mRNA表达减少,采用免疫组化、免疫印迹方法检测到小鼠肾脏nephrin蛋白表达下降。本研究发现,DN大鼠肾脏nephrin蛋白表达降低,与以往研究结果一致。关于DN足细胞nephrin蛋白可能的去向有两种:其一,高糖环境中,机体合成的nephrin剪接异构体缺乏跨膜区域,使其在裂孔隔膜上失去稳定性,易于脱离裂孔隔膜到尿液中,使 nephrin 蛋白表达水平降低[11,12];其二,糖尿病状态下,高糖激活PKC可以诱导足细胞发生胞吞作用,将nephrin吞噬到细胞内,使 nephrin表达减少[13]。Podocin是继nephrin后发现的一种特异性表达于裂孔隔膜的膜蛋白,呈发夹样的结构。Baelde等[14]研究发现糖尿病肾病患者足细胞podocin蛋白表达降低,且其表达减少与尿蛋白增加相关。研究证实podocin羧基末端与nephrin胞内段羧基末端相互作用参与nephrin与细胞骨架的连接,可加强nephrin诱导的信号转导[15]。本实验发现,DN大鼠足细胞nephrin和podocin的蛋白表达水平同时下降,它们之间是否存在因果关系有待于进一步研究。
本研究结果显示,DN大鼠血糖、肾系数、24 h尿蛋白总量、血尿素氮和血肌酐明显升高,体重明显下降;肾组织病理见肾小球肥大,毛细血管基底膜增厚,系膜基质增生,肾小管上皮细胞空泡样变,见蛋白管型,nephrin和podocin表达减少。从模型大鼠的肾功能变化和病理改变来看,本实验成功复制了大鼠糖尿病肾病模型。应用黄芪多糖干预后,发现其可以减轻糖尿病肾脏病理改变,改善肾功能,并降低血糖,同时维持nephrin和podocin蛋白的表达。由此可见,黄芪多糖对DN肾脏保护作用的机制可能与降低血糖、稳定DN状态下足细胞nephrin和podocin表达量相关。
[1]彭万年,罗 仁,李保良,等.糖尿病肾病研究[M].第1版.北京:中国科技出版社,2006.1-17.
[2]Akhtar M,AlMana H.Molecular basis of proteinuria[J].Adv Anat Pathol,2004,11(6):304 -309.
[3]White KE,Bilous RW,Diabiopsies Study Group.Structural alterations to the podocyte are related to proteinuria in type 2 diabetic patients[J].Nephrol Dial Transplant,2004,19(6):1437-1440.
[4]曹 闻,张莹雯.黄芪多糖冲剂治疗糖尿病肾病的临床观察[J].湖北中医杂志,2007,29(4):12-13.
[5]康 白,毛淑梅,李承德,等.黄芪多糖对糖尿病大鼠早期多尿的保护作用[J].中国药理学通报,2009,25(11):1470-1473.
[6]陈文华,詹锐文.黄芪多糖治疗糖尿病及其并发症的用药规律[J].中国中医药现代远程教育,2004,2(5):21-22.
[7]Wolf G,Chen S,Ziyadeh FN,et al.From the periphery of glomerular capillary wall toward the center of disease:podocyte injury comes of age in diabetic nephropathy[J].Diabetes,2005,54(6):1626 -1630.
[8]戴厚永,郑 敏,汤日宁,等.厄贝沙坦对早期糖尿病肾病大鼠足细胞损伤及整合素连接激酶的影响[J].中国病理生理杂志,2010,26(11):2175 -2179.
[9]Toyoda M,Suzuki D,Umezono T,et al.Expression of human nephrin mRNA in diabetic nephropathy[J].Nephrol Dial Transplant,2004,19(2):380 -385.
[10]Barutta F,Corbelli A,Mastrocola R,et al.Cannabinoid receptor 1 blockade ameliorates albuminuria in experimental diabetic nephropathy[J].Diabetes,2010,59(4):1046-1054.
[11]Doublier S,Salvidio G,Lupia E,et al.Nephrin expression is reduced in human diabetic nephropathy:evidence for a distinct role for glycated albumin and angiotensin II[J].Diabetes,2003,52(4):1023 -1030.
[12]Benigni A,Gagliardini E,Tomasoni S,et al.Selective impairment of gene expression and assembly of nephrin in human diabetic nephropathy[J].Kidney Int,2004,65(6):2193-2200.
[13]Tossidou I,Teng B,Menne J,et al.Podocytic PKC -alpha is regulated in murine and human diabetes and mediates nephrin endocytosis[J].PLoS One,2010,5(4):e10185.
[14]Baelde HJ,Eikmans M,Lappin DW,et al.Reduction of VEGF-A and CTGF expression in diabetic nephropathy is associated with podocyte loss[J].Kidney Int,2007,71(7):637-645.
[15]Hinkers S,Vlangos C,Heeringa S,et al.Specific podocin mutatious correlate with age of onset in steroid-resistant nephritic syndrome[J].J Am Soc Nephrol,2008,19(2):365-371.
