Ephrin-A3在脂多糖处理后星形胶质细胞增殖中的表达*
2011-08-02王继先张博爱
王继先,张博爱,刘 宇,何 昕,李 林,张 勤
(郑州大学第一附属医院神经内科,河南 郑州 450052)
中枢神经系统损伤后再生困难,其机制尚不完全明确,药物应用及康复训练等只能改善而不能完全恢复其原有功能,给社会、家庭及个人造成沉重负担,因此研究损伤后细胞反应及分子变化非常重要。研究表明Eph/ephrin在神经系统中发挥重要作用,不仅参与神经系统早期的形态发生、发展及功能塑造,还参与调节成年期突触可塑性以及中枢神经系统损伤后反应[1]。星形胶质细胞(astrocyte,AS)约占中枢神经系统细胞总数的90%,它不仅仅是一种营养支持细胞,还在突触形成及功能的控制、成体神经发育、信息交流、脑血流的调控、免疫调节[2]、检测神经元活力和释放化学递质调控神经元[3]等方面起重要作用,多年来的研究显示中枢神经系统损伤、神经系统退行性病变等与炎症有密切关系,而炎症反应可以激活AS。该实验通过脂多糖(lipopolysaccharide,LPS)诱导大鼠大脑皮层AS建立炎症模型,观察ephrin-A3在AS增殖中的表达变化,进一步探讨其在中枢神经系统损伤修复中的分子机制。
材料和方法
1 材料
1.1 主要试剂 DMEM培养基购自Hyclone。胎牛血清杭州四季青公司。多聚赖氨酸、兔抗GFAP多克隆抗体购自Sigma。Ephrin-A3多克隆抗体(Santa Cruz),吖啶橙(acridine orange,AO)∕嗅化乙啶(ethidium bromide,EB)荧光试剂盒、MTT试剂盒及CY3荧光试剂盒购自碧云天生物技术研究所。抗肿瘤坏死因子 α(tumor necrosis factor α,TNF - α)酶联免疫吸附试剂盒、白细胞介素6(interleukin,IL-6)酶联免疫吸附试剂盒购自武汉博士德生物制品公司。其它生化试剂均为进口分装或国产分析纯。
1.2 动物 SPF级健康新生(24 h内)Wistar大鼠,雌雄不限,由郑州大学医学院实验动物中心提供。
2 方法
2.1 原代大鼠AS的培养、纯化和鉴定 取新生24 h内的 Wistar大鼠,参照 McCarthy等[4]报道的方法进行细胞培养纯化。使用胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)鉴定所培养的 AS,取第3代AS(纯度>97%)用于实验研究。
2.2 实验分组 实验分为6组:空白对照组,LPS 10 mg/L作用30 min组、6 h组、24 h组、48 h组和72 h组。
2.3 AS形态学观察 应用倒置相差显微镜观察AS的生长情况及形态变化。
2.4 MTT法测定AS存活率 使用96孔培养板,每孔接种1×104细胞,置37℃、5%C02培养箱中培养3 d,细胞进入对数生长期后,加入LPS 100 μL(10 mg/L),每组复孔8 个(n=8),分别孵育30 min、6 h、24 h、48 h 和72 h 后,每孔加入 10 μL MTT 溶液,在细胞培养箱内继续孵育4 h。每孔加入100 μL formanzan溶化液,在37℃细胞培养箱内再继续孵育直至在显微镜下观察,Formazan结晶全部溶解。以空白孔调零,使用酶标仪测定570 nm波长的吸光度值(A值)。使用等量不加LPS的无血清DMEM作为对照组。
2.5 AO/EB检测AS凋亡率 各组AS培养至不同时点后应用AO/EB荧光试剂盒行AO/EB染色,操作步骤按照试剂盒说明书进行。荧光显微镜下观察,可见4种细胞形态:活细胞,核染色质着绿色并呈正常结构;早期凋亡细胞,核染色质着绿色并呈固缩状或圆珠状;晚期凋亡细胞,核染色质为橘红色并呈固缩状或圆珠状;非凋亡的死亡细胞,核染色质着红色并呈正常结构。高倍镜下随机选取4个视野分类计数细胞计算细胞凋亡率,细胞凋亡率=(早期凋亡细胞+晚期凋亡细胞)∕(活细胞+非凋亡的死亡细胞+早期凋亡细胞+晚期凋亡细胞)×100%。
2.6 ephrin-A3和GFAP表达的免疫荧光测定 各组星形胶质细胞培养至不同时点后以4%多聚甲醛固定,应用ephrin-A3和GFAPⅠ抗及CY3荧光试剂盒(Ⅱ抗)行染色,测定不同时点 ephrin-A3和GFAP的表达,操作步骤按照试剂盒说明书进行。含5%牛血清白蛋白(bovine serun albumin,BSA)的TBS Tx(g/L,Tris碱 2.42,NaCl 8,Triton X -1001,pH 7.6),封闭60 min;各组分别加ephrin-A3抗体和GFAP抗体浓度为1∶100,4℃过夜;CY3标记的抗兔IgG浓度为1∶200,作用60 min;抗荧光淬灭封片液封片后荧光显微镜下观察,阳性细胞呈红色荧光。应用Image-Pro Plus 6.0专业图像分析软件分析各实验组的荧光图片单个细胞的累积A值及平均累积A值,进行统计学分析。
2.7 ELISA法测定炎症因子 各组AS培养至不同时点后应用ELISA法检测TNF-α和IL-6的含量,每组样本6个。分别用TNF-α酶联免疫吸附试剂盒和IL-6酶联免疫吸附试剂盒测定,操作按说明书进行,用Bioelisa Reader ELx800测定A值,测定波长为450 nm,经标准品拟合曲线计算出具体含量,结果以pg/L表示。
3 统计学处理
用SPSS 13.0统计软件进行分析。数据以均数±标准差()表示,经方差齐性检验后,多组均数比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。检验水准为α=0.05,以P<0.05为差异有统计学意义。
结 果
1 AS形态观察及鉴定
倒置相差显微镜下观察,提取的细胞在种植1 h后开始贴壁,6 h后大部分细胞可贴壁,呈椭圆形、梭形及不规则形,24 h后所有细胞均贴壁,光晕明显,并可见少数细胞伸出1-2个细微的突起,3 d后细胞数量开始增加,胞体明显增大,突起数量增多,长度增加,并可见部分突起出现分支。传至第3代时用抗GFAP抗体进行纯度鉴定,结果显示AS纯度可达97%以上,见图1A,并检测AS上是否有ephrin-A3的表达,见图1B。
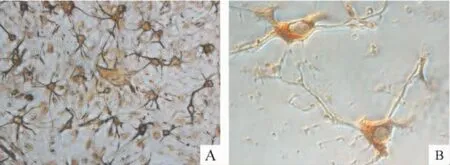
Figure1.Immunochemical staining of astrocytes.A:GFAP -positive astrocytes(×200);B:ephrin-A3-positive astrocytes(×400).图1 AS免疫组化染色
2 MTT法测定AS活性
LPS(10 mg/L)作用 AS 6 h、24 h、48 h 和72 h 的细胞活性均提高,与对照组相比均有显著差异(P<0.05),而30 min组细胞活性与对照组相比无显著差异(P>0.05)。30 min组、48 h组和72 h组的细胞活性与24 h组相比均有显著差异(P<0.05),见表1。
表1 10 mg/L LPS作用不同时点的AS吸光度值及凋亡率比较Table1.The A570value and apoptotic rate(%)of the astrocytes in 10mg/L LPS for different times()
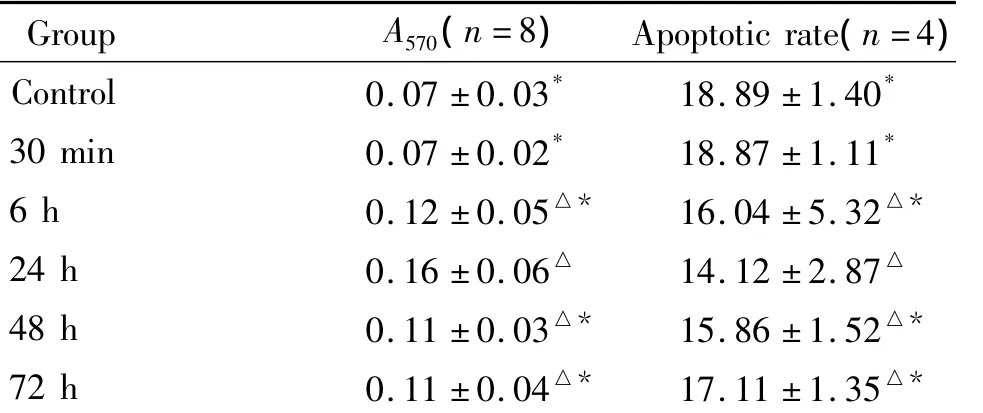
表1 10 mg/L LPS作用不同时点的AS吸光度值及凋亡率比较Table1.The A570value and apoptotic rate(%)of the astrocytes in 10mg/L LPS for different times()
△P<0.05 vs control group;*P<0.05 vs 24 h group.
Group A570(n=8) Apoptotic rate(n=4)Control 0.07 ±0.03* 18.89 ±1.40*30 min 0.07 ±0.02* 18.87 ±1.11*6 h 0.12 ±0.05△* 16.04 ±5.32△*24 h 0.16 ±0.06△ 14.12 ±2.87△48 h 0.11 ±0.03△* 15.86 ±1.52△*72 h 0.11 ±0.04△* 17.11 ±1.35△*
3 AO/EB检测AS凋亡率
LPS(10 mg/L)作用AS 6 h、24 h、48 h 和72 h 的细胞凋亡率均下降,与对照组相比均有显著差异(P<0.05),而30 min组细胞凋亡率与对照组相比无显著差异(P>0.05)。30 min组、48 h组和72 h组的细胞凋亡率与24 h组相比均有显著差异(P<0.05),见表1、图2。
4 ephrin-A3和GFAP表达的免疫荧光测定结果
荧光显微镜下观察发现,各组AS的胞体和突起均呈红色荧光,细胞核不显色,为一暗区。LPS作用24 h、48 h和72 h的胞体和突起的 ephrin-A3和GFAP的荧光强度显著增强,并有逐渐增强趋势,与对照组相比差异显著(P<0.05),而30 min组和6 h组与对照组相比变化不大(P>0.05),各组与24 h组相比,差异显著(P <0.05),见表2、图3、4。
5 IL-6及TNF-α含量测定
LPS作用6 h内,IL-6和TNF-α含量维持在低水平,稍有增加(P>0.05),24 h时增加明显。与对照组相比,脂多糖作用24 h、48 h和72 h时IL-6和TNF-α含量显著升高(P<0.05),与24 h相比差异显著(P<0.05),见表3。
表2 各组AS不同时点ephrin-A3和GFAP的CY3荧光染色IATable2.The IA of ephrin-A3 in astrocytes of different time point(.n=5)
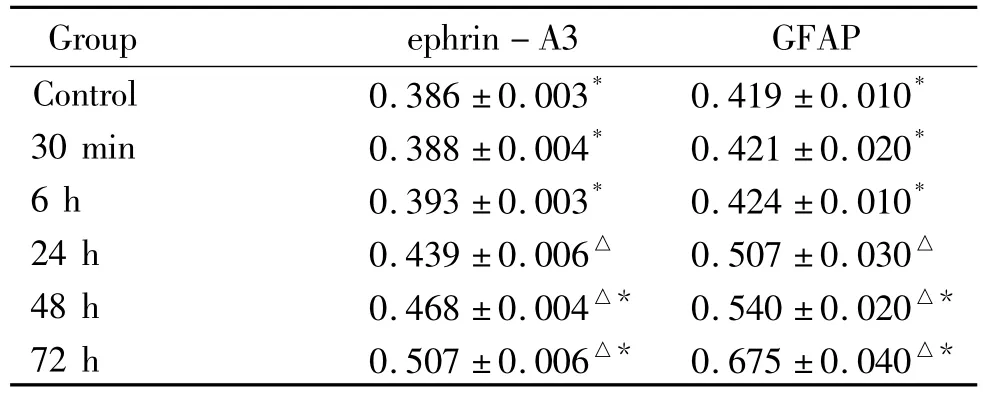
表2 各组AS不同时点ephrin-A3和GFAP的CY3荧光染色IATable2.The IA of ephrin-A3 in astrocytes of different time point(.n=5)
△P<0.05 vs control group;*P<0.05 vs 24 h group.
Group ephrin-A3 GFAP Control 0.386 ±0.003* 0.419 ±0.010*30 min 0.388 ±0.004* 0.421 ±0.020*6 h 0.393 ±0.003* 0.424 ±0.010*24 h 0.439 ±0.006△ 0.507 ±0.030△48 h 0.468 ±0.004△* 0.540 ±0.020△*72 h 0.507 ±0.006△* 0.675 ±0.040△*
表3 各组培养液中IL-6和TNF-α含量比较Table3.Changes of IL-6 and TNF-α in culture medium of every group(.n=6)

表3 各组培养液中IL-6和TNF-α含量比较Table3.Changes of IL-6 and TNF-α in culture medium of every group(.n=6)
△P<0.05 vs control group;*P<0.05 vs 24 h group.
Group IL-6(pg/L) TNF-α(pg/L)Control 249.1 ±20.1* 70.3 ±9.1*30 min 251.2 ±19.7* 70.8 ±6.9*6 h 278.9 ±28.5* 71.5 ±8.3*24 h 2057.8 ±47.6△ 79.1 ±7.6△48 h 2374.6 ±38.5△* 98.5 ±7.4△*72 h 2486.3 ±35.7△* 101.7 ±6.5△*
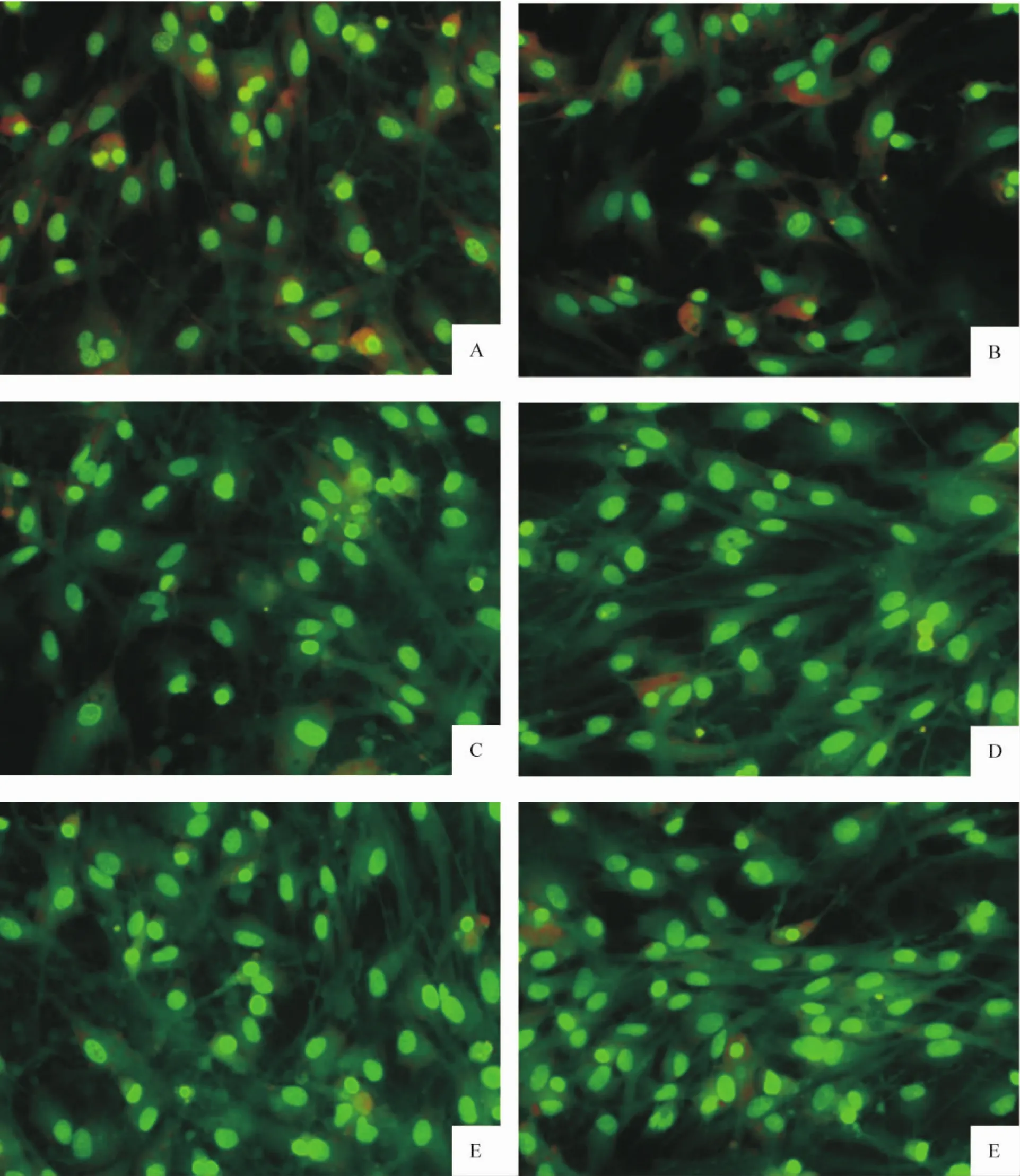
Figure2.AO/EB fluorescein staining of AS in every group(×200).A:control group;B:30min group;C:6h group;D:24 h group;E:48 h group;F:72 h group.图2 各组AS不同时点AO/EB荧光染色
讨 论
中枢神经系统损伤后无法恢复原有功能的主要原因是轴突再生障碍,是由多因素共同作用的结果,包括缺乏轴突生长和导向的生长促进因子、细胞微环境的抑制性改变以及轴突导向分子的参与等。
以往研究表明EphA4广泛分布于大脑神经元上,特别是海马锥体神经元的树突棘上,在应答中枢神经系统损伤的分子机制中表达上调,且起负向调控作用[5]。而ephrin-A3是EphA4的关键配体,定位于AS环绕树突棘部分的ephrin-A3对维持和活化树突棘的正常形态起着重要作用,其与树突棘结合后激活EphA4,而EphA4的活化可以缩短树突棘的长度和降低树突棘的密度,从而起到负向调控作用[6]。所以本实验选择ephrin-A3作为一个切入点研究。
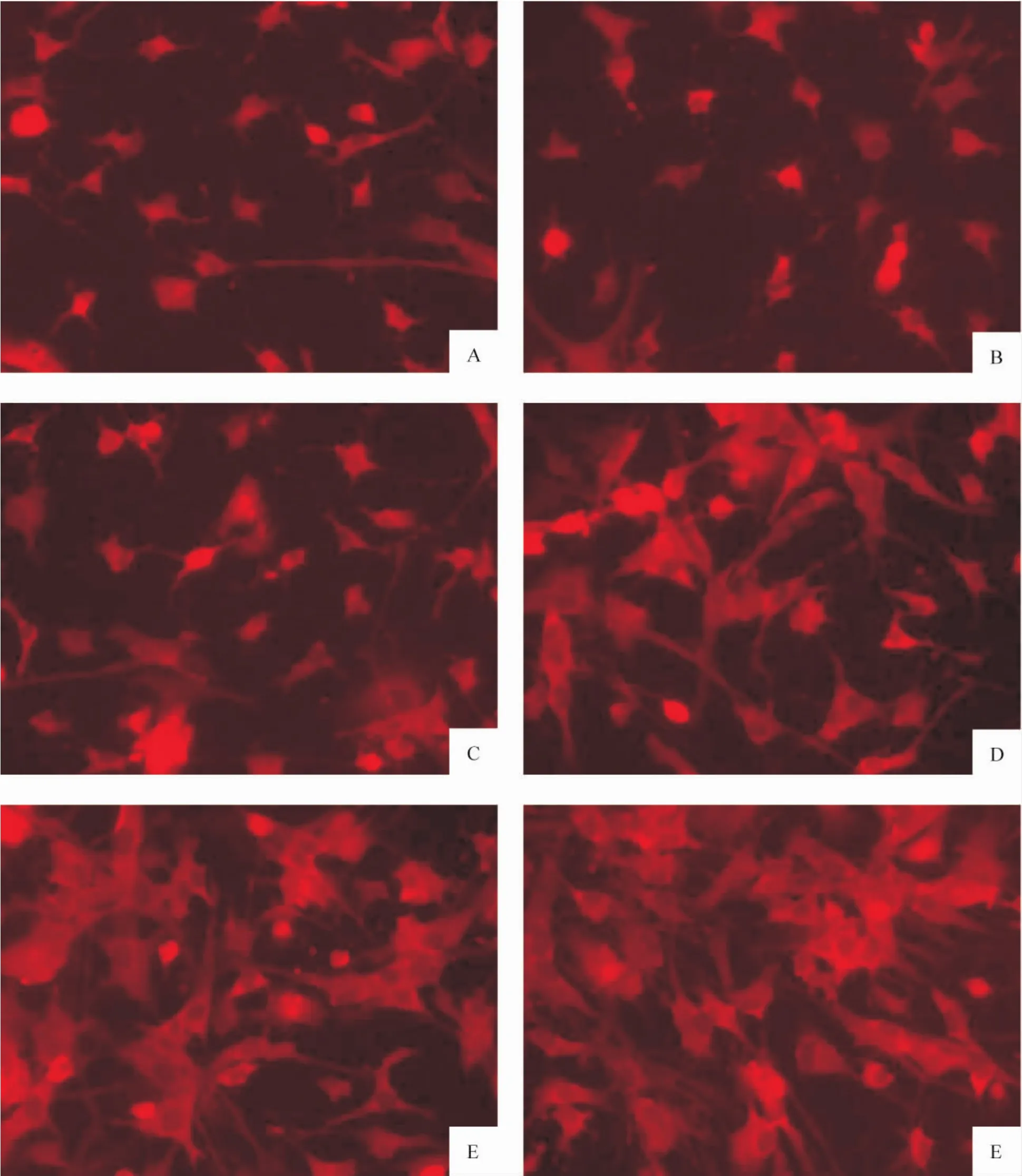
Figure3.Fluorescein staining of ephrin-A3 with CY3 in AS of every group(×200).A:control group;B:30 min group;C:6 h group;D:24 h group;E:48 h group;F:72 h group.图3 各组AS不同时点ephrin-A3 CY3荧光染色
中枢神经系统损伤或发生神经退行性疾病后,炎症反应非常明显,AS被激活,产生一系列炎症因子、趋化因子和营养因子等,在神经元的发育和存活、轴突的再生、神经干细胞的分化等过程中发挥重要作用。LPS是最常用最经典的致炎剂,多被用来制作神经细胞的炎症损伤模型[7]。本实验通过LPS诱导AS建立炎症模型,检测培养液中炎症因子变化,发现AS培养液内IL-6和TNF-α显著增加、AS凋亡减少、存活增加及特异性蛋白GFAP表达增加,说明LPS在一定时间内可以促进AS分泌炎症因子,促进AS活化增殖。实验表明LPS可以激活炎症通路促进 AS分泌 IL-6、IL-8、TNF-α、一氧化氮(nitric oxide,NO)、炎症因子 10(inflammatory factor 10,IP10)、活性氧簇(reactiveoxygenspecies,ROS)等炎症因子[7],并促进AS活化增殖[8]。这些研究结果与本实验相符,都表明炎症因子在AS增殖中起重要作用。
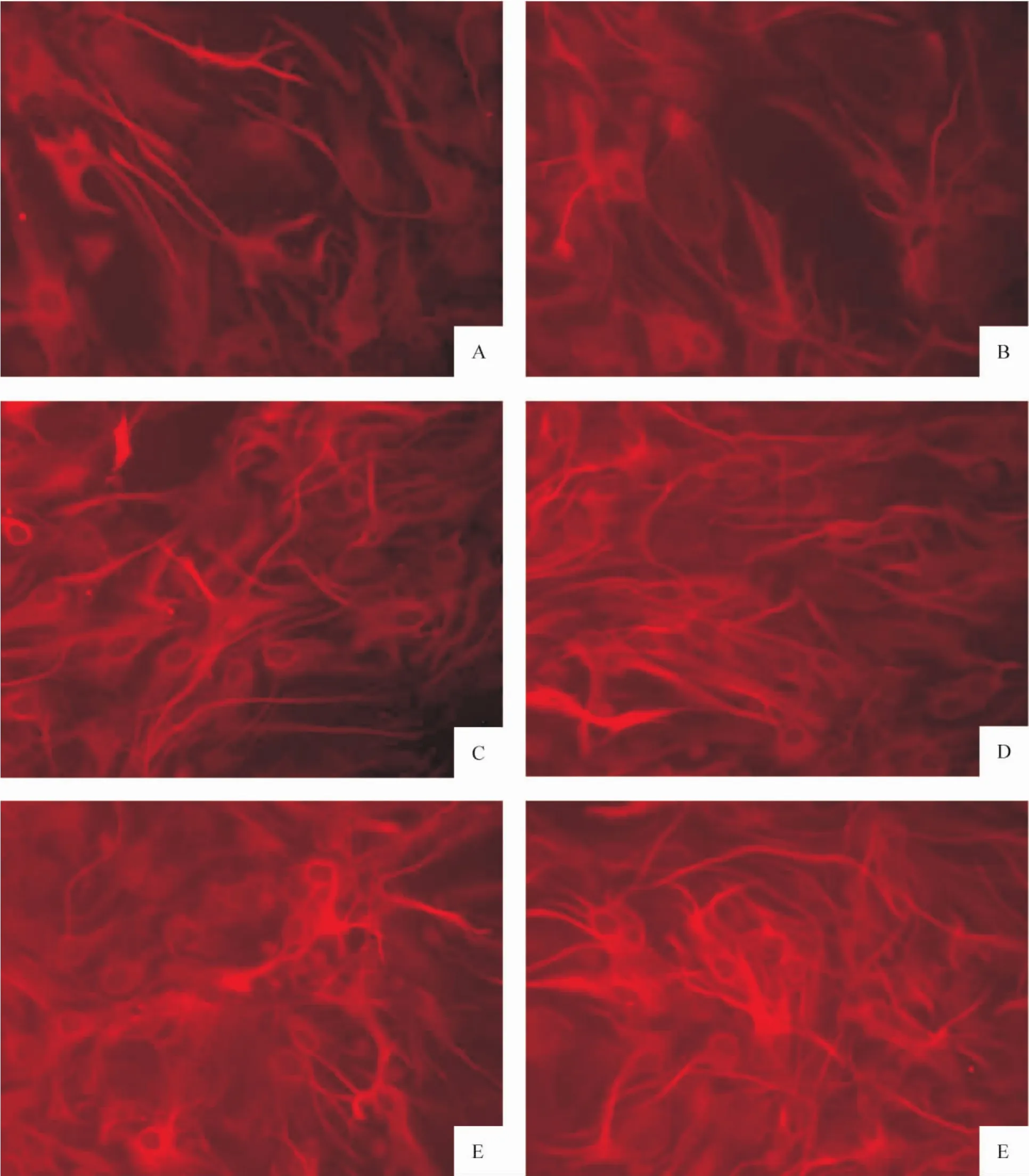
Figure4.Fluorescein staining of GFAP with CY3 in AS of every group(×200).A:control group;B:30 min group;C:6h group;D:24 h group;E:48 h group;F:72 h group.图4 各组AS不同时点GFAP CY3荧光染色
Eph受体酪氨酸家族及其配体ephrins是一种轴突导向分子家族,其在成年中枢神经系统中通常低水平表达,当神经系统损伤如AS、神经元和少突胶质细胞活化时出现上调,表达上调直接抑制轴突再生,另外,Eph表达也可以调控AS增生和胶质疤痕形成[9],还有研究表明Eph可通过调控AS骨架蛋白重组从而调控其反应性[10]。结合本实验测定ephrin-A3,发现其随着GFAP增加有上调趋势,说明其可能与细胞增殖有关,综合上述实验表明Eph家族可能在AS增殖中发挥重要作用。
损伤后炎症反应可能改变Ephs和ephrins表达,研究发现:白细胞抑制因子(LIF)和IFN-γ可上调AS EphA4蛋白表达,体外细胞培养时EphA4基因敲除的AS对炎症因子如LIF或IFN-γ无反应,而海马损伤后,反应性胶质细胞(IFN-γ)受体mRNA表达上调的同时胶质ephrin-B1表达也升高[11],在多发性硬化 (multiple sclerosis,MS)疾病中,当急性炎症脱髓鞘发生时AS Eph/ephrin在损伤活化处表达上调,而在慢性脱髓鞘非活化处炎症因子信号下降或消失,这一现象支持炎症因子与Ephs及ephrins表达上调有关[12]。本实验ephrin-A3表达上调的同时,AS培养液内的IL-6和TNF-α增加,说明两者之间存在一定关系,但其中谁是起始因素不能确定。
细胞因子信号也是调控胶质增殖的关键因素,它可引起AS EphA4表达增加,而后Rho激酶通路激活,而LIF不能引起EphA4基因敲除AS反应性增殖则表明LIF介导的胶质活化可能需通过EphA4受体信号途径起作用。实验表明Rho激酶信号可促进AS增殖[13],Eph-Rho通路可能是星形胶质细胞增殖的起始物。本实验初步观察到ephrin-A3表达变化与AS增殖及炎症因子之间存在联系,但炎症反应、Eph/ephrin家族表达变化和AS反应性是否有直接关系尚不完全清楚,需要进一步深入研究。
体外实验表明ephrins在各种细胞轴突再生中起抑制作用,如ephrin-A5-Fc可抑制EphA4受体阳性的大鼠胚胎腹侧脊髓神经元轴突发生,ephrin-A5作用于视网膜神经节细胞和ephrin-B3作用于皮层神经元均可抑制轴突发生[14]。半定量法测定ephrins mRNA在传入神经阻滞的海马中的表达,发现多种ephrins mRNA表达上调包括ephrin-A3,有研究显示在MS中的反应性AS中ephrin-A3上调[12]。这些说明ephrin-A3可能参与成年脑中枢神经损伤后的再生及可塑性调节,且在其中可能起负向调控作用。所以,Eph/ephrin信号可能不止通过一种机制抑制轴突再生,它在成年中枢神经系统损伤后的结果中起关键作用。
综上可知,无论是ephrin-A3表达上调、AS增殖还是炎症反应,其最终的结果都可能在中枢神经系统损伤修复中起负向作用,另外,研究已经证实,ephrinB/EphB信号系统可以调节树突棘形态发生和可塑性,在含有失活EphB2体外培养的海马神经元中,树突棘无法成熟,其逆向传导对树突棘形成也很重要[15]。可见ephrin/Eph在中枢神经系统中占据了重要地位。通过对ephrin/Eph的调控,可能对脑卒中等中枢神经系统的治疗和康复产生重要影响。
[1]Pasquale EB.Eph-ephrin bidirectional signaling in phys-iology and diease[J].Cell,2008,133(1):38 -52.
[2]Seth P,Koul N.Astrocyte,the star avatar:redefined[J].J Biosci,2008,33(3):405 -421.
[3]Fellin T.Communication between neurons and astrocyte:relevance to the modulation of synaptic and network activity[J].J Neurochem,2009,108(3):533 -544.
[4]McCarthy KD,Vellis JD.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue[J].J Cell Biol,1980,85(3):890 -902.
[5]赵燕玲,张博爱,贾延劼,等.EphA4在海人酸诱导大鼠大脑皮层神经元凋亡中的表达及天麻素的影响[J].中国病理生理杂志,2009,25(10):1917-1921.
[6]Carmona MA,Murai KK,Wang L,et al.Glial ephrin - A3 regulates hippocampal dendritic spine morphology and glutamate transport[J].Proc Natl Acad Sci,2009,106(30):12524-12529.
[6]Yeh SH,Hung JJ,Gean PW,et al.Hypoxia-inducible factor-1α protects cultured cortical neurons from lipopolysaccharide-induced cell death via regulation of NR1 expression[J].Neurosci,2008,28(52):14259 -14270.
[8]熊家巷,白 云,宋 敏,等.炎性介质脂多糖、γ干扰素活化星形胶质细胞效应[J].第三军医大学学学报,2008,30(22):2065-2068.
[9]Goldshmit Y,McLenachan S,Turnley A.Roles of Eph receptors and ephrins in the normal and damaged adult CNS[J].Brain Res Rev,2006,52(2):327 -345.
[10]Puschmann TB,Turnley AM.Eph receptor tyrosine kinases regulate astrocyte cytoskeletal rearrangement and focal adhesion formation[J].J Neurochem,2010,113(4):881-894.
[11]Wang Y,Zhou CF.Involvement of interferon-γ and its receptor in the activation of astrocytes in the mouse hippocampus following entorhinal deafferentation[J].Glia,2005,50(1):56-65.
[12]Sobel RA.Ephrin A receptors and ligands in lesions and normal- appearing white matter in multiple sclerosis[J].Brain Pathol,2005,15(1):35 -45.
[13]Nicole O,Goldshmidt A,Hamill CE,et al.Activation of protease-activated receptor-1 triggers astrogliosis after brain injury[J].J Neurosci,2005,25(17):4319 -4329.
[14]Kullander K,Croll SD,Zimmer M,et al.Ephrin-B3 is the midline barrier that prevents corticospinal tract axons from recrossing,allowing for unilateral motor control[J].Genes Dev,2001,15(7):877-888.
[15]Segura I,Essmann CL,Weinges S,et al.AGrb4 and GIT1 transduce ephrinB reverse signals modulating spine morphogenesis and synapse formation[J].Nat Neurosci,2007,10(3):301-310.
