赖型钩端螺旋体溶血素HlyX对血管内皮细胞通透性的影响*
2011-08-02吴秉婷李道坤
孙 湛,吴秉婷,李道坤,鲍 朗
(四川大学华西医学中心感染免疫研究室,四川 成都 610041)
钩端螺旋体(Leptospira,简称钩体)在世界范围内广泛分布,可引起人兽共患自然疫源性疾病-钩端螺旋体病(leptospirosis,简称钩体病)[1]。钩体病患者临床症状明显,严重者可出现肾功能障碍,黄疸,皮肤、脏器广泛性出血,尤其是急性肺弥漫性大出血而致口鼻涌血死亡[2]。钩体病导致急性肺弥散性大出血的机制仍未被阐明,因此对钩体的致病机制研究仍具有十分重要的现实意义。赖型钩端螺旋体全基因组测序结果预测了9个和钩端螺旋体毒力相关的溶血素基因[3]。大多数溶血素在问号状赖型钩体中表达并且被分泌入环境中。其中HlyX(LA0378)是非鞘磷脂酶类溶血素,研究已发现该溶血素能在体外引起绵羊红细胞溶血[4],且促进ECV304细胞乳酸脱氢酶以及一氧化氮的释放[5],但其确切的对血管内皮细胞通透性以及对细胞凋亡率的影响尚无报道。本研究从赖型钩端螺旋体56601株中克隆、表达hlyX基因,并将目的蛋白作用于HUVECs细胞株,检测其对单层血管内皮细胞通透性的影响及其对细胞凋亡率的影响,探讨该蛋白在钩端螺旋体引起肺弥散性出血致病过程中可能起到的作用及可能机制。
材料和方法
1 材料
1.1 菌株、质粒和细胞 钩端螺旋体赖型56601株由本研究室保存并定时感染豚鼠传代以保持毒力。原核表达质粒pET32a(+)本室常规保种,感受态细胞E.coli BL21(DE3)pLysS购自 Tiangen。HUVECs细胞株,由四川大学华西医院移植免疫实验室提供。
1.2 主要试剂 PCR试剂盒、DNA连接试剂盒(TaKaRa);胶回收纯化试剂盒以及质粒提取试剂盒(Omega);限制性内切酶 Kpn I、EcoRⅠ、DNA markerⅣ、protein Marker(Fermentas);BCA protein assay reagent kit(Pierce);抗His蛋白的单克隆抗体(Ⅰ抗)以及羊抗鼠IgG-HRP(Ⅱ抗)(北京天根公司);DAB显色液(北京中衫公司);蛋白纯化柱HisTrap纯化柱(GE);Millicell hanging cell culture(pore size 0.4 μm,diameter 6.5 mm)(Millipore);HRP-albumin(博士德公司);其余常规试剂均为国产或进口分析纯产品。
2 方法
2.1 赖型钩体56601株基因组提取与纯化 应用基因组提取试剂盒提取基因组。
2.2 hlyX基因PCR扩增 根据GenBank中hlyX基因序列设计。上游和下游引物分别引入EcoR I和XhoI酶切位点。P1:5'-CGGAATTCTTGGTCGAAGCGCTGTCTGT-3';P2:5'-GGCCTCGAGATCCAATTTTTCGGTTTCTAG-3'(划线部分分别是 EcoR I和 Xho I酶切位点,Invitrogen合成)。以赖型钩体56601株全基因组DNA为模板,P1、P2为引物按以下反应体系进行PCR扩增:5×PrimerSTARTMbuffer(Mg2+plus)10 μL,dNTP mixture(各 2.5 mmol/L)4 μL,P1、P2 各 1.0 μL,基因组DNA1 μL,PrimerSTARTMHS 0.5 μL,H2O 32.5 μL。反应参数:98 ℃ 10 s,55 ℃ 5 s,72 ℃ 1 min,30个循环。反应结束后取5 μL扩增产物用0.7%琼脂糖凝胶电泳检测结果。
2.3 重组质粒pET-hlyX的构建和鉴定 hlyX与质粒pET32a(+)分别用限制性内切酶EcoR I和Xho I酶切,纯化。hlyX与pET32a(+)以摩尔比3∶1混和,用DNA连接试剂进行连接反应,转化BL21(DE3)pLysS感受态细胞,铺板过夜培养,随机挑取转化菌落于LB培养基振荡培养,提取质粒DNA,作双酶切和PCR鉴定,以上鉴定正确的阳性克隆送上海英骏生物技术有限公司测序。
2.4 重组质粒pET-hlyX在大肠杆菌中的诱导表达 将含重组质粒 pET-hlyX、空白对照质粒pET32a(+)以及不含质粒大肠杆菌BL21(DH3)分别接种于LB培养基过夜振荡培养,第2 d取菌液按1∶100接种于新鲜LB培养基(氯苄西林100 mg/L)培养3 h,加入IPTG至终浓度0.5 mmol/L,5 h后收集菌液经反复冻融、离心处理,分别取上清和沉淀作SDS-PAGE分析。
2.5 HlyX融合蛋白和Trx蛋白的大量表达及纯化、复性和免疫印迹分析 挑取单克隆菌落于5 mL LB培养基中37℃振荡培养过夜(氯苄西林100 mg/L),第2 d按1∶50加入到300 mL LB培养基中(氯苄西林100 mg/L),37℃振荡培养3 h,加入终浓度为0.5 mmol/L IPTG,继续诱导培养5 h,离心集菌,超声破碎。弃上清,用洗涤液A(50 mmol/L Tris-HCl、10 mmol/L EDTA、100 mmol/L NaCl、0.5%Triton X-100)洗涤沉淀,重悬沉淀,室温静置30 min,洗涤液B(50 mmol/L Tris-HCl、10 mmol/L EDTA、100 mmol/L NaCl、2 mmol/L尿素)洗涤沉淀,重悬沉淀,室温静置30 min,4℃12000 r/min离心10 min,弃上清。以8 mol/L尿素重悬包涵体,室温静置30 min,4℃过夜。4℃12000 r/min离心10 min,收集上清。按照HisTrap纯化柱所提供的方法纯化融合包涵体蛋白。将纯化的Trx-HlyX蛋白进行尿素梯度透析复性,取上清进行SDS-PAGE检查纯化效果。将Trx-HlyX蛋白溶液作Western blotting,Ⅰ抗为鼠抗His-tag抗体,Ⅱ抗为HRP标记羊抗鼠IgG。测定蛋白浓度,将纯化后的目的蛋白用Millipore的超滤管4℃反复离心去除咪唑,用去内毒素胶预装柱处理,即先用1%脱氧胆酸钠再生去内毒素胶,再用无致热源的三蒸水平衡预装柱,最后将蛋白缓慢上柱,收集流出液即为去除内毒素的蛋白。-70℃贮存备用。
2.6 内皮单细胞层通透性的测定 HUVECs以2×105cells/cm2接种在铺有1%明胶的顶层小室微孔膜上(孔径大小0.4 μm,直径6.5 mm),待细胞长至融合后,改用无酚红无血清DMEM继续培养8 h,使细胞获得同步生长并处于静止期。在阴性对照组各孔中加入Trx标签蛋白液50 μL,在蛋白作用组各孔中加入Trx-HlyX融合蛋白液50 μL至终浓度分别为5、10、20、40 mg/L,每个浓度重复5孔。继续培养细胞。24 h后加100 μL(1 g/L)HRP-白蛋白到双层小室的顶室,37℃、5%CO2孵育1 h,随后从每个双层小室的顶室和底室分别取样品100 μL,置于黑色96孔板中,并向每孔中都加入100 μL TMB后加入2 mol/L H2SO4终止反应。酶标仪在450 nm波长测定吸光度(A)值。
2.7 细胞凋亡检测
①Annexin V-FITC/PI双染法流式细胞术检测细胞凋亡 取HUVECs单细胞悬液,往96孔板各孔中加入100 μL细胞液,培养24 h后将实验分阴性对照组和蛋白作用组:在阴性对照组各孔中加入Trx标签蛋白液50μL,在蛋白作用组各孔中加入Trx-HlyX融合蛋白液 50 μL 至终浓度分别为 5、10、20、40 mg/L,每个浓度重复5孔。继续培养细胞,24 h后收集细胞按如下方法处理:用不含EDTA的胰蛋白酶消化收集各孔细胞;冰PBS洗涤2次(2000 r/min离心5 min)收集(1-5)×105细胞;加 500 μL binding buffer悬浮细胞和5 μL Annexin V-FITC混匀后,再加入5 μL propidium iodide混匀,室温、避光、反应5-15 min;经流式细胞仪检测细胞凋亡率。
②Hoechst 33258荧光染色观察细胞凋亡 按上述方法处理细胞,除去培养基,用PBS洗2遍,用免疫染色固定液固定(4℃,过夜),弃除固定液,PBS洗3遍,每次5 min,加入0.4 mL Hoechst 33258染色液,染色 10 min后,弃除染色液,PBS洗 3遍,每次5 min,滴加抗荧光淬灭封片液。荧光显微镜下(激发波长为350 nm,发射波长为460 nm)检测各组呈蓝色细胞核的细胞。
3 统计学处理
结 果
1 赖型钩体56601株hlyX基因PCR扩增
以赖型钩体56601株全基因组为模板,通过PCR扩增出约1200 bp左右的特异性片段,与预期的大小一致,见图1。
2 重组质粒的构建与鉴定
提取重组质粒双酶切结果显示该重组质粒含有约1200 bp片段,PCR结果显示该重组质粒能扩增出目的片段,而空质pET32a(+)未能扩增出。测序结果和GenBank数据库中hlyX 100%匹配,表明重组质粒构建成功,见图2。
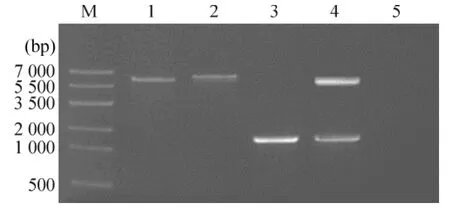
Figure2.Analysis of recombinant plasmid pET-hlyX.M:DNA markerⅣ;Lane 1:plasmid pET32a(+);Lane 2:recombinant plasmid pET-hlyX;Lane 3:PCR products amplified from recombinant plasmid with primer P1 and P2;Lane 4:pET-hlyX digested with Xho I and EcoR I restriction enzyme;Lane 5:PCR products amplified from plasmid pET32a(+).图2 重组质粒pET-hlyX的鉴定
3 重组质粒的诱导表达和免疫印迹分析
SDS-PAGE结果显示,含重组质粒pET-hlyX菌体总蛋白在约65 kD处出现明显条带,且以包涵体的形式存在,空质粒菌体蛋白在20 kD处出现条带。Trx-HlyX融合蛋白和Trx蛋白经HisTrap亲和层析柱纯化后得到较高纯度的蛋白,见图3。
4 Trx-HlyX融合蛋白对HUVECs通透性的影响
结果显示,随着Trx-HlyX融合蛋白浓度增加,HUVECs单层细胞的通透性依次增加,5 mg/L、10 mg/L组与对照组没有明显差异,但当Trx-HlyX蛋白作用浓度超过20 mg/L,与对照组相比,差异显著(P <0.05),见图4。
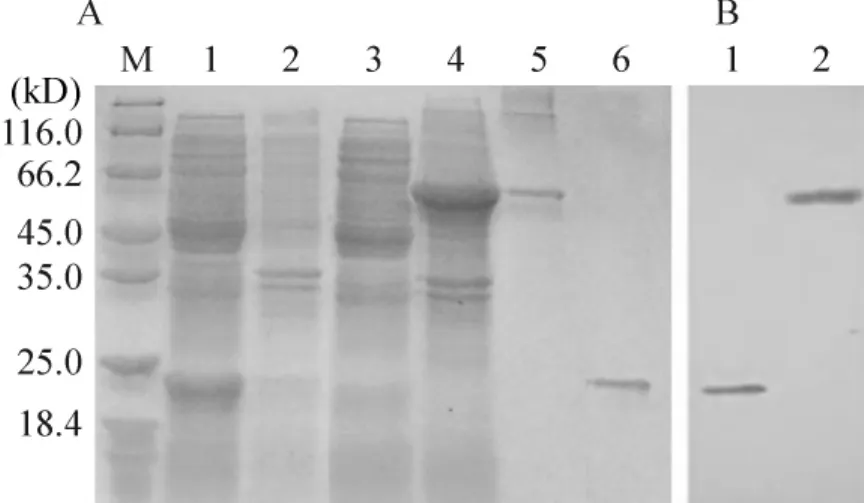
Figure3.Detection of Leptospira HlyX and Trx fusion partner expressed in E.coli.A:SDS-PAGE was performed in SDS-12%polyacrylamide gel and stained with Coomassie brilliant blue;B:immunoblot analysis was performed with the mouse anti-his tag monoclonal antibody.E.coli harboring pET-HlyX was induced by IPTG(1 mmol/L)for 5 h at 37℃,and sonic lysates were separated into soluble and insoluble fractions by centrifugation.A:M:molecular mass marker;Lane 1:soluble fraction from E.coli lysate harboring pET32a(+)induced by IPTG;Lane 2:insoluble fraction from E.coli lysate harboring pET32a(+)induced by IPTG;Lane 3:soluble fraction from E.coli lysate harboring pET-HlyX induced by IPTG;Lane 4:insoluble fraction from E.coli lysate harboring pET-HlyX induced by IPTG;Lane 5:purified 52 kD Trx-HlyX fusion protein;Lane 6:purified 20.4 kD Trx fusion partner.B:Lane 1:20.4 kD Trx fusion partner protein;Lane 2:62 kD pET-HlyX fusion protein.图3 重组质粒pET-HlyX以及标签蛋白Trx在大肠杆菌中表达
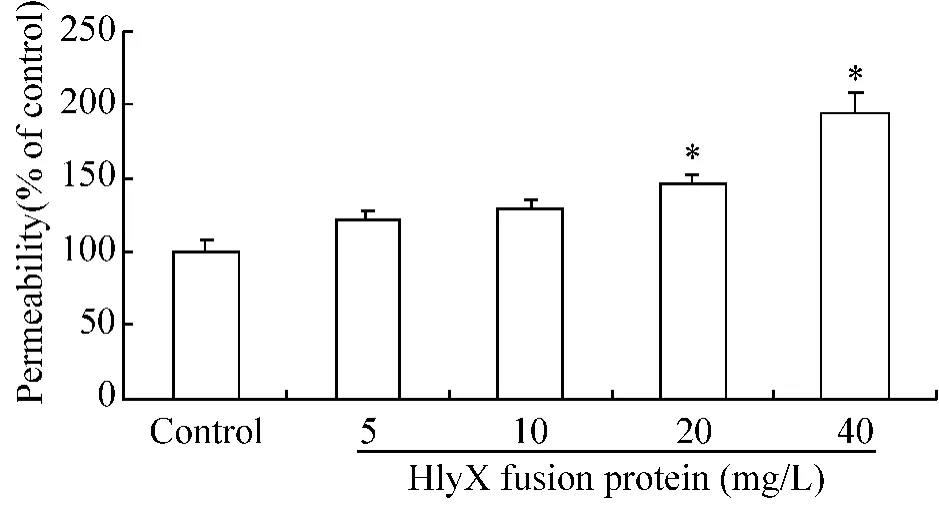
Figure4.HlyX fusion protein increased permeability in a HUVECs barrier model.The confluent monolayer HUVECs in the top chamber of the barrier model were pre-treated with Trx fusion partner or HlyX(5,10,20 or 40 mg/L)for 24 h.The values were normalized against those for untreated(control)cells..n=5.*P<0.05 vs control group.图4 HlyX融合蛋白对HUVECs单层细胞通透性的影响
5 Trx-HlyX融合蛋白对HUVECs细胞凋亡率的影响
应用流式细胞术检测,经Trx-HlyX融合蛋白作用24 h的HUVECs细胞,细胞凋亡率随着蛋白浓度的增加而增加,呈剂量依赖关系。当蛋白浓度达到20 mg/L,与对照组相比差异显著(P<0.05),说明该蛋白有一定的细胞毒性作用,见图5。Hoechst 33258荧光染色结果(图6)显示:A组(阴性对照组):细胞核较大,出现均匀的低强度荧光,凋亡细胞数目极少;B组、C组(Trx-HlyX 5 mg/L、10 mg/L):有数目极少的强度很高的蓝色亮点,与A组比较无明显差别;D组(Trx-HlyX 20 mg/L):有较多的高强度的蓝色亮点,有部分细胞发生凋亡;E组:有大量强度高的蓝色亮点,较多细胞发生凋亡。
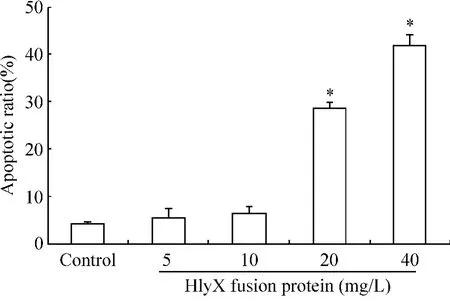
Figure5.The of apoptotic rate of HUVECs assayed by Annexin-V/PI double-staining flow cytometry.The percentages of apoptotic cells in the presence of HlyX fusion protein increased in a concentration-dependent manner..n=5.*P<0.05 vs control group.图5 Annexin V-FITC/PI双染法流式细胞术检测凋亡HUVECs的比例
讨 论
由致病性钩端螺旋体所引起的钩体病是世界范围内流行的人兽共患自然疫源性疾病。钩体病的主要症状包括发热、肌肉酸痛和乏力,严重者表现为黄疸、溶血性贫血以及肝肾肺功能障碍,部分患者会因弥漫性肺出血而死亡。钩体病导致急性肺弥散性大出血的机制仍未被阐明。许多阐述仅仅只是推测,皆有待于实验的验证。关于钩体引起肺出血机制的认识,有学者提出毒力蛋白机制[6]。其认为钩体通过毒力蛋白作用引起血管损伤,尤其是小血管炎性损伤,进而引起出血[7]。虽然特异性毒力蛋白并未阐明,但是可能的毒力蛋白包括有外膜蛋白、膜糖脂蛋白、溶血素以及脂多糖[8]。
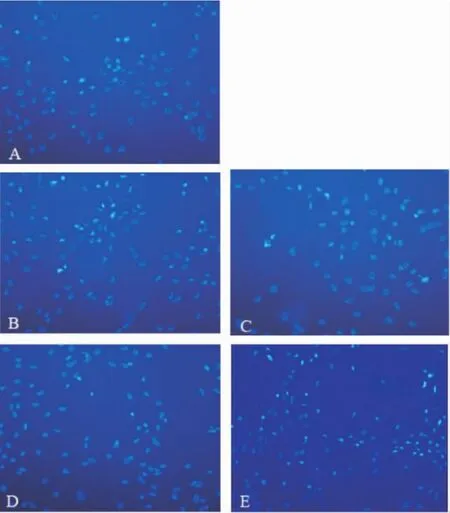
Figure6.Hoechst 33258 nuclear staining for assessment of apoptosis of HUVECs.A:control;B-E:HUVECs were treated with 5,10,20 or 40 mg/L HlyX fusion protein,respectively,at 37 ℃ for 24 h.图6 Hoechst33258细胞核染色检测人脐静脉内皮细胞的凋亡
溶血素存在于一些钩体培养物的上清液中,能破坏红细胞或其它细胞膜,增加毛细血管的渗透性,使血管壁破裂造成皮下出血,是钩体的一个重要的致病因子。通过分析问号钩体黄疸出血型赖型全基因组CDS,发现大染色体上存在9个可疑的溶血素[9]。HlyX属于非鞘磷脂酶类溶血素,能引起成孔蛋白类溶血,可通过在红细胞或其它细胞膜表面形成稳定的穿膜小孔,使细胞膜的渗透性增高,离子和分子可以自由穿过脂质双分子层,导致细胞外液涌入而使细胞裂解。已有实验证明,在大肠杆菌中表达的HlyX有明显的溶血活性,与LipL32共同作用于绵羊血红细胞,溶血作用明显增强,表现为协同作用,如果同时使用它们的抗体能够阻止溶血作用[4]。
本研究通过克隆表达出溶血素蛋白Trx-HlyX,使其作用于人脐静脉内皮细胞,采用生物素标记白蛋白的酶联免疫吸附法测定人脐静脉内皮细胞单细胞层通透性的变化,并应用流式细胞术检测其对血管内皮细胞凋亡率的影响。本研究发现,在体外用不同剂量的融合蛋白Trx-HlyX作用于人脐静脉内皮细胞,当目的蛋白达到一定剂量时,可引起单层血管内皮细胞的通透性增大,而标签蛋白Trx则没有这样的作用。随着Trx-HlyX蛋白作用于HUVECs剂量上升,细胞凋亡率也有上升趋势。
血管内皮细胞损伤在钩体病早期就会出现。血管损伤主要会表现在毛细血管,但是其导致出血的机制仍未被阐明。通过本实验研究可推测,溶血素蛋白HlyX可能通过引起细胞凋亡数量增加,而导致血管内皮细胞的通透性增加。我们通过实验已证实,溶血素蛋白HlyX作用的血管内皮细胞LDH和NO释放量明显增高,对细胞具有毒性效应[6]。所以推测,血管内皮细胞坏死量增加,可能也是导致血管内皮细胞通透性增加的原因。另外,血管内皮细胞之间的紧密连接被破坏,可能也影响单层细胞的通透性,其具体机制有待进一步深入研究。
[1]Adler B,de la peña Moctezuma A.Leptospira and leptospirosis[J].Vet Microbiol,2010,140(3-4):287-296.
[2]Paganin F,Bourdin A,Borgherini G,et al.Pulmonary manifestations of leptospirosis[J].Rev Mal Respir,2009,26(9):971-979.
[3]Ren SX,Fu G,Jiang XG,et al.Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing[J].Nature,2003,422(6934):888-893.
[4]Hauk P,Negrotto S,Romero E C,et al.Expression and characterization of HlyX hemolysin from Leptospira interrogans serovar copenhageni:potentiation of hemolytic activity by LipL32[J].Biochem Biophys Res Commun,2005,333(4):1341-1347.
[5]黄 毕,鲍 朗,钟 琪,等.赖型钩端螺旋体溶血素HlyX基因的克隆、表达及其细胞毒效应[J].中国病理生理杂志,2008,24(11):2200-2203.
[6]Evangelista KV,Coburn J.Leptospira as an emerging pathogen:a review of its biology,pathogenesis and host immune responses[J].Future Microbiol,2010,5(9):1413-1425.
[7]Luks AM,Lakshminarayanan S,Hirschmann JV.Leptospirosis presenting as diffuse alveolar hemorrhage:case report and literature review[J].Chest,2003,123(2):639-643.
[8]Palaniappan RU,Ramanujam S,Chang YF.Leptospirosis:pathogenesis,immunity,and diagnosis[J].Curr Opin Infect Dis,2007,20(3):284-292.
[9]张怡轩.致病性钩端螺旋体溶血素基因功能的研究进展[J].国外医学:流行病学传染病学分册,2002,29(6):359-362.
