RNAi沉默N-cadherin表达对EC9706细胞裸鼠移植瘤生长的影响*
2011-08-02刘文静侯新芳何素英王居峰
李 克, 刘 莺, 刘文静, 侯新芳, 何素英, 王居峰
(河南省肿瘤医院肿瘤科,河南 郑州 450008)
食管癌是最常见的恶性肿瘤之一,我国特别是河南等省份是食管癌的高发地区[1,2],其死亡率居恶性肿瘤的第4位。由于侵袭、转移是引起食管癌患者死亡的主要原因,因此对食管癌侵袭转移机制的探讨已成为当前研究的热点。
钙黏附蛋白家族(cadherin family)与肿瘤的侵袭和转移密切相关,其中以上皮型钙黏附蛋白(E-cadherin)和神经型钙黏附蛋白(N-cadherin)分布最广泛。国内外已有研究表明,食管鳞状细胞癌的侵袭、转移与E-cadherin的低表达或不表达有关。最近研究表明,在前列腺癌和乳腺癌中N-cadherin表达增多,并且在引起肿瘤侵袭转移方面有着比E-cadherin 减少更为重要的作用[3,4]。N-cadherin 对于肿瘤上皮细胞及表达 N-cadherin的血管平滑肌细胞和内皮细胞之间的黏附起着重要作用。在肿瘤形成过程中,N-cadherin的表达有助于血管形成及上皮细胞-间质细胞的迁移,从而使肿瘤细胞更加富于侵袭性,易于转移[5]。此外,N-cadherin还是一种凋亡抑制因子,可以通过抑制凋亡而促进肿瘤细胞的生长和存活。如前文所述[6],本研究首先通过对食管鳞状细胞癌组织、癌旁不典型增生组织及正常食管黏膜组织中E-cadherin、N-cadherin的蛋白表达及其与临床病理诸因素的关系进行分析,发现人食管鳞状细胞癌组织中E-cadherin的低表达和N-cadherin的高表达与食管鳞状细胞癌的发生、发展及侵袭、转移密切相关;然后又通过逆转录病毒介导的RNA干扰(RNA interference,RNAi)技术,降低人食管鳞状细胞癌细胞系EC9706细胞中N-cadherin mRNA和蛋白的表达水平,结果发现:RNAi沉默N-cadherin表达可以使EC9706细胞的体外侵袭力显著降低,从而提示N-cadherin与食管鳞状细胞癌细胞的侵袭、转移密切相关,食管鳞状细胞癌的侵袭、转移可能是N-cadherin和MMP-9共同作用的结果。因此,本研究通过荷瘤裸鼠实验,将RNA干扰前后的EC9706细胞通过皮下注射的方式接种于裸鼠体内,观察各组裸鼠成瘤期、成瘤大小、瘤体重量及细胞凋亡的情况,检测各组裸鼠移植瘤组织中E-cadherin、N-cadherin和 MMP-9的表达,从而为N-cadherin治疗食管鳞状细胞癌的可行性研究提供理论基础。
材料和方法
1 材料
4-6周 BALB/c-nude裸鼠15只,雌性,平均体重16-18 g,购自上海斯莱克实验动物有限责任公司。pEGFP-MSCVneo质粒和 pMSCVneo/N-cadherin质粒由协和医科大学马杰博士馈赠。pMSCVneo/N-cadherin质粒大小为7.5 kb,内含EGFP基因序列、U6启动子序列和多克隆位点等。人食管癌细胞株EC9706由中科院提供;包装细胞株PT67购自Clontech;E-cadherin、N-cadherin和 MMP-9Ⅰ抗(鼠抗人单克隆抗体)购自Abcam;脂质体Lipofectamine 2000TM购自Invitrogen;TUNEL细胞凋亡原位检测试剂盒购自南京凯基生物科技发展有限公司。
2 方法
2.1 逆转录病毒介导的RNAi沉默N-cadherin基因在EC9706细胞中的表达
①脂质体法转染病毒包装细胞PT67及抗性克隆的筛选与扩增 将病毒包装细胞PT67接种至6孔培养板中,待其融合达90%-95%时,用脂质体法对其进行转染(具体方法见 LipofectamineTM2000说明书)。转染共分4组:正常对照组﹑脂质体组和pEGFP-MSCVneo质粒组﹑pMSCVneo/N-cadherin质粒组。
选用G418进行抗性克隆的筛选和扩增,初选浓度为1000 mg/L(由预实验得出),10-15 d后降为300 mg/L,继续维持10-15 d。转染后的细胞每隔3-4 d在倒置荧光显微镜下488 nm波长处观察细胞中绿色荧光蛋白的表达情况。
②病毒滴度的测定 从pEGFP-MSCVneo质粒组、pMSCVneo/N-cadherin质粒组经G418筛选形成的PT67抗性克隆中,分别挑取2个边界清楚的克隆进行扩增,收集病毒上清用以感染NIH3T3细胞,并用G418(600 mg/L)加压筛选,用未感染的NIH3T3细胞作对照。2周后计算每瓶内的克隆数,按下式计算病毒滴度。病毒滴度(cfu/L)=克隆数/[病毒原液的体积(L)×复制因子×稀释度]。选取病毒滴度最高的病毒上清进行后续实验。
③EC9706细胞的转染及抗性克隆的筛选与扩增将EC9706细胞接种至6孔培养板中,待其融合达90%-95%时,进行感染,感染共分3组:正常对照组﹑pEGFP-MSCVneo病毒上清组(空载体组)﹑pMSCVneo/N-cadherin病毒上清组(干扰载体组),方法与病毒滴度测定相同,筛选出具有G418抗性的EC9706细胞克隆,并用含G418(300 mg/L)的条件培养基进行维持培养。
2.2 裸鼠异种肿瘤接种实验
①EC9706细胞悬液的制备 大量扩增并收获处于对数生长期的正常对照组、空载体组和干扰载体组EC9706细胞,用不含 Ca2+、Mg2+的 PBS液(0.01 mol/L,pH 8.0)洗涤2次并制备成1×1010cells/L的细胞悬液。
②动物准备及肿瘤细胞接种 将15只裸鼠随机分为3组:正常对照组、空载体组和干扰载体组,每组各5只。将裸鼠常规消毒后,选取各组裸鼠背部肩胛旁区作为注射点,分别皮下注射3组EC9706细胞悬液(1 ×1010cells/L),0.2 mL/只。
③生长曲线的绘制 定期观察裸鼠成瘤情况,每隔7d测量移植瘤的长径(L)和短径(S),根据公式V(cm3)=L×S2×0.5来计算移植瘤的近似体积,并绘制肿瘤生长曲线,计算成瘤率。
④瘤体终重量和终体积的比较 接种5周后,颈椎脱臼处死裸鼠,完整剥离瘤体,测量瘤体终体积,并称取瘤重,以计算肿瘤抑制率,肿瘤抑制率=(对照组瘤重-实验组瘤重)/对照组瘤重×100%;切除部分新鲜标本投入液氮中保存,以备Western blotting实验所用;剩余肿瘤组织用40 g/L多聚甲醛固定,常规石蜡包埋,用于HE染色、免疫组化及细胞凋亡的检测。
2.3 裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9蛋白的表达
①免疫组织化学法检测裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9蛋白的表达 将各组裸鼠移植瘤组织经40 g/L多聚甲醛固定,常规脱水,石蜡包埋,连续切片,切片厚度4-6 μm。染色方法严格参照免疫组化PV-9000试剂盒说明书进行操作,以PBS液代替Ⅰ抗作为阴性对照。胞膜/胞质棕黄色染色为阳性,其中E-cadherin以胞膜着色为主,N-cadherin和MMP-9以胞质染色为主,每张切片随机取5个视野(×400),观察200个细胞,计数阳性细胞。
②Western blotting检测裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9蛋白的表达 研钵常规消毒后,加入液氮,取约50 mg组织块研磨,磨碎后加入适量(约200 μL)蛋白裂解液,继续研磨至粉末,转移至预冷的EP管中,待粉末溶化后,1500×g离心30 min,去上清转移至一新的EP管中,即为组织蛋白。严格参照Western blotting试剂盒说明书进行操作,用β-actin抗体作为上样对照。Western blotting结果的灰度值分析采用Gene Tools软件完成。
2.4 凋亡的原位酶标记检测(TUNEL法) 将石蜡包埋的组织切片预处理后,严格参照TUNEL细胞凋亡原位检测试剂盒说明书进行染色,同时设阴性及阳性对照。以背景无颜色,细胞核内着棕黄色颗粒为阳性。每张切片随机取5个视野(×400),观察200个细胞,计数阳性细胞。
3 统计学处理
应用SPSS 13.0软件进行统计学处理,数据以均数±标准差()表示,多个样本均数比较应用单因素方差分析,以α=0.05为检验水准。
结 果
1 逆转录病毒介导的RNAi沉默N-cadherin基因在EC9706细胞中的表达
1.1 脂质体法转染病毒包装细胞PT67及阳性克隆的筛选与扩增 转染24 h后在荧光显微镜下488 nm波长处观察,pEGFP-MSCVneo质粒组、pMSCVneo/N-cadherin质粒组PT67细胞均可见明亮的绿色荧光,胞浆和胞核都有,正常对照组、脂质体组未见绿色荧光。20-30 d后正常对照组、脂质体组细胞全部死亡,从而得到稳定转染的PT67细胞。
1.2 病毒滴度的测定 pEGFP-MSCVneo质粒组PT67细胞克隆1和2的病毒滴度分别为6×107cfu/L和 1×107cfu/L,pMSCVneo/N-cadherin质粒组PT67细胞克隆1和2的病毒滴度分别为2×107cfu/L和8×107cfu/L,遂选择pEGFP-MSCVneo质粒组PT67细胞克隆1和pMSCVneo/N-cadherin质粒组PT67细胞克隆2的病毒上清对EC9706进行转染。
1.3 EC9706的转染及抗性克隆的筛选与扩增 将病毒上清转染EC970624 h后,空载体组及干扰载体组即可见绿色荧光,胞浆和胞核都有,而正常对照组未见绿色荧光。当G418以600 mg/L的初选浓度作用5-7 d后,正常对照组细胞绝大部分死亡,然后将G418浓度降为300 mg/L维持,10-15 d后正常对照组细胞全部死亡,而空载体组及干扰载体组则形成大小不一的抗性克隆,后续培养中仍用含300 mg/L G418的条件培养基维持。
2 荷瘤裸鼠异种肿瘤接种实验
2.1 人食管鳞状细胞癌细胞系EC9706细胞异种移植瘤动物模型的建立 正常对照组、空载体组裸鼠均于接种后第7-8 d左右的时间出现肉眼可见的瘤体,而干扰载体组裸鼠出瘤时间较前2组延长大2-4 d。瘤体起初为椭圆形,以后生长渐不规则,凸凹不平。接种5周后,处死裸鼠并迅速测量瘤体体积和重量,见图1。与正常对照组、空载体组相比,干扰载体组裸鼠移植瘤体积和重量均明显减小,差异显著(P<0.05)。空载体组的肿瘤抑制率为6.89%,而干扰载体组的肿瘤抑制率为79.52%。解剖学检查各组没有明显差别,瘤体有完整包膜,未见肿瘤向周围组织侵袭,全身未见肿瘤转移,淋巴结不易找到,无胸腺,肺脏无栓塞。心、肝、脾、肾等器官肉眼观察无异常。
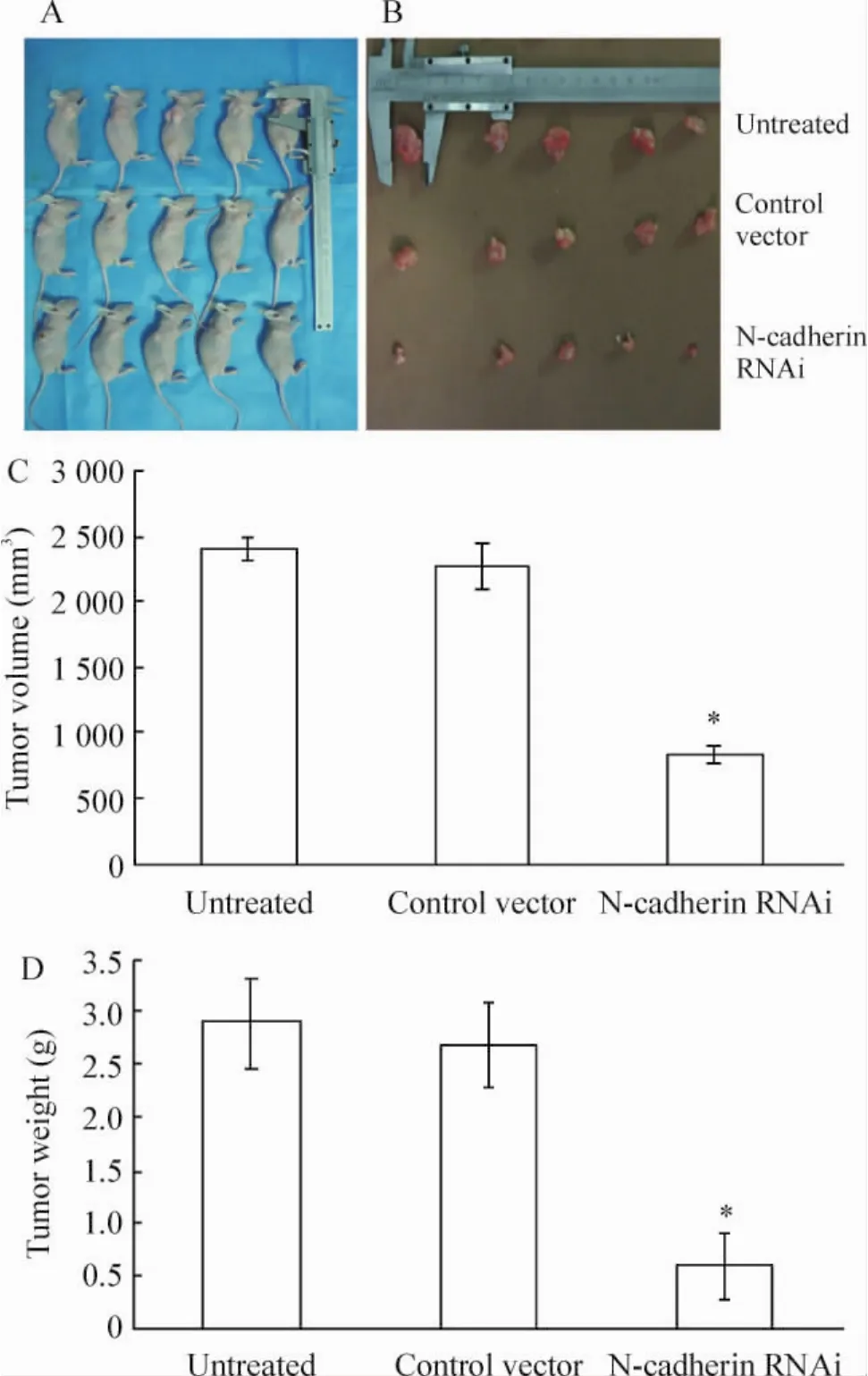
Figure 1.Effect of N-cadherin knock-down on EC9706 tumor growth in nude mice.A:photograph of nude mice at the 5th week;B:photograph of tumor tissues in nude mice at the 5th week;C:down-regulation of N-cadherin reduced the volumes of tumor tissues in N-cadherin RNAi group at the 5th week;D:down-regulation of N-cadherin reduced the weights of tumor tissues in N-cadherin RNAi group at the 5th week..n=5.*P<0.05 vs untreated and control vector groups.图1 RNA干扰沉默N-cadherin表达对EC9706细胞裸鼠体内成瘤能力的影响
2.2 生长曲线的绘制 接种后定期观察各组裸鼠移植瘤生长情况,每7 d测量1次裸鼠瘤体体积,然后绘制其生长曲线,结果显示:干扰载体组裸鼠瘤体生长缓慢且瘤体体积显著小于正常对照组和空载体组,组间比较差异显著(P<0.05),见图2。
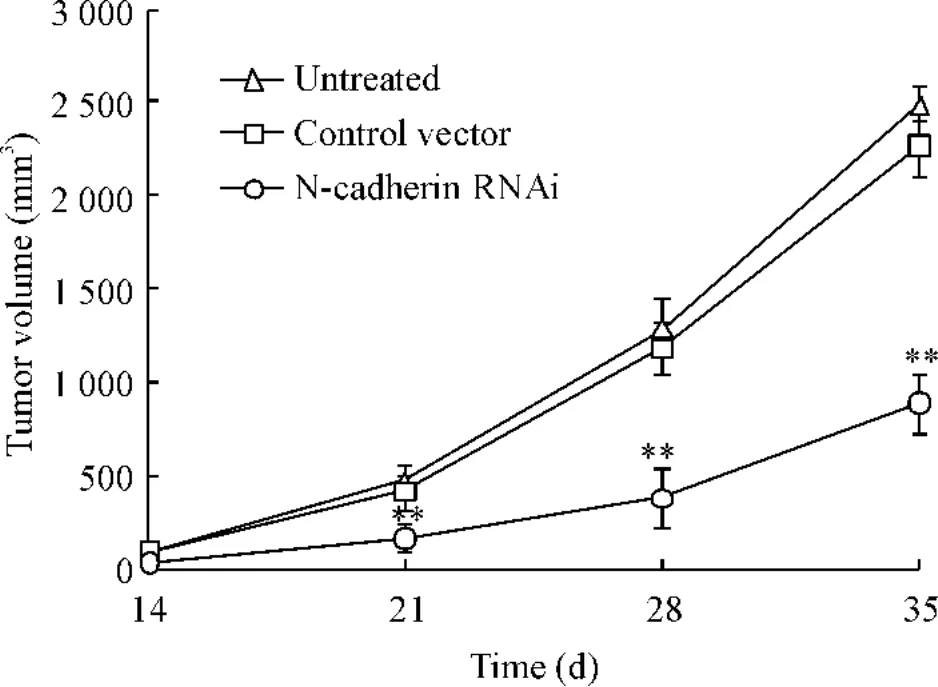
Figure 2.The grouth curves of tumor tissues in the 3 groups of nude mice..n=5.**P<0.01 vs untreated and control vector groups.图2 3组裸鼠移植瘤体积生长曲线
2.3 裸鼠移植瘤的组织学观察 3组裸鼠移植瘤组织HE染色后,光镜下观察可见大小不等的瘤细胞团,其中散在灶状、片状凝固性坏死,瘤细胞多为圆形或多角形上皮样细胞,大小不一,排列紧密,核染色质致密,染色深,异型性明显,部分肿瘤细胞病理性核分裂像可见。瘤细胞团周围有少量纤维结缔组织包绕,未见色素颗粒,见图3。
3 3 组裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9蛋白的表达
3.1 免疫组织化学法检测各组裸鼠肿瘤组织中E-cadherin、N-cadherin和MMP-9蛋白的表达 3组裸鼠移植瘤组织均见到E-cadherin蛋白阳性染色,呈棕黄色颗粒,阳性信号定位于细胞膜,3组比较差异无显著(P>0.05);正常对照组和空载体组裸鼠肿瘤组织中可见到N-cadherin和MMP-9蛋白阳性染色,呈棕黄色颗粒,阳性信号定位于细胞质,而干扰载体组中N-cadherin和MMP-9蛋白的阳性染色较弱,与正常对照组和空载体组比较,差异均显著(P <0.05),见表1、图4。
3.2 Western blotting检测3组裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9蛋白的表达 正常对照组、空载体组和干扰载体组3组裸鼠肿瘤组织中E-cadherin的蛋白表达比较,无显著差异(P>0.05);正常对照组和空载体组2组裸鼠肿瘤组织中N-cadherin的蛋白表达相比无明显变化(P>0.05),而干扰载体组中N-cadherin的蛋白表达与以上2组相比则明显降低(P<0.05);正常对照组和空载体组2组裸鼠肿瘤组织中MMP-9的蛋白表达相比无明显变化(P>0.05),而干扰载体组中MMP-9的蛋白表达与以上2组相比则明显降低(P<0.05),见图5。
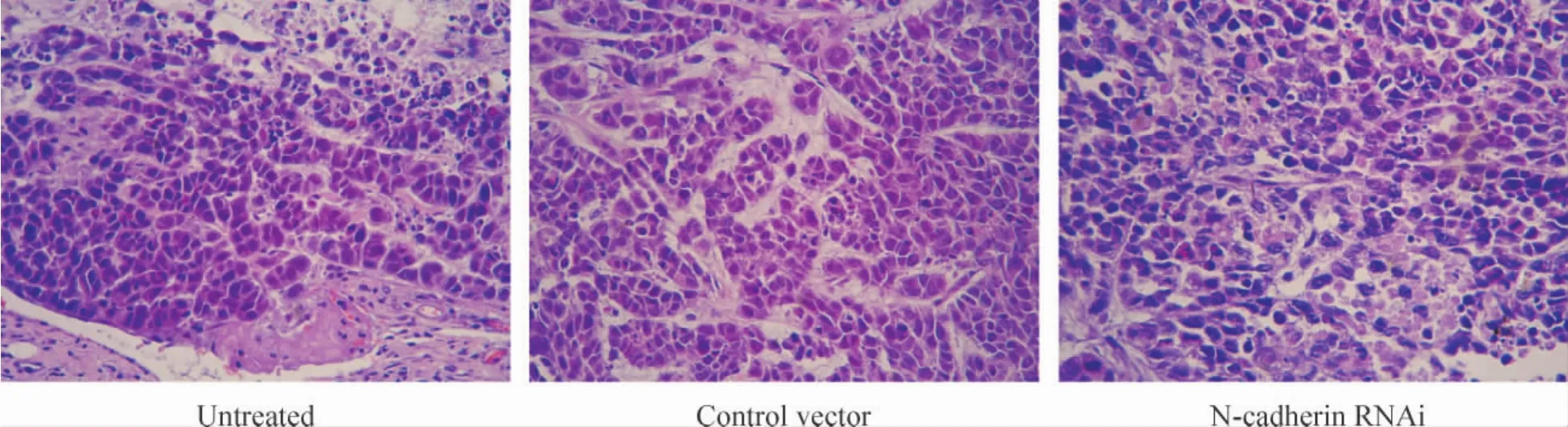
Figure 3.HE staining of tumor tissue in the 3 groups of nude mice(×400).图3 3组裸鼠移植瘤组织的HE染色结果

表1 3组裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9蛋白表达的比较Table 1.Comparision of E-cadherin,N-cadherin and MMP-9 protein expression in the 3 groups of nude mice

Figure 4.Expression of E-cadherin,N-cadherin and MMP-9 proteins in the 3 groups of nude mice(×400).图4 3组裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9蛋白的表达
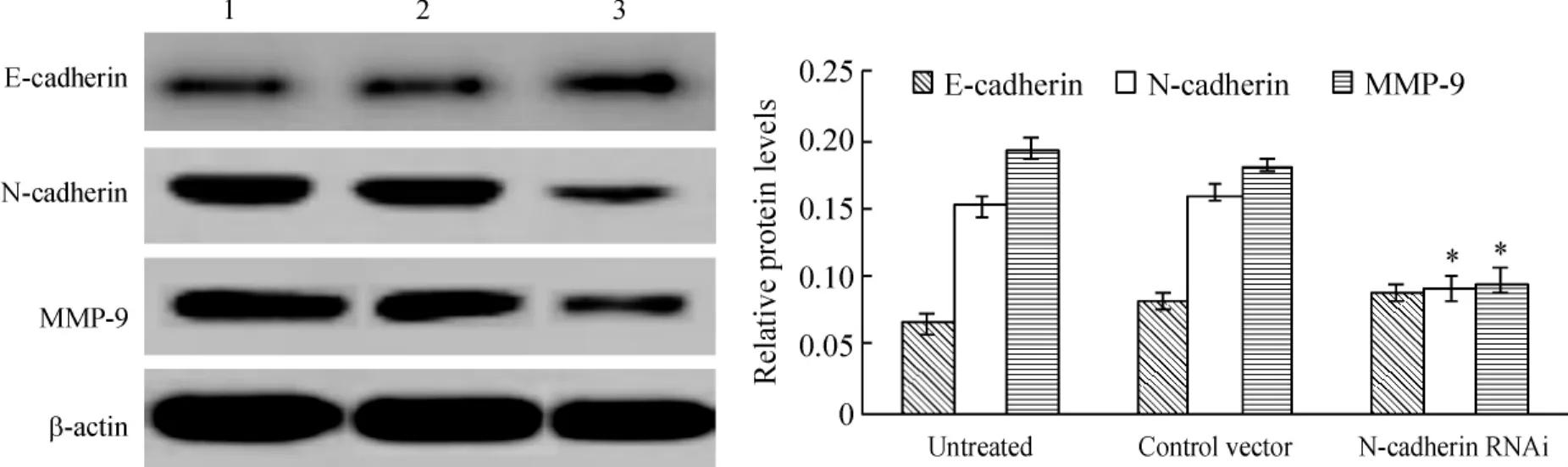
Figure 5.Western blotting analysis for N-cadherin,E-cadherin and MMP-9 expression in nude mice.1:untreated group;2:control vector group;3:N-cadherin RNAi group..n=5.*P<0.05 vs untreated and control vector groups.图5 3组裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9的蛋白表达
4 裸鼠移植瘤组织中细胞凋亡的检测
凋亡的原位酶标记检测结果显示,凋亡细胞的细胞核内出现棕黄色颗粒,干扰载体组凋亡的阳性细胞数明显增加,与正常对照组和空载体组相比差异显著(P<0.05),见图6。
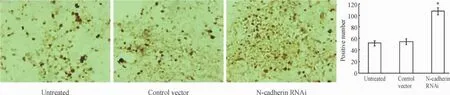
Figure 6.Apoptosis analysis of tumor tissues in the 3 groups of nude mice(TUNEL,×200)..n=5.*P<0.05 vs untreated and control vector groups.图6 3组裸鼠移植瘤组织中细胞凋亡情况
讨 论
E-cadherin和N-cadherin不仅在介导钙离子依赖的同型细胞间的黏附中发挥作用,而且在细胞迁移和肿瘤侵袭转移方面也有着重要作用。许多研究表明,E-cadherin是作为一种抑癌基因发挥作用的[7]。而最近研究表明,和 E-cadherin相反,N-cadherin在促进肿瘤的侵袭转移方面具有重要作用。
为了研究RNAi沉默N-cadherin表达对人食管鳞状细胞癌EC9706细胞体内生物学行为的影响,我们将转染前后的EC9706细胞大量扩增、收集后分别种植于裸鼠皮下,成功建立EC9706细胞异种移植瘤动物模型,该模型为进一步研究N-cadherin与食管鳞状细胞癌发生、发展及侵袭、转移关系奠定了良好基础。接种5周后,处死裸鼠并分离瘤体,分别行3组裸鼠移植瘤体积和重量的组间比较,结果发现:正常对照组、空载体组相比无显著差异(P>0.05),而干扰载体组与以上2组相比,组间比较差异显著(P<0.05)。这提示,RNAi沉默 N-cadherin表达对EC9706细胞裸鼠皮下移植瘤的生长有显著抑制作用。
本研究联合运用免疫组织化学法和Western blotting方法比较了3组裸鼠移植瘤组织中E-cadherin、N-cadherin和MMP-9蛋白的表达情况,结果显示:3组裸鼠皮下移植瘤中E-cadherin蛋白的表达无显著差异;而与正常对照组和空载体组相比,干扰载体组N-cadherin和MMP-9蛋白的表达明显减弱。这提示,干扰载体组EC9706细胞移植于裸鼠体内后,N-cadherin和MMP-9蛋白仍维持低表达,RNA干扰沉默N-cadherin表达可能通过下调MMP-9的表达,降低细胞对细胞外基质的降解能力,进而降低EC9706细胞的体内侵袭力。
已有多项体外实验表明[8-10],N-cadherin的异常高表达可以抑制肿瘤细胞凋亡。Li等[11]发现,黑色素瘤细胞中N-cadherin介导的细胞间黏附可以激活Akt/PKB通路,而导致预凋亡蛋白Bad失活和稳定态β-catenin的聚集,最终促进癌细胞的存活。Tran 等[12]发现,在前列腺肿瘤中,N-cadherin/catenin黏着复合体可以通过一个信号转导级联反应上调抗凋亡蛋白Bcl-2的表达,进而增加转移过程中癌细胞的生存能力。Makrigiannakis等[13]发现,抑制N-cadherin功能的抗N-cadherin抗体可以诱导表达N-cadherin的卵巢颗粒细胞发生凋亡。Gwak等[14]发现,通过反义载体转染抑制N-cadherin的功能后,与对照组相比,肝癌细胞在胆汁酸作用下更容易发生凋亡。Jiang等[15]发现,表达TIP30肿瘤抑制因子突变型(可以保护细胞抵抗顺铂诱导的凋亡)的人肝癌细胞HepG2对化疗不敏感,但如果运用RNA干扰技术沉默N-cadherin的表达,这类细胞又重新获得了对顺铂的敏感性。以上研究结果均表明,N-cadherin是一种凋亡抑制因子,可以通过抑制凋亡而促进肿瘤细胞的生长和存活。本实验运用TUNEL法比较了3组裸鼠移植瘤组织中细胞的凋亡情况,结果显示:干扰载体组裸鼠移植瘤组织中凋亡的阳性细胞数明显增加。这提示,RNAi沉默N-cadherin表达可能通过诱导细胞凋亡,进而抑制EC9706细胞裸鼠皮下移植瘤的生长。
[1]邹小农,陈万青,张思维,等.中国部分县市1998-2002年食管癌发病与死亡[J].中国肿瘤,2007,16(3):142-146.
[2]张亚冰,赵立群,裘宋良,等.河南省林州市2004年与1980年食管癌前病变和食管癌患病率的比较研究[J].中华肿瘤预防杂志,2006,13(5):328-330.
[3]Pettitt J.The cadherin superfamily[J].WormBook,2005,29(4):1-9.
[4]Shibata T,Hirohashi S.E-cadherin cell adhesion system in human cancer[J].Seikagaku,2006,78(7):647-656.
[5]Mǎrgineanu E,Cotrutz CE,Cotrutz C.Correlation between E-cadherin abnormal expressions in different types of cancer and the process of metastasis[J].Rev Med Chir Soc Med Nat Iasi,2008,112(2):432-436.
[6]李 克,王 鑫,何 炜,等.神经型钙粘素在食管鳞癌组织中的表达及RNAi沉默该基因对EC9706细胞体外侵袭能力的影响[J]. 癌症,2009,28(1):11-18.
[7]谢传高,魏树梅,陈清宇,等.GEP100基因沉默抑制胰腺癌细胞AsPC-1的侵袭能力[J].中国病理生理杂志,2010,26(7):1348-1351.
[8]Erez N,Zamir E,Gour BJ,et al.Induction of apoptosis in cultured endothelial cells by a cadherin antagonist peptide:involvement of fibroblast growth factor receptor-mediated signalling[J].Exp Cell Res,2004,294(2):366-378.
[9]Peluso JJ,Pappalardo A,Trolice MP.N-cadherin-mediated cell contact inhibits granulosa cell apoptosis in a progesterone-independent manner[J].Endocrinology,1996,137(4):1196-1203.
[10]Peluso JJ.Putative mechanism through which N-cadherin-mediated cell contact maintains calcium homeostasis and thereby prevents ovarian cells from undergoing apoptosis[J].Biochem Pharmacol,1997,54(8):847-853.
[11]Li G,Satyamoorthy K,Herlyn M.N-cadherin-mediated intercellular interactions promote survival and migration of melanoma cells[J].Cancer Res,2001,61(9):3819-3825.
[12]Tran NL,Adams DG,Vaillancour RR,et al.Signal transduction from N-cadherin increases Bcl-2.Regulation of the phosphatidylinositol 3-kinase/Akt pathway by homophilic adhesion and actin cytoskeletal organization[J].J Biol Chem,2002,277(36):32905-32914.
[13]Makrigiannakis A,Coukos G,Christofidou-Solomidou M,et al.N-cadherin-mediated human granulosa cell adhesion prevents apoptosis:a role in follicular atresia and luteolysis?[J].Am J Pathol,1999,154(5):1391-1406.
[14]Gwak GY,Yoon JH,Yu SJ,et al.Anti-apoptotic N-cadherin signaling and its prognostic implication in human hepatocellular carcinomas[J].Oncol Rep,2006,15(5):1117-1123.
[15]Jiang C,Pecha J,Hoshino I,et al.TIP30 mutant derived from hepatocellular carcinoma specimens promotes growth of HepG2 cells through up-regulation of N-cadherin[J].Cancer Res,2007,67(8):3574-3582.
