离体软组织弹性的常用测试方法和应用
2011-07-31黄燕平郑永平
黄燕平,郑永平
香港理工大学 医疗科技及资讯学系,香港
离体软组织弹性的常用测试方法和应用
黄燕平,郑永平
香港理工大学 医疗科技及资讯学系,香港
专论——生物组织弹性测量

栏目主编:郑永平(香港理工大学 医疗科技及资讯学系)
郑永平教授分别于 1990 及 1993 年获中国科学技术大学电子信息工程学士及硕士学位,1997 年获香港理工大学生物医学工程博士学位,其后在加拿大温莎大学 (University of Windsor)就读博士后,于 2001 年成为香港理工大学助理教授,并于 2008 年在医疗科技及资讯学系晋升为教授。2008 年 8 月 ~2010 年 7 月,他同时兼任香港理工大学创新产品和技术研究所副所长。郑永平教授的主要研究方向包括超声弹性测量与成像、三维超声成像与测量、医用超声仪器的创新、研究与开发,以及可携带人体生理参数测量仪等。主持承担多项科研项目。他已发表及录用的 SCI论文 90 余篇,国际会议论文 150 余篇,另有 6 项美国和 4 项中国授权的专利及另外 12 项受理中的专利。他所开发研制的组织超声弹性测量仪已被国内外多间大学和医院用于各种软组织的评估,并有7项专利已成功转让给了工业界作产业化。
弹性是软组织一个很重要的力学参数,可用于生物力学系统的建模、分析和病灶的诊断及治疗手段有效性的评估。根据弹性力学和材料力学基本知识,可用标准测试例如压缩、拉伸、扭转和弯曲等来测量组织的弹性特征。这些测试的优点是边界条件简单,很容易直接获得组织的本征弹性参数例如杨氏模量、剪切模量或者泊松比。但是因为测试需要准备形状规则的样本,所以这些方法仅适用于离体组织的测量。结合适当的粘弹性模型,这些标准测试还可以用于测试组织的非线性粘弹性参数。因为可以方便测得组织很重要的基本弹性特征,这些离体组织样本测试方法还是被大量用于实际测量当中。这期我们将对离体组织样本的常用弹性测量方法作一些介绍,并分析这些测量方法及相关力学模型的优点和缺点,最后以软骨的离体样本测试为例说明这些弹性测试方法在生物医学相关领域的应用。
弹性;弹性测量;应力;应变;杨氏模量;剪切模量;泊松比;粘弹性;力学测试;压缩;拉伸;扭转;弯曲;膨胀
1 材料弹性测量背景介绍
我们在此专栏第一期文章中概括地讨论了组织弹性测量的意义,在这一期我们主要介绍离体组织弹性测量的常用方法,包括一些所谓“标准”的测试方法,例如压缩等,也包括一些比较特殊的方法,例如膨胀测试法。标准的测试方法受测量本身和外在因素的影响小,可以认为是组织弹性测试的“金”标准(gold standard)。弹性是生物组织很重要的一种材料特性,生物组织虽然跟工程固体材料例如金属和塑料有很大的不同,但本质上也是一种材料,所以在材料力学和弹性力学当中,一些常用的测试方法作一些适当的处理就可以直接推广到生物组织的弹性测量上面。相对于固体工程材料,软组织包含水分,某些组织的结构如胶原蛋白纤维网络的排列方向会随位置或者深度方向的不同而不同,因此它的材料性质也比较复杂,实际当中要完全精确地测量组织的力学特性不太现实,需要简化组织的模型获得尽量少,但是有效的弹性参数。先从最简单的弹性固体模型说起,传统的连续介质固体弹性理论证明,假设被测物体是各向同性的材料,在小形变下应力/应变表现为线弹性,遵从胡克定律(Hooke's Law),那么反映其应力 /应变基本关系的本构方程(constitutive equation)可以表示为[1-2]:

其中ε为应变,σ为应力,下标代表笛卡尔直角坐标系下不同的三轴x、y和z,E为杨氏模量(Young's modulus),μ为剪切模量(Shear modulus),ν为泊松比(Poisson's ratio)。在各向同性的假设下,三个材料参数里面只有两个是互相独立的,它们之间的约束关系可以表示为:

这些基本的材料参数需要通过实验进行测量,测量的方法包括下面介绍的压缩、拉伸、扭转、弯曲测试等。当把生物组织简化到均匀的各向同性并且忽略其随时间变化的粘性特征的时候,就可以用这些基本的实验方法来测得组织的弹性参数。实际应用当中,因为组织力学特性的复杂性,这样简单化的模型不能满足测量需求。为了更进一步获得组织的非线性粘弹性系数,必须假设更加符合材料特性的本征方程然后结合相对应的实验进行测量[3],例如实际应用当中经常使用的两个模型——超弹性模型(hyperelasticity)[4-5]和加了时间特征的准线性粘弹性(Quasilinear viscoelasticity, QLV)模型[6-8],就可以用来更好地预测组织的力学行为,获得更好表征组织力学行为的非线性粘弹性参数。
离体组织测试的缺点也是显而易见的,因为离体组织已经脱离了它本身所在的生物体,周围环境变化以及新陈代谢的中断,其力学特性很可能已经跟活体组织情况产生了很大的变化,所以测得的参数可能并不能很好地代表该组织在生物活体情况下的弹性特征。实际测量当中可以通过优化的标本保存方法,尽量避免这种情况的发生,或者尽量减小这些离体因素的影响。对于某些组织来说,这两种情况的差别可能很大,譬如对于那些有包膜的组织,例如淋巴结,离体小样本测量的时候可能已经破坏了外面的被膜,再加上离体情况下淋巴液流动的停止,所以在离体和活体情况下测量出的弹性参数可能会有很大的区别。而对于某些组织例如软骨[9]或脚底软组织[10],通过合适的低温保存,弹性特征的变化不显著。所以对于活体和离体情况下的差异,不同组织受其生理结构和组织功能的不同而有很大的不同,实际当中需要对每种组织作不同的评估,然后决定合适的测量方法。本文首先介绍离体组织弹性测量的常用方法,然后重点以软骨测试为例具体说明这些测试方法在生物医学领域相关的应用,最后小结全文。
2 软组织弹性常用测试方法
本节着重介绍几种常用的离体组织弹性的测量方法。我们这里需要特别指出的是印压(indentation)测试,它既可以应用在离体测量,又可以用在活体组织测量上,是一个非常有用的弹性测量方法。对于印压,因为非常广泛的应用还有其可用于活体组织测量的特殊性,本文不作重点介绍,我们会在接下来的两期里面单独讨论。对于下面介绍的常用测量方法(除了膨胀),我们主要介绍最简单化的组织模型下(各向同性、均匀和小形变固体)测量组织弹性参数例如杨氏模量或者剪切模量的公式。对于更加复杂组织的非线性粘弹性模型,我们在 2.5 中作简要介绍。
2.1 压缩和拉伸测试
压缩或拉伸是最常用的离体组织弹性测量方法,这里我们只讨论简单的单轴压缩或拉伸测试。非受限单轴压缩(unconfined uniaxial compression)实验将外形规则(一般是圆柱体)的标本放在两个夹板之间进行压缩,在横向让组织自由膨胀,然后测量组织在小形变情况下的应力/应变关系,算得组织的杨氏模量。在单轴压缩情况下,应力除σxx外,其它都为 0,公式(1)可以简化为 :

也就是说,组织杨氏模量可以通过以下公式求得:

其中F为被测样本所受总外力,A0=πr2为样本受压横截面积,l0样本初始厚度,l为样本形变。实验当中为了防止压缩时样本失稳,样本高度和直径之比(l0/2r)可取1.5~2.0[11]。在压缩之后,组织会在横向有膨胀,假设横向应变为εyy,那么所测组织的泊松比也可以通过以下公式求出:

组织在横向的应变可由多种方法求得。Jurvelin等[12]利用光学显微镜方法观察软骨在压缩测试时横向的应变,然后直接求得软骨的泊松比。Lu等[13]利用超声来观察样本在横向的形变情况,同样可以求得所测样本的泊松比。实际测量当中需要注意夹板跟组织之间的摩擦力对测量结果的影响。这是因为摩擦力的存在使得靠近压板附近的组织横向扩张受到限制,跟理论的压缩模型产生了差异[14-15],这种差异会随着摩擦系数的增大显得更加明显。有限元分析表明,当接触表面摩擦系数为0.5的时候,应力/应变曲线相对于零摩擦力情况下的差异可达到50%或以上[15],该影响不能忽略。实际操作中,通常可以使用摩擦力小的抛光压板[4]或者在夹板上加一层光滑薄膜,如聚四氟乙烯(PTFE)[5],或者利用添加润滑剂[13-14]来减小摩擦力对测量的影响。
受限压缩(confined compression)是另外一种常用的生物组织弹性测量方法。在四周受限压缩情况下,横向的应变为 0,也就是说,εyy=εzz=0,根据胡克定律的另外 一种形式[3],此时 :
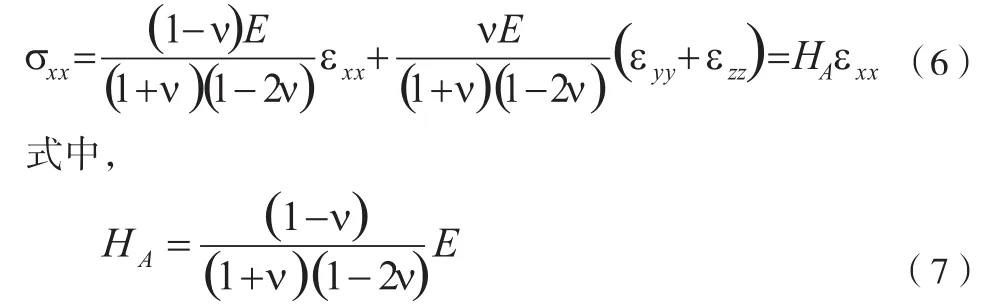
称为整体模量(aggregate modulus),代表材料在横向受限压缩情况下的弹性特征。可以看到假如材料体积完全不可压缩(ν→0.5),整体模量会趋向于无限大(实际组织测试当中不会发生),当材料体积压缩性很大时(ν→0),整体模量就趋近于杨氏模量,所以整体模量也是组织体积是否具有可压性的一个直观的体现。受限压缩测试应用最多的组织是关节软骨[16-22],其次还有半月板[23]、椎间盘[24]等类软骨组织及皮肤[25]。受限压缩测试的特点是在把组织看成两相性(biphasic,固相和液相)时,可以控制组织液体流动的方向,并且结合松弛或者蠕变测试可以用来测试组织的液体渗透性(permeability)。实际测试当中,根据组织本身具体情况决定周围测试仪器的材料。例如在关节软骨受限压缩测试当中,通常横向包围软骨组织的选用密封无孔材料,模拟软骨在快速压缩下的低渗透率,软骨底部压头也选用无孔材料以模拟软骨底部骨头对液体的低渗透性,但是软骨表面压头一般选用孔状材料,允许软骨液体在测试中自由流出。在两相性组织模型里,组织最后稳定状态下测到的是其中固态结构的整体模量,它和组织杨氏模量的关系如公式(7)所描述,如泊松比已知,可互相转化。
拉伸实验跟压缩实验类似,可以用来测量组织的弹性特征。该方法通常使用在那些需要通过拉伸来完成其生物力学功能的组织,例如血管[26-29]、筋腱[30-32]、韧带[33-34]和皮肤[35-36]。实验中需要用拉头固定组织样品的两端,并且确保生物组织和拉头在拉伸测试中不会有相对运动。通常可以在拉头表面使用砂纸以增大拉头和组织之间的摩擦力,防止拉头和样品的相对滑动。对于中空的组织,例如血管,拉伸还可以在两个方向进行,一个是沿着血管方向的拉伸[28],测试血管组织沿着血管方向的弹性参数 ;另外一个是沿着径向的[29],可以模量实际当中血管中血压对血管的撑大膨胀作用,获得血管沿径向的弹性。对于某些微细的组织,例如结缔组织基本成份之一的胶原蛋白纤维,特别适合用拉伸来测试其弹性特征[37]。
2.2 剪切和扭转测试
活体生物组织在力学运动中所受的应力除了轴向的压缩或拉伸外,还伴随着剪切形变,例如不同心肌层之间存在的剪切形变是心脏在收缩期心肌增厚的原因之一[38],在大脑组织上也可以经常看到因为剪切产生的创伤[39]。因此生物组织的剪切力学性能也是组织很重要的一个特性参数,需要用剪切测试或者扭转测试来获得。纯剪切实验需要准备规则的长方体样本,根据公式(1),简单的小形变剪切测试只需要测量出剪切应力/应变就可以获得材料的剪切模量:

其中Fxy为组织表面沿y向所受剪切力,A0为剪切力作用面积,dxy为剪切方向位移,l0为组织的厚度。Dokos等设计一个用于剪切测试的三轴测量系统[40],并用于各向异性的心肌的剪切特性测量[41]。Tanaka等[42]研究发现颞下颌关节盘的动态剪切模量跟测试的频率有关,而且具有方向性。
在使用扭转测试时,需要准备标准的圆柱体样本,假设其截面半径为 r,对应极惯性矩(polar moment of inertia)为 J=πr4/2,长度为 L,扭矩为 M,那么圆周处的剪切应力为[43]:

假设此时样本扭角(twist angle)度为φ,那么圆周处的剪切应变为:

那么所测材料的剪切模量就可以通过以下公式算出:

为简单化,有时候也用扭矩/扭角比(M/φ)直接表征组织的扭转硬度[44]。标准的扭转测试可能只适合于相对硬度比较大的生物软组织,例如软骨[45]和韧带[44,46]等。
2.3 弯曲测试
虽然不是很常见,但是弯曲测试也可以用来测量软组织的弹性测量[47-48],例如血管壁[49-50]和脉瓣[51],这是因为这些组织在血流运动学中的受力状态有点类似于弯曲测试。简单的三点弯曲测试,假设受力组织为截面宽度b,高h的长方体,所受力偶矩(moment of couple)为 M,受力后弯曲的圆弧半径为R,那么组织的有效杨氏模量可以通过以下公式求得[52]:

其中I=bh3/12为样本的贯性矩(moment of inertia)。Yu等[49]研究了动脉血管壁在弯曲测试里中性轴(neutral axis)的位置,并且发现血管内膜和中膜的硬度远远大于外膜的硬度。Roy等[53]用弯曲测试比较耳廓软骨和肋软骨的硬度,还比较了组织工程培养出来的软骨硬度与自然软骨硬度的区别,结果显示耳廓软骨硬度大于肋软骨硬度,人工培养的软骨硬度则小于自然软骨的硬度。
2.4 膨胀测试
膨胀测试就是利用组织内部离子浓度和外部溶液离子浓度不同引起的唐南渗透压(Donnan osmotic pressure)引起的形变,测量组织的力学特征参数[54]。该方法的优点是不需要借助外来负载直接利用组织内部产生的渗透力使组织产生形变,该方法被广泛应用于软骨组织的测试上[55-63]。当周围溶液离子产生变化的时候,因为离子浓度的不平衡,在软骨内部产生渗透压,使软骨产生膨胀,并最后通过胶原蛋白的拉伸产生的应力来达到平衡。膨胀测试已经被成功用于测量软骨的硬度特性。在计算中,应力由唐南压计算,需要知道软骨在不同层的固定电荷浓度(fixed charge density)、水分浓度分布和溶液浓度 ;对于软骨不同位置应变的测量,可用光学方法测量[62],但是其缺点是只能观察软骨样本外边界处的变化情况,无法观察样本中间任何截面上组织形变情况。Tepic 等[64]用超声的方法观测软骨在渗透压负载下的形态变化情况,但是他们测量当中只使用了软骨表面反射的信息,没有在膨胀测试中对软骨内部进行观察。鉴于高频超声可以很方便观察软骨的内部变化,我们组采用了 50MHz高频超声探头对软骨进行超声显微成像,成功测得软骨内部不同层在膨胀中的不同应变情况,并结合一个四参数三相软骨模型成功测得软骨不同层的整体模量分布情况[65-70],再一次验证了软骨整体模量随着深度的增加而增大的结论[20]。
2.5 粘弹性系数和本构方程
由于软组织结构的复杂性,简单的各向同性、均匀性的线弹性模型在实际当中很多情况下都不符合组织在生物体里面真实的力学行为。例如,简单的线弹性模型就很难解释组织的应力松弛和应变蠕变实验,也不能解释为什么生物体的弹性参数与激励的频率有关。生物组织普遍具有所谓应变硬化(strain hardening),也就是硬度随着应变增大而增大的现象,这就是软组织的非线性弹性,对于某些组织这种非线性在测试的时候也必须考虑。所有这些都可以在代表组织力学行为特征的本构方程得到体现。例如,为了模拟组织在大形变下的非线性力学特征,一个很常用的 模 型 就 是 超 弹 性(hyperelasticity) 模 型[4,71-73]。 该 模 型假设一个应变能量方程,描述应力/应变之间的非线性关系,然后结合实验数据进行逆问题求解,获得这个应变能量方程中的系数值,用它们代表组织的弹性特征,这些系数被证明可以用来区分正常和疾病组织[74]。另外一个常用的考虑组织粘弹性的模型就是准线性粘弹性(Quasi-linear viscoelasticity,QLV)模型[6]。QLV 模型假设在应力松弛实验下利用一个代表弹性 (T(λ))和一个代表粘性 (G(t))的函数之乘积分离组织的粘弹性:

其中F为t时刻的应力,λ为零时刻对组织施加的阶跃形变。粘性方程可以用来求得跟组织粘性有关的松弛时间参数和常数,弹性部分则代表组织的暂态弹性特征。然后考虑形变随时间的函数为u(t)的组织所受的应力为f(t),根据力的叠加原理,它们之间的关系可以写成:

其中T上一点表示对时间τ求一次导数。根据实验测得形变u(t)和力f(t),我们就可以利用最优化方法求得弹性和粘性函数当中的代表组织弹性特征的参数,并用于特征化不同的组织。我们已经成功将该方法应用于比较腿部软组织在肌肉不同收缩状态下和颈部组织放疗后不同纤维化程度下粘弹性特征的不同[75-76]。QLV模型还可广泛用于其它类型软组织,例如脊髓[77]、韧带[78]、食道[79]和足部软组织[7-8]等的力学测量。除了这两个模型,在外力负载作用下组织的粘弹性行为,还可以用包含基本单元弹簧和阻尼器的复合结构(串并联)来描述[3],在该模型下,用一个弹性系数k代表每个弹簧的弹性,另外用一个阻尼因子η代表每个阻尼器的特性,描述它们力学特征的基本方程为:

公式中x为位移,x上一点代表求导,v代表速度。可以通过实验数据进行曲线拟合获得结构中基本单元的参数,用以表征组织测试表现出来的粘弹性行为。详细介绍组织粘弹性的本征方程已经超出了本文的范围,有兴趣的读者可以参考这方面的专著[80-81]。
3 软组织常用弹性测试方法的应用
上面介绍的这些离体软组织弹性的测量方法在应用方面,主要以基础研究为主,或者作为活体生物组织通过弹性进行疾病诊断的可行性研究。所谓基础研究,就是找到合适的力学模型,来描述组织在各种测量当中的力学行为。这些模型能让我们更加理解组织的生物力学行为,可用于计算机的虚拟现实(virtual reality)技术,例如模拟手术当中对组织的触感。对于疾病的诊断方面,准确的弹性力学模型可以预测弹性变化的机制,找到干预这些变化的有效手段。如果能够验证组织弹性在离体状态下可以作为疾病诊断的依据,那么这些弹性参数就有进一步的可能用于在活体上对疾病进行诊断。下面我们主要以软骨为例介绍离体弹性测量在这些方面的应用。
3.1 离体软骨弹性测试应用
软骨在人体运动力学上起到很关键的支撑和润滑作用。之所以要了解软骨的弹性特征,是因为由骨关节炎或者创伤引起的关节退化,是一种很常见的疾病,因为软骨本身自我代谢的速度比较慢,所以普通软骨创伤恢复的时间就比较长。对于软骨的退化,如果在晚期才检测出来,目前没有有效的医治方法。伴随着早期软骨退化的一个很重要的特征就是其硬度的变化,因此可以通过其硬度的测量来诊断其病变,做到早发现早治疗,治疗效果也就可能会相应提高。因为关节软骨所处的位置在关节腔内,空间比较小,所以活体测量软骨的弹性是一个比较有挑战性的课题。实验已经证明适当的低温冷藏和解冻技术对软骨样本的生物力学性能影响不是很大[9,82],所以离体测试也就成了很常用的可以深入了解软骨弹性特征的测试方法。
上面提到的这些离体组织的弹性测试方法都在软骨上获得了应用。其中应用最多的就是拉伸、自由压缩和受限压缩,可用来研究软骨弹性与其结构成分的关系。Kempson等[83]利用拉伸实验证明软骨的拉伸硬度跟里面的胶原蛋白纤维方向有关,顺着纤维方向拉伸的硬度明显大于跟纤维方向垂直方向的拉伸硬度[84],同时在软骨深度方向,拉伸硬度表层最大,随着深度的增加而减小。利用受限压缩,Schinagl等[20]发 现 整 体 模 量 表 层 最 小, 随 着 深 度 的增加而增加。拉伸和压缩硬度随深度变化的模式为什么有这样的不同呢?这可以归结为软骨两种主要成分胶原蛋白(collagen)和蛋白多糖(proteoglycan)随深度分布的不同。研究表明软骨拉伸硬度受胶原蛋白的影响大一些,而压缩硬度主要跟蛋白多糖浓度相关[85-87]。软骨中表层的胶原蛋白最多,蛋白多糖最少,而中下层却刚好相反[85],这就导致了拉伸和压缩硬度随深度变化模式的不同。另外,当软骨 发 生退化以后, 其 拉 伸硬度和压缩硬 度 都 会 减 小[85]。例如,Akizuki等[88]通过实验得到股骨髁(femoral condyle)处表层正常软骨拉伸模量均值为 7.79MPa,但是同一位置具有骨关节炎退化特征的软骨拉伸模量则降到 1.36MPa,显示退化后软骨硬度产生了明显的下降,这表示软骨的抗压性能下降,那么它就难以维持关节在正常活动中的生理负荷,这种超过极限的负荷随时间积累可能会加速软骨退化的速度。扭转测试也被用来测量软骨的弹性特征,使用小幅度扭角的时候,扭转测试结果跟软骨里面液体流动性无关,所以可以测得里面固态结构的本征弹性参数。Setton 等[45]用前十字韧带切除手术动物模型来模拟关节退化,通过扭转实验发现手术之后6周软骨的剪切模量降到了手术前的60% 左右,说明软骨质量也发生了明显的退化。为了确定软骨硬度跟临床上经常使用的软骨质量分数之间的关系,Kleeman 等利用压缩测试软骨在终稳状态下的硬度,然后跟两个常用的软骨质量评分系统 :Mankin score 和国际软骨修复协会推荐的软骨质量分数(ICRS grade)进行相关性分析,得出软骨硬度跟 Mankin score 的相关度为 R2=0.47,而其与 ICRS grade 之间的相关度为 R2=0.69。正常的软骨跟ICRS grade 为 2 级和 3 级的软骨可以通过硬度进行区分,但是和 1 级软骨之间硬度有重叠,区分就有困难。Zheng等结合自由压缩测试与超声测量技术对关节软骨作了一系列的测试[89-91]。他们发现经酶 trypsin 处理过的软骨有层状的硬度分布[89]。另外他们还观察到了软骨在应力松弛测量中存在应变的松弛现象,即在受压方向不同深度软骨组织的应变分布会随着时间的变化而改变[90]。这一发现验证了软骨两相理论所预测的结果。Zheng 等还通过自由压缩测试与超声显微镜开发了超声弹性显微镜并成功应用于软骨弹性分布的测量[91]。总的说来,离体弹性测量已经成为一个研究软骨的基本工具,除了用来研究软骨的退化,还可以用在软骨的修复[92]以及组织工程软骨的质量评估[93-95]等方面。
3.2 离体组织弹性测试的其它应用简介
除了在软骨上面的应用,离体弹性测试方法在其它组织方面的应用也是广泛的。作者在这里举几个例子以期在这方面可以起到抛砖引玉的作用。第一个例子是肝纤维化检测。为了证明肝硬度跟临床常用的肝纤维化评分标准具有一致性,Yeh 等[96]利用压缩实验测试离体肝脏的硬度,然后跟 METAVIR 分数进行相关分析,可以得到显著的正向相关性,证明利用肝硬度评估肝纤维化水平具有可行性。第二个例子是脚底软组织的弹性测量,特别是糖尿病人的足部因为糖基化引起的血管供血不足和神经损伤,长期引起的后果是足部组织硬度会发生改变。Pai和 Ledoux[97]通过离体压缩测得糖尿病人脚底组织平均硬度为(1147±446)kPa,而正常人脚底组织的平均硬度为(593±205)kPa,证明糖尿病人脚底软组织的确受到了病变的影响。最后一个例子跟癌症组织的硬度相关。Krouskop 等[98]利用离体印压实验发现在乳腺组织和前列腺组织上,恶性肿瘤组织在大形变情况下弹性模量增加的程度比正常和良性病变组织大,证明恶性肿瘤组织具有很大的非线性弹性特征,因此测量组织的非线性弹性参数对于组织病变的诊断具有很大的潜力。
4 结束语
因为活体测量环境的限制,某些情况下很难进行准确的组织弹性测量,这个时候可以借助于离体弹性测量技术。这些离体测量技术通过简单的边界条件,可以比较容易地获得被测组织的本征弹性参数,所以离体测量技术在一定程度上成为组织弹性测量的“金”标准,可以作为一个切入点,特别适合于那些生物力学研究方面还在起步阶段的组织。通过这些测量方法测得的弹性参数主要可以用来:① 研究组织的基本生物力学行为,用于建立准确的组织生物力学模型 ;② 作为参数输入计算机进行计算分析,准确模拟特定生物组织在运动学和动力学活动中的响应 ;③ 验证弹性参数用于某些疾病诊断的可行性,作为下一步寻找合适活体组织弹性测量方法和仪器的前提条件 ;④ 评估某些新型治疗方法改善组织弹性特征的有效性。这些基本的离体组织弹性测量方法应用广泛,无论是现在还是将来,它们都还会在组织生物力学研究和诊断方面发挥不可或缺的作用。
致谢:
作者感谢香港研究资助局(PolyU5354/08E)和香港理工大学(J-BB69)基金对本研究的资助。
[1] Fung YC.Chapter 6:Elastic and plastic behavior of materials[M] //In:Fung YC,editor. Fundations of Solid Mechanics.Englewood Cliffs,NJ:Prentice Hall,1965:127-153.
[2] 徐芝纶.第二章:平面问题的基本理论[M]//徐芝纶, 编. 弹性力学(上册).北京:高等教育出版社,2006:9-35.
[3] Fung YC.Chapter 2:The meaning of the constitutive equation[M]//In:Fung YC,editor. Biomechanics:Mechanical Properties of Living Tissues.New York:Springer-Verlag,1993: 23-65.
[4] Miller-Young JE,Duncan NA,Baroud G.Material properties of the human calcaneal fat pad in compression: experiment and theory [J].J Biomech,2002,35(12):1523-1531.
[5] Miller K,Chinzei K.Constitutive modelling of brain tissue: experiment and theory[J].J Biomech,1997,30(11-12):1115-1121.
[6] Fung YC.Chapter 7:Bioviscoelastic solids[M]//In:Fung YC,editor.Biomechanics: Mechanical Properties of Living Tissues.New York:Springer-Verlag,1993:23-65.
[7] Pai S,Ledoux WR.The quasi-linear viscoelastic properties of diabetic and non-diabetic plantar soft tissue [J].Ann Biomed Eng,2011,39(5):1517-1527.
[8] Ledoux WR,Blevins JJ.The compressive material properties of the plantar soft tissue [J].J Biomech,2007,40(13):2975-2981.
[9] Szarko M,Muldrew K,Bertram JEA.Freeze-thaw treatment effects on the dynamic mechanical properties of articular cartilage [J].BMC Musculoskelet Disord,2010,(11):8.
[10] Bennett MB,Ker RF.The mechanical properties of the human subcalcaneal fat pad in compression [J].J Anat,1990,171(8): 131-138.
[11] 胡文全.第二章:材料在其它静载荷下的力学性能[M]//时海芳,任鑫,编.材料力学性能.北京:北京大学出版社,2010: 64-92.
[12] Jurvelin JS,Buschmann MD,Hunziker EB.Optical and mechanical determination of Poisson's ratio of adult bovine humeral articular cartilage[J].J Biomech,1997,30(3):235-241.
[13] Lu MH,Zheng YP,Huang QH.A novel noncontact ultrasound indentation system for measurement of tissue material properties using water jet compression[J].Ultrasound Med Biol,2005,31(6):817-826.
[14] Charalambides MN,Goh SM,Wanigasooriya L,et al.Effect of friction on uniaxial compression of bread dough[J].J Mater Sci,2005,40(13):3375-3381.
[15] Wu JZ,Dong RG,Schopper AW.Analysis of effects of friction on the deformation behavior of soft tissues in unconfined compression tests[J].J Biomech,2004,37(1):147-155.
[16] Mow VC,Kuei SC,Lai WM,et al.Biphasic creep and stressrelaxation of articular cartilage in compression-theory and experiments[J].J Biomech Eng-Trans ASME,1980,102(1): 73-84.
[17] Soltz MA,Ateshian GA.Experimental verification and theoretical prediction of cartilage interstitial fluid pressurization at an impermeable contact interface in confined compression[J].J Biomech,1998,31(10):927-934.
[18] Korhonen RK,Laasanen MS,Toyras J,et al.Comparison of the equilibrium response of articular cartilage in unconfined compression,confined compression and indentation[J].J Biomech,2002,35(7):903-909.
[19] Knecht S,Vanwanseele B,Stussi E.A review on the mechanical quality of articular cartilage - implications for the diagnosis of osteoarthritis[J].Clin Biomech,2006,21(10):999-1012.
[20] Schinagl RM,Gurskis D,Chen AC,et al.Depth-dependent confined compression modulus of full-thickness bovine articular cartilage[J].J Orthop Res,1997,15(4):499-506.
[21] Ateshian GA,Warden WH,Kim JJ,et al.Finite deformation biphasic material properties of bovine articular cartilage from confined compression experiments[J].J Biomech,1997,30(11-12): 1157-1164.
[22] Chen AC,Bae WC,Schinagl RM,et al.Depth- and straindependent mechanical and electromechanical properties of fullthickness bovine articular cartilage in confined compression[J].J Biomech,2001,34(1):1-12.
[23] Joshi MD,Suh JK,Marui T,et al.Interspecies variation of compressive biomechanical properties of the meniscus[J].J Biomed Mater Res,1995,29(7):823-828.
[24] Yao H,Justiz MA,Flagler D,et al.Effects of swelling pressure and hydraulic permeability on dynamic compressive behavior of lumbar annulus fibrosus[J].Ann Biomed Eng,2002,30(10):1234-1241.
[25] Wu JZ,Dong RG,Smutz WP,et al.Nonlinear and viscoelastic characteristics of skin under compression: experiment and analysis[J].Bio-Med Mater Eng,2003,13(4):373-385.
[26] Holzapfel GA.Determination of material models for arterial walls from uniaxial extension tests and histological structure[J].J Theor Biol,2006,238(2):290-302.
[27] Steiger HJ,Aaslid R,Keller S,et al.Strength,elasticity and viscoelastic properties of cerebral aneurysms[J].Heart Vessels,1989,5(1):41-46.
[28] Monson KL,Goldsmith W,Barbaro NM,et al.Axial mechanical properties of fresh human cerebral blood vessels[J].J Biomech Eng-Trans ASME,2003,125(2):288-294.
[29] Ozolanta I,Tetere G,Purinya B,et al.Changes in the mechanical properties,biochemical contents and wall structure of the human coronary arteries with age and sex[J].Med Eng Phys, 1998,20(7):523-533.
[30] Almeida-Silveira MI,Lambertz D,Perot C,et al.Changes in stiffness induced by hindlimb suspension in rat Achilles tendon[J].Eur J Appl Physiol Occup Physiol,2000,81(3): 252-257.
[31] Ng COY,Ng GYF,See EKN,et al.Therapeutic ultrasound improves strength of Achilles tendon repair in rats[J].Ultrasound Med Biol,2003,29(10):1501-1506.
[32] Revel GM,Scalise A,Scalise L.Measurement of stressstrain and vibrational properties of tendons[J].Meas Sci Technol,2003,14(8):1427-1436.
[33] Gupte CM,Smith A,Jamieson N,et al.Meniscofemoral ligaments-structural and material properties[J].J Biomech,2002, 35(12):1623-1629.
[34] Yoganandan N,Kumaresan S,Pintar FA.Geometric and mechanical properties of human cervical spine ligaments[J].J Biomech Eng-Trans ASME,2000,122(6):623-629.
[35] Pan L,Zan L,Foster FS.Ultrasonic and viscoelastic properties of skin under transverse mechanical stress in vitro[J].Ultrasound Med Biol,1998,24(7):995-1007.
[36] Eshel H,Lanir Y.Effects of strain level and proteoglycan depletion on preconditioning and viscoelastic responses of rat dorsal skin[J].Ann Biomed Eng,2001,29(2):164-172.
[37] Gentleman E,Lay AN,Dickerson DA,et al.Mechanical characterization of collagen fibers and scaffolds for tissue engineering[J].Biomaterials,2003,24(21):3805-3813.
[38] Legrice IJ,Takayama Y,Covell JW.Transverse shear alongmyocardial cleavage planes provides a mechanism for normal systolic wall thickening[J].CircRes,1995,77(1):182-193.
[39] Margulies SS,Thibault LE,Gennarelli TA.Physical model simulations of brain injury in the primate[J].J Biomech,1990, 23(8):823-&.
[40] Dokos S,LeGrice IJ,Smaill BH,et al.A triaxial-measurement shear-test device for soft biological tissues[J].J Biomech Eng-Trans ASME,2000,122(5):471-478.
[41] Dokos S,Smaill BH,Young AA,et al.Shear properties of passive ventricular myocardium[J]. Am J Physiol-Heart Circul Physio, 2002,283(6):H2650-H2659.
[42] Tanaka E,Hanaoka K,van Eijden T,et al.Dynamic shear properties of the temporomandibular joint disc[J].J Dent Res, 2003,82(3):228-231.
[43] Beer FP,Johnston ER,Dewolf JT.Chapter 2:Torsion[M]// In:Beer FP,Johnston ER,Dewolf JT,editors.Mechanics of Materials.4thed.Singapore:McGraw Hill,2006:132-208.
[44] Zdero R,Olsen M,Elfatori S,et al.Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments[J].J Biomech Eng-Trans ASME,2009, 131(4):7.
[45] Setton LA,Mow VC,Howell DS.Mechanical behavior of articular cartilage in shear is altered by transection of the anterior ligament[J].J Orthop Res,1995,13(4):473-482.
[46] Ruland RT,Hogan CJ,Randall CJ,et al.Biomechanical comparison of ulnar collateral ligament reconstruction techniques[J].Am J Sports Med,2008,36(8):1565-1570.
[47] Harman M,Nguyen X,Sirois E,et al.Three-point bending device for flexure testing of soft tissues[C].35thAnnual Northeast Bioengineering Conference,New York:IEEE,2009.
[48] Nicosia MA.A theoretical framework to analyze bend testing of soft tissue[J].J Biomech Eng-Trans ASME,2007,129(1): 117-120.
[49] Yu QL,Zhou JB,Fung YC.Neutral axis location in bending and Young's modulus of different layers of arterial wall[J].Am J Physiol,1993,265(1):H52-H60.
[50] Xie JP,Zhou JB,Fung YC.Bending of blood vessel wall: stressstrain laws of the intima-media and adventitial layers[J].J Biomech Eng-Trans ASME,1995,117(1):136-145.
[51] Mirnajafi A,Raymer JM,McClure LR,et al.The flexural rigidity of the aortic valve leaflet in the commissural region[J].J Biomech,2006,39(16):2966-2973.
[52] Beer FP,Johnston ER,Dewolf JT.Chapter 3:Pure Bending[M]// In:Beer FP,Johnston ER,Dewolf JT,editors.Mechanics of Materials.4thed.Singapore:McGraw Hill,2006:209-307.
[53] Roy R,Kohles SS,Zaporojan V,et al.Analysis of bending behavior of native and engineered auricular and costal cartilage[J].J Biomed Mater Res Part A, 2004,68A(4):597-602.
[54] Lu Y,Parker KH,Wang W.Effects of osmotic pressure in the extracellular matrix on tissue deformation[J].Philos Trans R Soc A-Math Phys Eng Sci,2006,364(1843):1407-1422.
[55] Bank RA,Soudry M,Maroudas A,et al.The increased swelling and instantaneous deformation of osteoarthritic cartilage is highly correlated with collagen degradation[J].Arthritis Rheum,2000,43(10):2202-2210.
[56] Basser PJ,Schneiderman R,Bank RA,et al.Mechanical properties of the collagen network in human articular cartilage as measured by osmotic stress technique[J].Arch Biochem Biophys,1998,351(2):207-219.
[57] Flahiff CM,Kraus VB,Huebner JL,et al.Cartilage mechanics in the guinea pig model of osteoarthritis studied with an osmotic loading method[J].Osteoarthritis Cartilage,2004,12(5):383-388.[58] Flahiff CM,Narmoneva DA,Huebner JL,et al.Osmotic loading to determine the intrinsic material properties of guinea pig knee cartilage[J].J Biomech,2002,35(9):1285-1290.
[59] Hattori K,Uematsu K,Matsumoto T,et al.Mechanical effects of surgical procedures on osteochondral grafts elucidated by osmotic loading and real-time ultrasound[J].Arthritis Res Ther,2009,11(5):9.
[60] Narmoneva DA,Cheung HS,Wang JY,et al.Altered swelling behavior of femoral cartilage following joint immobilization in a canine model[J].J Orthop Res,2002,20(1):83-91.
[61] Narmoneva DA,Wang JY,Setton LA.Nonuniform swelling-induced residual strains in articular cartilage[J].J Biomech,1999,32(4):401-408.
[62] Narmoneva DA,Wang JY,Setton LA.A noncontacting method for material property determination for articular cartilage from osmotic loading[J].Biophys J,2001,81(6):3066-3076.
[63] Setton LA,Tohyama H,Mow VC.Swelling and curling behaviors of articular cartilage[J].J Biomech Eng-Trans ASME,1998,120(3):355-361.
[64] Tepic S,Macirowski T,Mann RW.Mechanical properties of articular cartilage elucidated by osmotic loading and ultrasound[J].Proc Natl Acad Sci USA,1983,80(11):3331-3333.
[65] Wang Q,Zheng YP,Niu HJ,et al.Extraction of mechanical properties of articular cartilage from osmotic swelling behavior monitored using high frequency ultrasound[J].J Biomech Eng-Trans ASME,2007,129(3):413-422.
[66] 牛海军,王青,郑永平,等.运用四参数三相混合模型和瞬态超声成像技术提取关节软骨的弹性模量[J].科学通报,2007,52(1):41-46.
[67] 牛海军,王青,郑永平,等.基于非匀质4参数三相模型的关节软骨轴向模量估计[J].航天医学与医学工程,2007,20(2): 136-140.
[68] 牛海军,郑永平,王青,等.基于瞬态超声技术的软骨膨胀观测和模量提取[J].生物医学工程学杂志,2008,25(4):822-825.
[69] 王青,郑永平.高频超声对关节软骨消肿与肿胀行为的定量分析[J].中国生物医学工程学报,2006,25(5):571-579.
[70] 王青,郑永平.运用渗透性膨胀和超声显微成像弹性技术研究关节软骨的力学特性[J].中国医疗设备,2011,26(1):13-16, 137.
[71] Mehrabian H,Campbell G,Samani A.A constrained reconstruction technique of hyperelasticity parameters for breast cancer assessment[J].Phys Med Biol,2010,55(24):7489-7508.
[72] Natali AN,Pavan PG,Stecco C.A constitutive model for the mechanical characterization of the plantar fascia[J].Connect Tissue Res,2010,51(5):337-346.
[73] Roan E,Vemaganti K.The nonlinear material properties of liver tissue determined from no-slip uniaxial compression experiments[J].J Biomech Eng-Trans ASME,2007,129(3): 450-456.
[74] O'Hagan JJ,Samani A.Measurement of the hyperelastic properties of 44 pathological ex vivo breast tissue samples[J].Phys Med Biol,2009,54(8):2557-2569.
[75] Huang YP,Zheng YP,Leung SF.Quasi-linear viscoelastic properties of fibrotic neck tissues obtained from ultrasound indentation tests in vivo[J].Clin Biomech,2005,20(2):145-154.
[76] Zheng YP,Mak AFT.Extraction of quasi-linear viscoelastic parameters for lower limb soft tissues from manual indentation experiment[J].J Biomech Eng-Trans ASME,1999,121(3): 330-339.
[77] Bilston LE,Thibault LE.The mechanical properties of the human cervical spinal cord in vitro [J].Ann Biomed Eng,1996,24(1):67-74.
[78] Funk JR,Hall GW,Crandall JR,et al.Linear and quasi-linear viscoelastic characterization of ankle ligaments[J].J Biomech Eng-Trans ASME,2000,122(1):15-22.
[79] Yang W,Fung TC,Chian KS,et al.Viscoelasticity of esophageal tissue and application of a QLV model[J].J Biomech Eng-Trans ASME,2006,128(6):909-916.
[80] Fung YC.Biomechanics:Mechanical Properties of Living Tissues[M]//Fung YC,editor.New York:Springer-Verlag, 1993.
[81] Mow VC,Huiskes R.Basic Orthopaedic Biomechanics and Mechano-Biology[M].3rded. Philadelphia,PA:Lippincott Williams & Wilkins,2005.
[82] Changoor A,Fereydoonzad L,Yaroshinsky A,et al.Effects of refrigeration and freezing on the electromechanical and biomechanical properties of articular cartilage[J].J Biomech Eng-Trans ASME,2010,132(6):6.
[83] Kempson GE,Freeman MAR,Swanson SAV.Tensile properties of articular cartilage[J].Nature,1968,220(5172):1127-1128.
[84] Woo SLY,Akeson WH,Jemmott GF.Measurements of nonhomogeneous,directional mechanical properties of articular cartilage in tension[J].J Biomech,1976,9(12):785-791.
[85] Mow VC,Gu WY,Chen FH.Chapter 5:Structure and function of articular cartilage and meniscus[M]//In:Mow VC,Huiskes R,editors.Basic Orthopaedic Biomechanics and Mechano-Biology.3rded.Philadelphia,PA:Lippincott Williams & Wilkins, 2005:181-258.
[86] Kempson GE,Muir H,Pollard C,et al.Tensile properties of cartilage of human femoral condyles related to content of collagen and glycosaminoglycans[J].Biochim Biophys Acta,1973,297(2):456-472.
[87] Kempson GE,Muir H,Swanson SAV,et al.Correlations between stiffness and chemical constituents of cartilage on human femoral head[J].Biochim Biophys Acta,1970,215(1):70-77.
[88] Akizuki S,Mow VC,Muller F,et al.Tensile properties of human knee joint cartilage:I. Influence of ionic conditions, weight bearing, and fibrillation on the tensile modulus[J].J Orthop Res,1986,4(4):379-392.
[89] Zheng YP,Ding CX,Bai J,et al.Biomechanical assessment of digested AC using ultrasound[J].Med Biol Engi Comput,2001, 39:534-541.
[90] Zheng YP,Niu HJ,Mak AFT,et al.Ultrasonic Measurement of depth-dependent transient behaviors of articular cartilage under compression[J].J Biomech,2005,38(9):1830-1837.
[91] Zheng YP,Bridal SL,Shi J,et al.High resolution ultrasound elastomicroscopy imaging of soft tissues:System development and feasibility[J].Phys Med Biol,2004,49:3925-3938.
[92] Katakai D,Imura M,Ando W,et al.Compressive properties of cartilage-like tissues repaired in vivo with scaffold-free, tissue engineered constructs[J].Clin Biomech,2009,24(1):110-116.
[93] Martin I,Obradovic B,Treppo S,et al.Modulation of the mechanical properties of tissue engineered cartilage[J].Biorheology, 2000,37(1-2):141-147.
[94] Vunjak-Novakovic G,Martin I,Obradovic B,et al.Bioreactor cultivation conditions modulate the composition and mechanical properties of tissue-engineered cartilage[J].J Orthop Res,1999,17(1):130-138.[95] Waldman SD,Grynpas MD,Pilliar RM,et al.Characterization of cartilagenous tissue formed on calcium polyphosphate substrates in vitro[J].J Biomed Mater Res,2002,62(3):323-330.
[96] Yeh WC,Li PC,Jeng YM,et al.Elastic modulus measurements of human liver and correlation with pathology[J].Ultrasound Med Biol,2002,28(4):467-474.
[97] Pai S,Ledoux WR.The compressive mechanical properties of diabetic and non-diabetic plantar soft tissue[J].J Biomech,2010, 43(9):1754-1760.
[98] Krouskop TA,Wheeler TM,Kallel F,et al.Elastic moduli of breast and prostate tissues under compression[J].Ultrason Imaging,1998,20(4):260-274.
Measurement of Soft Tissue Elasticity in Vitro - Common Methods and Applications
HUANG Yan-ping, ZHENG Yong-ping
Department of Health Technology and Informatics, The Hong Kong Polytechnic University, Hong Kong, China
Elasticity is an important characteristic of soft tissue which can be used for establishment of tissue mechanical model, simulation and analysis of biomechanical systems, diagnosis of diseases, and evaluation of new treatment efficacy. From the fundamental knowledge of elastic mechanics and material mechanics, the elasticity of soft tissue can be measured using standard testing methods such as compression, tension, torsion and bending. The advantages of these tests are simple boundary conditions so that intrinsic elastic properties such as Young's modulus, shear modulus or Poisson's ratio can be easily measured. However, because of the requirement of preparation of samples with a regular shape, these tests can be only applied for soft tissue assessment in vitro. With the incorporation of viscoelastic models, these tests can also be used to measure the nonlinear elastic and viscous parameters of soft tissues. Because of easy operation, these tests have been widely used to measure the elastic properties of soft tissues in practice. In this paper, we introduce some common techniques for the measurement of soft tissues elasticity in vitro and discuss the advantages and disadvantages of these techniques and corresponding biomechanical models. Finally we use the mechanical test of articular cartilage in vitro as an example to explain the applications of these methods in fields of biomedical engineering.
elasticity; elasticity measurement; stress; strain; Young's modulus; shear modulus; Poisson's ratio; viscoelasticity; mechanical test; compression; tension; torsion; bending; swelling
R445.1
A
10.3969/j.issn.1674-1633.2011.06.001
1674-1633(2011)06-0001-09
2011-06-12
香港研究资助局(PolyU5354/08E)和香港理工大学(J-BB69)支持。
作者邮箱:ypzheng@ieee.org
