地肤子中总黄酮提取工艺及其抗氧化性研究
2011-07-31张竞怡王文杰卢小龙郭豫梅
张竞怡,王文杰,史 欢,卢小龙,郭豫梅
(陕西理工学院 化学与环境科学学院,陕西 汉中 723001)
地肤(Kochia scoparia),俗名扫帚菜、扫帚苗,属藜科(Chenopodiaceae)一年生草本植物。地肤子为其成熟干燥的果实,其性寒、味甘苦、无毒[1]。地肤子的营养成分非常丰富,含有三萜皂甙、齐墩果酸及油酸、亚油酸等不饱和脂肪酸[2],同时它还有很高的药用价值,具有利小便、清湿热、止痒之功效。外用可治各种皮肤瘙痒、湿疹、干癣、皮肤过敏等。现代研究表明,地肤子主要含三萜皂苷、生物碱、黄酮类和脂肪油等成分,具有降血糖,抗病毒,增强免疫力等功效[3-4]。随着人们对地肤子营养成分和药用价值认识的逐步深入,地肤子越来越受到人们的重视,成为众多学者的研究热点。
目前,对地肤子中皂苷、生物碱、脂肪酸等生物活性成分研究报道的较多,而对地肤子中黄酮类物质研究报道的较少。黄酮类化合物具有抑菌消炎、抗氧化、抗衰老、抗癌防癌等诸多功效[5]。在植物器官中提取总黄酮已有不少报道[6-8],研究地肤子黄酮类物质的提取工艺及抗氧化性,旨在为大量提取、开发黄酮类化合物及综合利用地肤子资源提供依据,同时对从植物原料中提取天然抗氧化剂的研究开发具有一定的指导作用。
1 材料和方法
1.1 材料与仪器
地肤子购于汉中健康大药房。芦丁标准品为中国医药(集团)上海化学试剂公司生产(生化试剂)。无水乙醇、硝酸铝、氢氧化钠、亚硝酸钠、水杨酸试剂以上均为国产分析纯。电热恒温鼓风干燥箱(上海森信实验仪器有限公司)、粉碎机(天津市泰斯特仪器有限公司)、电热恒温水浴锅(北京科伟永兴仪器有限公司)、AL204-IC型电子天平(上海志荣电子科技有限公司)、722E型分光光度计(上海光谱仪器有限公司)、800型离心沉淀器(上海手术器械厂)、SHB-III型台式循环水式多用真空泵(郑州长城科工贸有限公司)和索式提取器(金坛市晶玻实验仪器厂)。
1.2 试验设计与方法
1.2.1 样品处理
将地肤子在50℃恒温干燥箱中烘干,粉碎、石油醚脱脂,风干,得到样品粉末。
1.2.2 总黄酮含量测定
芦丁标准曲线绘制。精确称取经60℃干燥至恒重的芦丁标准品10.0 mg,用60%乙醇溶解定容至50 mL的容量瓶中,配制成0.2 mg·mL-1的芦丁标准溶液。准确吸取0.00,2.00,3.00,4.00,5.00,6.00,7.00,8.00,9.00 mL,分别置于25 mL的容量瓶中,各加30%乙醇溶液至8 mL,再加5%NaNO2溶液0.4 mL,振摇后放置6 min;加10%Al(NO3)3溶液0.4 mL,摇匀后放置6 min;加4%NaOH溶液8 mL,用30%乙醇定容至刻度,放置10 min后,以相应的溶剂做空白,在波长508 nm下测其吸光度[9]。以浓度(X,mg·mL-1)为横坐标,以吸光度(Y)为纵坐标,绘制芦丁浓度-吸光度标准曲线。
总黄酮含量测定。取2 mL提取液,按照1.2.2的NaNO2-Al(NO3)3-NaOH体系络合化学吸光法测定样品溶液的吸光度[10]。从标准曲线中查出总黄酮的浓度,计算总黄酮的提取率。计算公式为:总黄酮提取率/%=总黄酮浓度(mg·mL-1) ×稀释倍数×提取液体积(mL) ×10-3/样品质量 ×100。
1.2.3 地肤子总黄酮提取
单因素试验。精确称取地肤子粉末样品1.000 0 g于150 mL锥形瓶中,按试验要求加入一定量的提取溶剂,在一定的温度下浸提一定时间。抽滤、离心,取样测定,试验乙醇浓度、料液比、温度、提取时间等因素对地肤子总黄酮提取的影响。
正交试验。在单因素试验的基础上,以乙醇浓度(A)、提取时间(B)、温度(C)、料液比(D)为试验因素,以地肤子总黄酮的提取率为试验指标,选用L9(34)正交表确定最佳的提取工艺。1-3水平A分别为60%,70%和80%,B分别为2.0,2.5和3.2 h,C分别为60,70和80℃,D 分别为 1∶70,1∶80 和 1∶90。
1.2.4 地肤子黄酮对羟自由基的清除能力的测定
利用H2O2与Fe2+混合产生羟自由基(-OH),由于-OH具有很高的反应活性,存活时间短,若在该反应体系中加入水杨酸就能有效地捕捉-OH,并产生有色产物,该产物在波长508 nm处有强吸收。若在该反应体系中加入具有清除-OH功能的被测物,则会与水杨酸竞争-OH,从而使有色产物生成量减少[11]。在试管中依次移取 l mmol·L-1硫酸亚铁2.5 mL和3 mmol·L-1双氧水2.5 mL,混合均匀后加入3 mmol·L-1水杨酸7.5 mL,在37℃的恒温水中反应15 min,在722E型分光光度计上于508 nm波长处测其吸光度,即为Y0值。再加入1 mL不同浓度的样品提取液,摇匀,于37℃水浴中反应15 min,测得其吸光度(Yx),用下列公式计算其清除率。清除率/%=(Y0-Yx)/Y0×100。
2 结果与分析
2.1 芦丁标准曲线
按照1.2.2节所设计芦丁浓度梯度进行标准曲线的绘制,结果见图1。得到芦丁浓度X与吸光度Y的回归方程式为:Y=10.418X+0.002 8,R2=0.999 7,表明芦丁浓度在这一范围内线性关系良好。
2.2 单因素试验
2.2.1 乙醇浓度

图1 地肤子总黄酮含量测定的标准曲线
准确称取1.000 0 g地肤子粉末,在料液比1∶60、温度60℃、提取时间2 h的条件下,用不同浓度的乙醇对地肤子进行浸提,结果见图2。

图2 乙醇浓度对总黄酮提取率的影响
由图2可以看出,黄酮的提取率开始随乙醇浓度的增大而增大,当乙醇浓度达到70%时提取率达到最大,以后再增加,黄酮提取率有所下降。可能是由于随着乙醇浓度的增大导致溶液的极性不同,一些脂溶性杂质的浓度增加,影响黄酮类物质的溶出[9]。故进行试验时乙醇浓度最好选 70%左右。
2.2.2 料液比
准确称取1.000 0 g地肤子粉末,在乙醇浓度70%、温度60℃、提取时间2 h的条件下,用不同料液比对地肤子进行浸提,结果见图3。
由图3可以看出,黄酮提取率随料液比增大而增大,当料液比达到1∶80时黄酮提取率最大,以后变化不大。说明黄酮已经基本全部溶出,再增加料液比黄酮提取率不会明显的增加。因此,料液比选为1∶80为宜。
2.2.3 提取时间

图3 料液比对总黄酮提取率的影响
准确称取1.000 0 g地肤子粉末,在乙醇浓度70%、料液比1∶80、温度60℃的条件下,用不同时间对地肤子进行浸提,结果见图4。
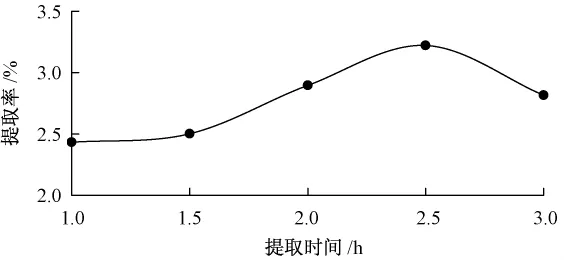
图4 提取时间对总黄酮提取率的影响
从图4可以看出,提取时间在2.5 h左右效果最好,此时黄酮类物质溶出已达到平衡,再延长时间,由于部分乙醇挥发而导致沸点逐渐增大,破坏了一些黄酮化合物,从而使总黄酮的提取率有所下降。
2.2.4 温度
准确称取1.000 0 g地肤子粉末,在乙醇浓度70%、料液比1∶80、提取时间2.5 h的条件下,用不同温度对地肤子进行浸提,结果见图5。

图5 温度对总黄酮提取率的影响
从图5可以看出,40~70℃,黄酮提取率随着温度的升高迅速增大,这是由于温度升高,分子运动加快,渗透、扩散、溶解速率加快,黄酮化合物更易从细胞中溶出[12]。当温度超过70℃以后,黄酮的提取率开始下降。可能是温度过高,黄酮化合物被破坏导致其提取率下降。故地肤子黄酮提取时温度最好控制在70℃左右。
2.3 正交试验结果
地肤子提取总黄酮的正交试验结果见表1。由表1可知,各因素对地肤子总黄酮提取率大小的影响次序为:乙醇浓度>温度>料液比>提取时间。同时还可以看出地肤子中总黄酮提取的最佳工艺为A3C3D2B3,即用80%乙醇为提取剂,在80℃条件下以料液比1∶80提取3 h。
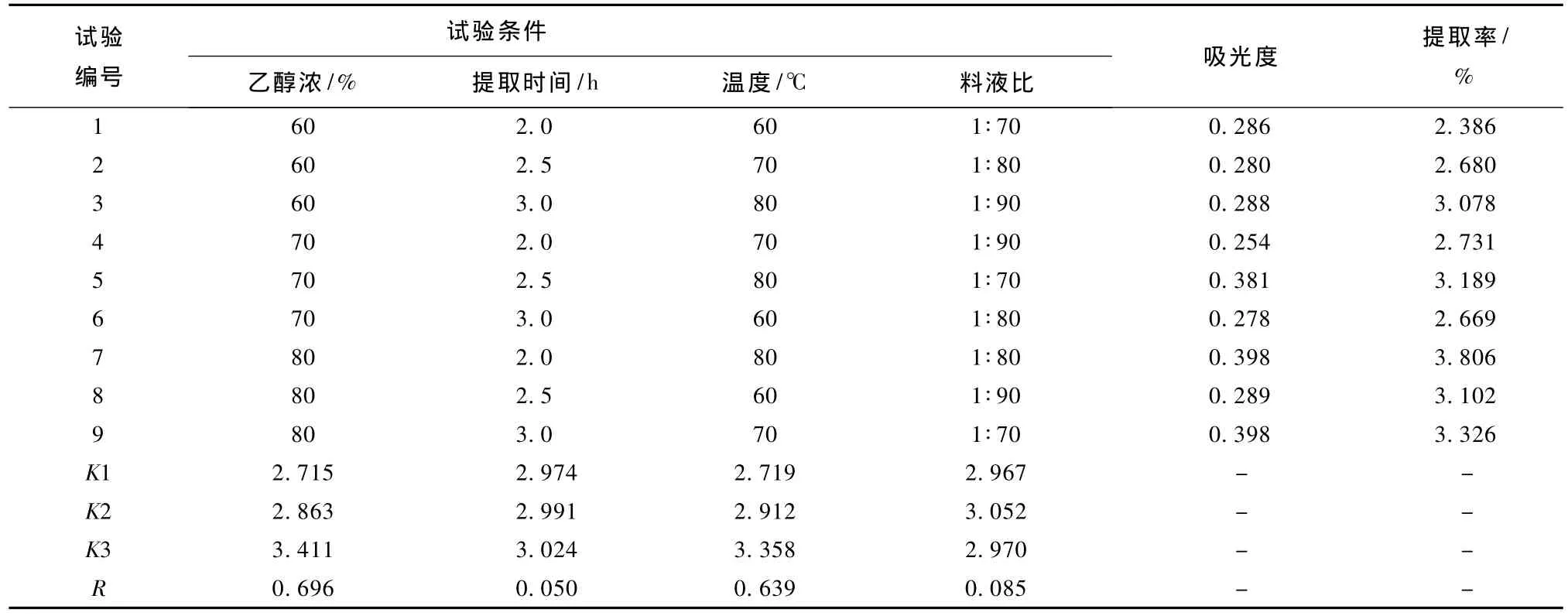
表1 地肤子提取总黄酮的正交试验结果
地肤子黄酮对羟自由基的清除能力见表2。
由表2可以看出,地肤子黄酮对羟自由基有明显的清除作用,随着地肤子黄酮浓度的增加清除作用加强。
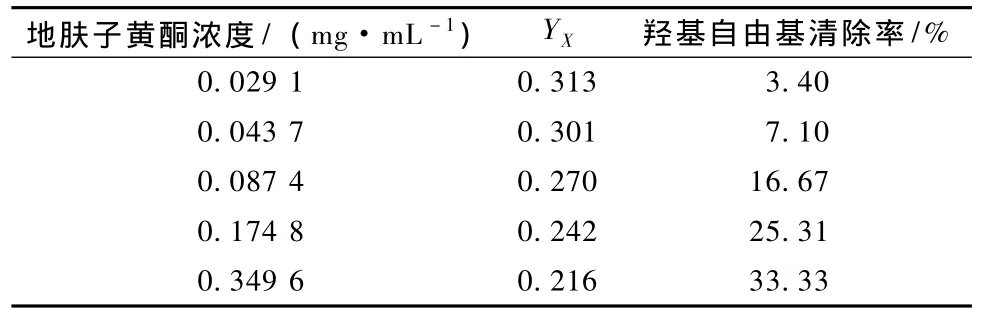
表2 地肤子黄酮对羟自由基的清除能力
3 小结与讨论
通过单因素梯度试验和正交试验,得到从地肤子中提取总黄酮的最佳提取条件组合为乙醇浓度80%、提取温度80℃、料液比1∶80、提取时间3 h。
地肤子总黄酮有较好的羟自由基清除能力。由此可见地肤子黄酮是一种很好的天然抗氧化剂,具有较高的药用价值,值得进一步开发利用。
[1]曹瑞玲,王兴邦,梁莉,等.浅谈地肤的价值与栽培技术[J].中国农业信息,2003(3):33.
[2]路洪顺,王曼.地肤的营养价值和栽培技术[J].中国林副特产,2001(11):39-40.
[3]Kubo M,Mats uda H,Dai Y,et al.Studies on Kochiae Fructus I.Antipruritogenic effect of 70% ethanol extract from Kochiae Fructus and its active component[J].Yakuguku Zasshi,1997,117(4):193 -201.
[4]Matsuda H,Dai Y.Studies on Kochiae Fructus II.Antinociceptive and antiinflmmatory Effects of 70% ethanol extract and its component,momordin Ic from dried fruits of Kochia scoparia L.[J].Biol Pharm Bull,1997,20(10):1086-1091.
[5]唐栩.26种黄酮类天然活性成分的药理研究进展[J].中药材,2003,27(1):46-54.
[6]蒋新龙.广玉兰叶、花总黄酮提取方法与含量比较[J].浙江农业科学,2010(3):648-650.
[7]蒋花.栀子花总黄酮提取与测定[J].浙江农业科学,2009(4):839-841.
[8]徐海菊.南瓜叶总黄酮的提取工艺优化研究[J].浙江农业科学,2009(3):626-628.
[9]莫开菊,柳圣,程超.生姜黄酮的抗氧化活性研究[J].食品科学,2006,27(9):110-115.
[10]王占彬,李元晓,朱世康,等.刺槐种子中黄酮类化合物的提取工艺研究[J].饲料工业,2009,30(14):47-50.
[11]李娟,马占强.茵陈黄酮类化合物体外抗氧化性研究[J].农产品加工,2009(8):74-80.
[12]范媛媛,李新华,刘兰英.绿豆黄酮提取工艺研究沈阳农业大学学报[J].2005,36(5):619-622.
