放射性肝损伤的血清比较蛋白质组学分析*
2011-07-31李晓梅姜玉华张在云孔德晓孙殿水于晓明孙洪强
李晓梅,姜玉华△,张在云,孔德晓,孙殿水,于晓明,孙洪强
(山东大学1第二医院肿瘤防治中心,2生物研究所,山东 济南 250033)
肝细胞肝癌是世界上发病率较高的消化道肿瘤之一,预后差。治疗手段多元化,包括手术、化疗、放疗介入治疗等,但死亡率仍较高,仅次于胃癌、食管癌而居第3位[1]。在肝细胞肝癌的治疗中,放疗发挥了积极的作用。放射性肝损伤是肝癌放射治疗最主要的并发症,不仅严重影响了患者对放射治疗的耐受性,也降低了患者的治疗效果和生存质量,大大限制了放疗的临床应用[2]。近年来,随着三维适形放疗技术的开展,肝细胞肝癌的放射治疗得到了快速发展,但由于大多数患者常常伴有肝硬化等肝脏基础疾病,肝功能差,更易诱发放射性肝损伤,严重者危及患者生命。有关放射性肝损伤的病理、影像学、细胞因子等方面的研究颇多,但有关其可能发生的早期生物学标记研究较少。本研究初步探讨了放射性肝损伤的早期事件,以期为临床尽早发现并干预、制定合理的放疗计划提供指导。
材料和方法
1 材料
采用山东大学医学院动物实验中心提供的健康成年SD大鼠8只,雌雄各半,体重(180±20)g。
所有SD大鼠饲养温度(23±2)℃,照明时间为12 h/d,湿度50%。实验过程中对动物处置符合2006年科学技术部发布的《关于善待实验动物的指导性意见》。
1.1 动物处理和分组 采用高脂低蛋白食物喂养,30%乙醇为唯一饮料,皮下注射CCl4:初次用量5 mL/kg,此后 2.5 mL/kg每3 d 1次,连续6周建立肝硬化模型。之后随机分为对照组(CCl4)和实验组(CCl4+放疗组)。前者未给予放疗,后者给予15 MV X射线半肝照射,单次剂量达15 Gy。在预实验中,照射后 1 h、3 h、5 h、6 h、7 h、8 h 处死大鼠,取受照射肝组织行HE染色,光镜下发现6 h肝脏方开始出现放射性损伤的典型病理变化,即:肝小叶中央静脉闭塞性损伤及邻近肝窦充血、内皮细胞肿胀坏死、肝细胞变性坏死,之前(1 h、3 h、5 h)肝组织只是表现出肝窦充血,未见明显肝细胞及内皮细胞变性坏死;之后(7 h、8 h)肝组织损伤进一步加重,表现为细胞核溶解消失,肝索塌陷,网状纤维减少。有理由确信15 Gy放疗后6 h,血清学变化正是反映肝损伤早期的变化。因此,选择照射后6 h抽取2组大鼠血液。
2 主要试剂及仪器
2.1 主要试剂 固相pH梯度干胶条(immobilized pH gradient strips,IPG strips)、十二烷基磺酸钠、二硫苏糖醇、三羟甲基胺基甲烷、溴酚蓝、过硫酸胺、甘氨酸、丙烯酰胺、IPG-缓冲液(pH:3~10)、覆盖液、琼脂糖、尿素、标准蛋白、三氟乙酸均购自Amersham Pharmacia Biotech;N,N'-甲叉双丙烯酰胺、α-氰基-4-羟基肉桂酸、胰岛素和3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸均购自Sigma;碘乙酰胺购自ACROS;胰蛋白酶和CompleteTM蛋白酶抑制剂购自Roche;去除血清高丰度蛋白试剂盒(Aurum Serum Protein Mini Kit)和蛋白银染试剂盒购自Bio-Rad;Ⅰ抗(兔抗人乙酰肝素酶多克隆抗体和肝细胞生长因子受体多克隆抗体)购自北京博奥森生物技术公司;鼠抗β-actin单克隆抗体购自Sigma;生物素标记的Ⅱ抗和DAB酶底物显色试剂盒购自北京中山金桥生物技术公司;化学发光(ECL)检测试剂盒购自Vigorous;BCA蛋白定量试剂盒购自Pierce。其余均为国产试剂。
2.2 主要仪器 IPGphor等电聚焦电泳仪、ImageMaster 2D Elite 4.01凝胶图像分析软件、ImageScanner扫描仪、LabScan扫描控制软件均购自瑞典Amersham Biosciences;PROTEANⅡxi Cell垂直电泳仪和自动取点仪购自Bio-Rad;基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF-MS)购自德国Bruker。
3 方法
3.1 蛋白样品的制备 每组大鼠取2 mL自凝血,室温静置2 h。3500 r/min离心5 min,取上清,混合后分装,-80℃冻存备用。然后按Aurmm Serum Protein Mini Kit操作手册去除高丰度蛋白以获取低丰度蛋白的洗脱液。按1∶3将洗脱液与-20℃预冷的丙酮混合,-20℃孵育过夜,10000×g 4℃离心5 min,沉淀用冷丙酮洗2次,室温晾干。加入水化上样液500 μL,使沉淀中的蛋白充分溶解,10000×g 4℃离心5 min,取上清液进行BCA蛋白定量。
3.2 双向凝胶电泳 参考Görg等[3]的方法和IPGphor等电聚焦系统操作指南进行双向凝胶电泳。取相同的样品3份,每份上样总体积为370 μL,同时在20℃自动进行18 cm IPG干胶条水化和聚焦,其中于30 V低电压水化8 h,60 V电压水化8 h然后经过500 V 1 h、1000 V 1 h,8000 V 10 h下进行等电聚焦。等电聚焦结束后,将胶条进行两步平衡后在PROTEANⅡxi Cell垂直电泳仪上进行SDS-PAGE电泳。然后按蛋白质银染试剂盒的操作要求[4]对2-DE胶进行银染作为平行胶,用于差异反应蛋白质点的鉴定。为了减少误差,每份蛋白样品重复电泳3次。
3.3 图谱分析 染色后的凝胶用ImageScaner扫描仪及Lab-Scan软件扫描,所得图谱以ImageMaster 2D 5.0 Platinum软件包进行图像分析,比较蛋白斑点的差异。
3.4 胶内酶解及MALDI-TOF/TOF分析 将图像分析得到的差异蛋白点酶解后从胶上切下,制备样品[5]后进行质谱分析。
3.5 MALDI-TOF/TOF分析及数据库查询 应用Mascot数据库,物种Homo sapiens,PI范围3~10,每个肽允许1个漏切位点,碘乙酰胺、半胱氨酸修饰和甲硫氨酸氧化修饰设置为可变修饰,肽段误差±0.1 Da。蛋白质匹配分数大于57分,置信水平在95%以上。
3.6 Western blotting法验证血清中乙酰肝素酶和肝细胞生长因子受体的表达水平 蛋白定量后,将等量(50 μg)蛋白变性,按以下步骤操作:SDS聚丙烯酰胺凝胶电泳,转膜,室温封存 3 h,加入Ⅰ抗(1∶1000),洗膜,加入Ⅱ抗(1∶3000),室温孵育1 h,洗膜,ECL试剂盒检测,X线片曝光、显影、定影、冲洗,扫描分析。
4 统计学处理
采用SPSS 16.0统计软件进行统计学分析。数据以均数±标准差()表示,均数比较采用t检验。
结 果
1 对照组(CCl4)和实验组(CCl4+放疗组)差异蛋白质的鉴定
应用双向凝胶电泳技术,筛选出33个明显差异表达的蛋白点,其中12个蛋白质鉴定成功。实验组较对照组相比,蛋白表达上调5个,下调7个。乙酰肝素酶和肝细胞生长因子受体分别位于第1和第9蛋白位点,见表1、图1。

表1 12个差异蛋白质分析Table 1.Analysis of twelve differentially expressed proteins

Figure 1.Identification of differentially expressed proteins in the two groups.图1 对照组和实验组差异蛋白质的鉴定
2 Western blotting验证乙酰肝素酶和肝细胞生长因子受体的表达
从图2可以看出,实验组和对照组相比,乙酰肝素酶表达上调,量化分析显示10.13±0.09 vs 18.27±0.23,(P<0.05);从图3可以看出,实验组和对照组相比,肝细胞生长因子受体表达下调,量化分析显示10.52±0.07 vs 1.15±0.03(P<0.01)。
讨 论
放射性肝损伤,又称放射性肝病(radiation-induced liver disease,RILD),是放射治疗肝细胞肝癌严重的并发症,是放疗疗效主要限制因素之一。其发生的可能机制是电离辐射引起肝内效应细胞产生释放多种促纤维生长因子,启动成纤维细胞的增殖分裂,导致大量胶原蛋白合成,最终形成肝内胶原沉积,血管壁增厚、闭合[6]。肝脏是晚反应组织,严重的急性放射性肝损伤会发展为亚急性放射性肝损伤,一旦发生即呈进行性演进,最终导致肝功能衰竭。因此早期诊断并对其进行可能的干预对改善患者的预后至关重要。
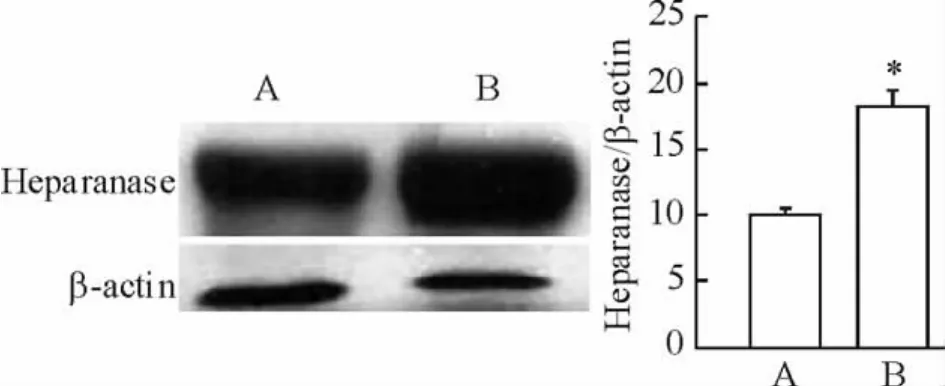
Figure 2.Comparison of heparanase expression between the two groups.A:CCl4group;B:CCl4+radiation group..n=4.*P <0.05 vs CCl4group.图2 2组血清肝素酶表达的比较

Figure 3. Comparison of hepatocyte growth factor receptor(HGFR)expression between the two groups A:CCl4group;B:CCl4+radiation group..n=4.**P <0.01 vs CCl4group.图3 2组血清肝细胞生长因子受体表达的比较
蛋白质组学研究已经成为当今生命科学的重点之一。它与血清学研究相结合,产生了血清蛋白质组学,可以全面、动态地分析患者血清样品中蛋白质种类及数量的改变,从而发现大量有对疾病诊断、疗效监测有价值的蛋白[7]。
国内外大量研究已经应用蛋白质组学技术发现了肝组织放疗前后蛋白质的变化。Lin等[8]发现放疗后发生改变的蛋白质主要与能量代谢、抗氧化反应、氨基酸与蛋白质代谢、骨架蛋白等有关。Park等[9]研究表明,放疗引起改变的蛋白质主要参与了氧化还原反应、细胞因子调节、信号转导、蛋白质合成与降解。我们的研究结果与此相似,并对其中的肝素酶和肝细胞生长因子受体做了验证。
乙酰肝素酶(heparanase,HPA)是一种葡萄糖醛酸酯酶,为迄今发现唯一作用于细胞外基质多聚糖的内切酶。在正常组织细胞中,乙酰肝素酶主要分布于胎盘、脾脏、血小板以及中性粒细胞、单核细胞、活化T/B淋巴细胞内,心脏、脑、肺、肝、骨骼肌、肾脏以及胰脏中不表达。它能够水解硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycans,HSPGs)的硫酸乙酰肝素侧链,破坏细胞外基质(extracellular matrix,ECM)和基底膜(basement membrane,BM)的基本结构,释放并激活连接在硫酸乙酰肝素侧链上的活性物质,与肿瘤侵袭转移、炎症反应、血管生成、组织重建等病理过程密切相关[10-11]。因此,我们推测,当肝脏发生放射性损伤时,乙酰肝素酶表达增加,通过降解HSPGs,使其所结合并保护的蛋白裸露而易于溶解,从而协同结构蛋白水解酶破坏、改变细胞ECM及BM结构,使得局部炎症浸润,并大量释放入血。本研究中乙酰肝素酶表达上调表明它可能在炎症反应及组织重建中发挥了一定的作用。众多研究已证实放疗后肝组织的病理学表现为炎症细胞浸润及肝纤维化形成[12-13]。
肝细胞生长因子(hepatocyte growth factor,HGF)最早是从部分肝切除的大鼠血清中分离得到的,是1种多功能的细胞因子,具有重要的抗纤维化作用,可能途径有:(1)通过抑制星状细胞活化,减少ECM过度产生;(2)通过抑制PI3K/Akt途径,抑制血管内皮细胞及肝细胞凋亡;(3)增加金属基质蛋白酶9(matrix metalloproteinase-9,MMP-9)的表达,减少金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMP)的产生[14]。其抗纤维化的分子机制是与其受体(hepatocyte growth factor receptor,HGFR/c-Met)结合后激活该受体的酪氨酸激酶活性发生信号转导,引起肝细胞、上皮细胞、内皮细胞等多种细胞的生长、迁移和形态变化,促进肝、肺、肾、脑等重要组织器官损伤后修复。陆海英等[15]研究发现HGF/c-Met介导的MAPK信号通路在抗肾脏纤维化中发挥了重要作用。我们的研究发现肝细胞生长因子受体表达下调,提示其可能减少了肝细胞再生与修复,促进了放射性损伤后的肝纤维化。
综上所述,乙酰肝素酶和肝细胞生长因子受体可能作为预测及监控放射性肝损伤的早期指标,二者的敏感性和特异性还有待于进一步研究。
[1]Robers LR.Sorafenib in liver canner:just the beginning[J].N Engl J Med,2008,359(23):420-422.
[2]Kim TH,Kim DY,Park JW,et al.Three-dimensional conformal radiotherapy of unresectable epatocellular carcinoma patients for whom transcatheter arterial chemoembolization was ineffective or unsuitable[J].Am J Clin Oncol,2006,29(6):568-575.
[3]Görg A,Obermaier C,Boguth G,et al.The current state of two-dimensional electrophoresis with immobilized pH gradients[J].Electrophoresis,2000,21(6):1037-1053.
[4]Zhu YF,Cui YG,Guo XJ,et al.Proteomic analysis of effect of hyperthermia on spermatogenesis in adult male mice[J].J Proteome Res,2006,5(9):2217-2225.
[5]Li C,Chen Z,Xiao Z,et al.Comparative proteomics analysis of human lung squamous carcinoma[J].Biochem Biophys Res Commun,2003,309(1):253-260.
[6]Stryker JA.Sciene to practice:why is the liver a radiosensitive organ?[J].Radiology,2007,242(1):1-2.
[7]Sheng KH,Yao YC,Chuang SS,et al.Search for the tumor-related proteins of transition cell carcinoma in Taiwan by proteomic analysis[J].Proteomics,2006,6(3):1058-1065.
[8]Lin RX,Zhao HB,Li CR,et al.Proteomic analysis of ionizing radiation-induced proteins at the subcellular level[J].J Proteome Res,2009,8(1):390-399.
[9]Park EC,Yoon JB,Seong JS,et al.Effect of ionizing radiation on rat tissue:proteomic and biochemical analysis[J].Prep Biochem Biotechnol,2006,36(1):19-35.
[10]LI JP.Heparin,heparan sulfate and heparanase in cancer:remedy for metastasis[J].Anticancer Agents Med Chem,2008,8(1):64-76.
[11]吴建秋,景在平.乙酰肝素酶-细胞与基质间相互作用的新型调节剂[J].中国病理生理杂志,2002,18(5):580-583.
[12]Vlodavsky I,Ilan N,Naggi A,et a1.Heparanase:structure,biological functions,and inhibition by heparin-derived mimetics of heparan sulfate[J].Curr Pharm Des,2007,13(20):2057-2073.
[13]Simizu S,Suzuki T,Muroi M,et al.Involvement of disulfide bond formation in the activation of heparanase[J].Cancer Res,2007,67(10):7841-7849.
[14]Maulik G,Shrikhande A,Kijima T,et al.Role of the hepatocyte growth factor receptor,c-Met,in oncogenesis and potential for therapeutic inhibition[J].Cytokine Growth Factor Rev,2002,13(1):41-59.
[15]陆海英,刘克剑,张 悦,等.中药抗纤灵方含药血清对TGF-β1刺激的 HK-2细胞 c-Met及其下游MAPK信号分子的调控作用[J].中国病理生理杂志,2010,26(1):154-157.
