人参皂苷Rg1对局灶性脑缺血再灌注大鼠脑组织NOS活性及蛋白表达的影响*
2011-07-31王巧云吴峰阶
王巧云,吴峰阶
(1滨州医学院基础学院,山东 烟台 264003;2滨州医学院临床学院,山东 滨州 256603)
脑缺血再灌注损伤是一复杂的病理生理过程,有多种因素参与。研究表明,一氧化氮(nitric oxide,NO)在其中发挥正负双重作用,一氧化氮合酶(nitric oxide synthase,NOS)是NO生物合成的限速酶,其类型与NO作用密切相关[1]。人参皂苷Rg1(ginsenoside Rg1)是人参的主要提取物之一,也是临床应用的主要药理活性成分,具有抗氧化、抗衰老、减轻神经功能损伤的作用,且作为复方制剂的主要成分之一已用于治疗脑血管疾病[2-3]。进一步研究发现人参皂苷Rg1能够抑制NOS活性,对放射性脑损伤具有保护作用[4]。人参皂苷Rg1是否亦通过影响NOS对缺血再灌注损伤脑有保护作用尚未见报道。本实验采用大鼠局灶性脑缺血再灌注模型,研究人参皂苷Rg1对缺血再灌注损伤大鼠脑组织中NO含量以及NOS、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)活性的影响,探讨其作用的可能机制。
材料和方法
1 材料
1.1 动物 SD大鼠(由山东大学动物中心提供,动物合格证号为SCXK鲁20030004),体重(270±30)g,雌雄不拘。
1.2 药品与试剂 人参皂苷Rg1(南京泽朗医药科技有限公司),nNOS和 iNOS抗体(Cell Signaling Technology);BCA蛋白试剂盒(Bio-Rad);ECL化学发光检测试剂盒(北京康为世纪生物科技有限公司);所有Ⅱ抗、Ⅲ抗均购自北京中衫金桥生物技术有限公司;测定NO、NOS和iNOS试剂盒(南京建成生物工程研究所)。
1.3 仪器 CM1850恒冷箱冰冻切片机(Leica);TG16MW-台式离心机(赫西仪器);Max M5酶标仪(Molecular Devices);凝胶成像仪(Bio-Rad)。
2 方法
2.1 分组与用药 将大鼠随机分成5组:(1)假手术组(sham);(2)脑缺血再灌注模型组(cerebral ischemia referfusion,I/R);(3)人参皂苷 Rg1防治组(10 mg/kg、20 mg/kg及40 mg/kg)。各组动物均腹腔注射等容积药物,1次/d,连续7 d,末次给药后30 min依法制备脑缺血再灌注模型。假手术组和模型组腹腔注射等容积生理盐水。
2.2 局灶性脑缺血再灌注模型制备 健康成年SD大鼠,参照Longa等[5]建立的大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型。以10%水合氯醛400 mg/kg腹腔注射麻醉后,颈纵向切口,分离右侧颈总动脉(common carotid artery,CCA),颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA)。在 ECA发出约 0.8 cm处结扎,于CCA近心端夹一动脉夹,在ECA结扎处与分叉处之间做一直径约2 mm的“V”形切口,将尼龙线(内径为0.26 mm,顶端制成直径为0.34 mm的光滑圆球)自切口处经颈内、颈外动脉分叉部进入颈内动脉,插入深度约(18.5±0.5)mm至微感阻力,使尼龙线头端通过MCA起始处,到达较细的大脑前动脉,此时即实现右侧大脑中动脉的血流阻塞,结扎ICA以固定尼龙线和防止出血,逐层缝合。缺血2 h,拔出尼龙线至CCA,再灌注24 h。术中术后室温控制在23~25℃,以电热毯保暖以保持大鼠直肠体温在(37±0.5)℃。
假手术组仅把尼龙线插入CCA中1~2 cm,不达到大脑中动脉位置。
2.3 神经功能评分 动物苏醒后,放回鼠笼,自由饮食,脑缺血再灌注后4 h及24 h,由1名不了解分组情况的观察者评估记录神经功能障碍评分。评分标准采用Longa's法[5]:0分,无功能障碍;1分,不能伸展左侧前肢;2分,向左侧旋转;3分,向左侧倾倒;4分,无自主活动伴意识抑制;5级,死亡。取4 h评分为1~3分大鼠用于实验。
2.4 病理标本收集 完成神经功能障碍评分后,以10%水合氯醛400 mg/kg腹腔注射麻醉,依次剪开皮肤,胸腔,充分暴露心脏,剪开左侧心尖部,以灌注针朝主动脉方向插入,止血钳夹闭,于右心耳下部剪开右心房,缓慢推注生理盐水100 mL,至流出液变清,换用4%多聚甲醛PBS液继续缓慢推注200 mL,至动物全身僵硬,肝脏发白为止,然后断头取脑,用刀片切去前部端脑和后部小脑,放入10%甲醛继续固定,石蜡包埋,在海马区做5 μm脑切片,尼氏染色。
2.5 NO、NOS及iNOS测定 MCAO后24 h,精确切取大脑中动脉支配的区域,称重,按脑组织与生理盐水的质量体积比为1∶9匀浆,离心后取上清液,测定NO、NOS及iNOS。NO以硝酸还原酶法测定;iNOS、NOS应用比色法测定。操作按说明书进行。
2.6 Western blotting检测nNOS和iNOS的表达MCAO后24 h,取海马冻存于液氮中备用。各组动物冻存的标本取0.1 g,加入裂解缓冲液约0.3 mL,用玻璃匀浆器匀浆,冰上裂解30 min;12000 r/min 4℃离心20 min;收集上清。取少量上清以BCA法定蛋白浓度,调整蛋白含量为 50 μg/30 μL,后加入loading buffer,煮沸10 min,冷却分装,置于低温冰箱保存,2周内使用。按实验室常规上样、电泳、转膜后,加入5%TBST-BSA中37℃封闭2 h。加入Ⅰ抗(iNOS和nNOS,稀释度为1∶1000)37℃摇床孵育2 h,0.1%TBS-T洗膜,10 min/次×3;Ⅱ抗(生物素标记的山羊抗兔或马抗小鼠IgG,稀释度为1∶1000)37℃摇床孵育0.5 h,0.1%TBS-T洗膜10 min/次 ×3;Ⅲ抗(辣根酶标记链霉卵白素,稀释度1∶1000),加入ECL免疫印迹检测试剂,以 ECL成像系统 (Fujiflm LAS-3000)拍照,以Quantity One凝胶分析系统进行灰度分析,并与内参照(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)比较,进行半定量。
3 统计学处理
结 果
1 人参皂苷Rg1对大鼠脑缺血再灌注损伤后神经功能障碍评分和锥体细胞存活的影响
如表1所示,神经功能障碍评分,模型组与假手术组相比明显增高(P<0.01);预先给予人参皂苷Rg1后,神经障碍评分明显降低,与模型组比较有显著差异(P<0.05,P<0.01)。尼氏染色结果显示,假手术组海马CA1区有3~4层锥体细胞,排列整齐、紧密,高倍镜下细胞核大而圆,有1~2个核仁。脑组织缺血损伤后,海马区神经细胞受损严重,CA1区失去正常结构,细胞排列散乱,细胞数量减少。部分神经元皱缩,核固缩、深染,呈三角形、长条形、梭形或不规则形,核染色质聚集,核仁不清晰,见图1。定量结果显示,人参皂苷Rg1(20 mg/kg、40 mg/kg)能够改善缺血神经细胞形态,减少神经细胞的丢失,与溶剂组相比具有显著差异(P<0.05),提示其对急性缺血再灌注损伤大脑具有保护作用,见表2。

表1 人参皂苷Rg1对大鼠脑缺血再灌注损伤后神经功能障碍评分的影响Table 1.The effect of ginsenoside Rg1 on neurological deficit scores in rats with cerebral ischemia/reperfusion injury(n=8)

Figure 1.The effects of Ginsenoside Rg1 on pyramidal neurons of hippocampus CA1 area in rats with cerebral ischemia/reperfusion injury(Nissel staining,× 400).A:sham group;B:I/R group;C:ginsenoside Rg110 mg/kg group;D:ginsenoside Rg120 mg/kg group;E:ginsenoside Rg140 mg/kg group.图1 人参皂苷Rg1对海马CA1区锥体细胞存活数的影响
表2 人参皂苷Rg1对脑缺血再灌注损伤后大鼠海马CA1区锥体细胞存活数的影响Table 2.The effects of ginsenoside Rg1 on pyramidal cells of hippocampus CA1 area in rats with cerebral ischemia/reperfusion injury(.n=8)
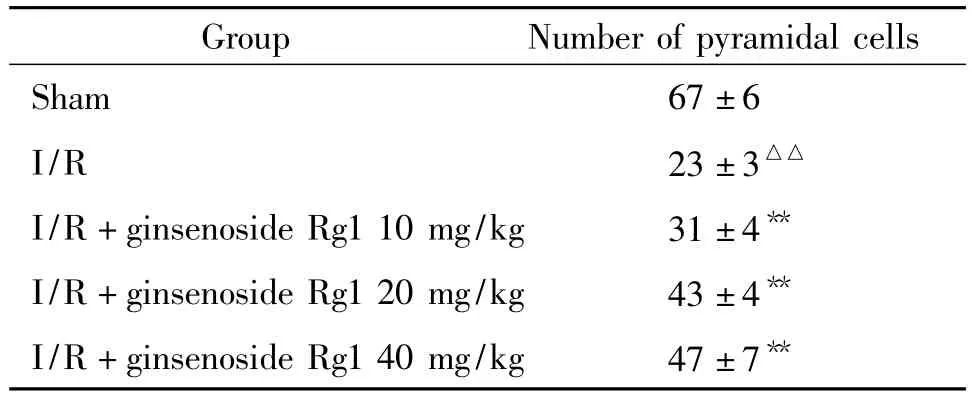
表2 人参皂苷Rg1对脑缺血再灌注损伤后大鼠海马CA1区锥体细胞存活数的影响Table 2.The effects of ginsenoside Rg1 on pyramidal cells of hippocampus CA1 area in rats with cerebral ischemia/reperfusion injury(.n=8)
△△P <0.01 vs sham;**P <0.01 vs I/R.
Group Number of pyramidal cells Sham 67±6 I/R 23 ±3△△I/R+ginsenoside Rg110 mg/kg 31 ±4**I/R+ginsenoside Rg120 mg/kg 43 ±4**I/R+ginsenoside Rg140 mg/kg 47±7**
2 人参皂苷Rg1对大鼠脑缺血再灌注损伤后脑组织NO含量及NOS、iNOS活性的影响
如表3所示,模型组大鼠MCAO缺血再灌注后,NO含量及NOS、iNOS活性高于对照组(P<0.01);经人参皂苷Rg1预处理后,NO含量及NOS、iNOS活性有不同程度下降,与模型组比较显著差异(P<0.05,P <0.01)。
3 人参皂苷Rg1对大鼠脑缺血再灌注损伤后海马区iNOS及nNOS的影响
如图2免疫印迹结果所示,假手术组大鼠海马nNOS和iNOS蛋白表达较低。模型组大鼠nNOS和iNOS含量增高;人参皂苷Rg120、40 mg/kg组nNOS和iNOS蛋白含量显著降低,与模型组比较显著差异(P<0.05,P<0.01)。以GAPDH为内标,对 nNOS和iNOS的表达进行量化,可以直观地看出人参皂苷Rg1对以上蛋白表达的抑制作用,见表4。
表3 人参皂苷Rg1对大鼠脑缺血再灌注损伤后脑组织NO含量及NOS、iNOS活性的影响Table 3.The effects of ginsenoside Rg1 on the level of NO and the activity of NOS and iNOS in rats with cerebral ischemia-reperfusion injury(.n=6)

表3 人参皂苷Rg1对大鼠脑缺血再灌注损伤后脑组织NO含量及NOS、iNOS活性的影响Table 3.The effects of ginsenoside Rg1 on the level of NO and the activity of NOS and iNOS in rats with cerebral ischemia-reperfusion injury(.n=6)
△△P <0.01 vs sham;*P <0.05,**P <0.01 vs I/R.
Group NO(mmol/g protein) NOS(103U/g protein) iNOS(103U/g protein)Sham 2.14±0.16 1.68±0.19 0.26±0.03 I/R 4.89±0.28△△ 3.02±1.02△△ 1.97±0.14△△I/R+ginsenoside Rg110 mg/kg 3.85±0.22* 2.65±0.55 1.62±0.09*I/R+ginsenoside Rg120 mg/kg 3.50±0.21* 2.31±0.13* 1.44±0.12*I/R+ginsenoside Rg140 mg/kg 3.02±0.24** 2.01±0.15** 1.19±0.11**

Figure 2.The effects of ginsenoside Rg1 on protein expression of NOS induced by cerebral ischemia-reperfusion injury detected with Western blotting.A:sham group;B:I/R group;C:ginsenoside Rg110 mg/kg group:D:I/R+ginsenoside Rg120 mg/kg group;E:I/R+ginsenoside Rg140 mg/kg group.图2 人参皂苷Rg1对海马组织中nNOS和iNOS表达的影响
表4 人参皂苷Rg1对大鼠脑缺血侧海马组织中nNOS和iNOS表达的影响Table 4.The effects of ginsenoside Rg1 on the expression of nNOS and iNOS induced by cerebral ischemia-reperfusion injury(.n=6)
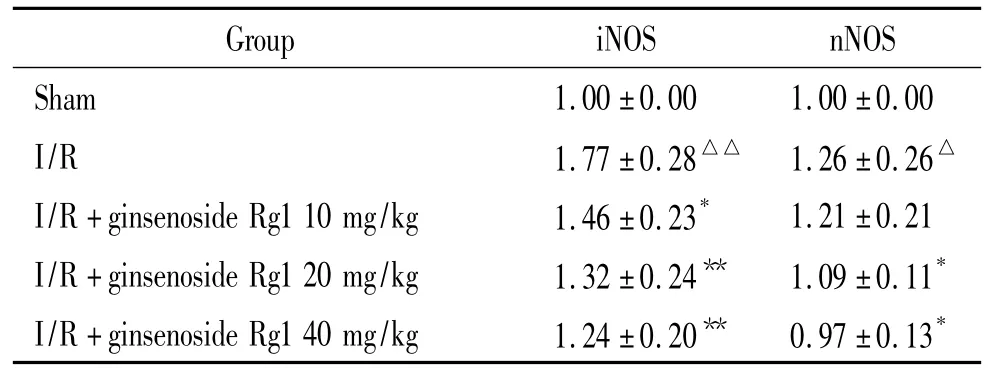
表4 人参皂苷Rg1对大鼠脑缺血侧海马组织中nNOS和iNOS表达的影响Table 4.The effects of ginsenoside Rg1 on the expression of nNOS and iNOS induced by cerebral ischemia-reperfusion injury(.n=6)
△P <0.05,△△P <0.01 vs sham;*P<0.05,**P <0.01 vs I/R.
Group iNOS nNOS Sham 1.00±0.00 1.00±0.00 I/R 1.77±0.28△△ 1.26±0.26△I/R+ginsenoside Rg110 mg/kg 1.46±0.23* 1.21±0.21 I/R+ginsenoside Rg120 mg/kg 1.32 ±0.24** 1.09 ±0.11*I/R+ginsenoside Rg140 mg/kg 1.24 ±0.20** 0.97 ±0.13*
讨 论
NOS是合成NO的关键酶,目前已经确定的有3种亚型:第1种是神经元型(nNOS),第2种为内皮型(eNOS),二者属结构型(cNOS),在生理状态下即有表达。它们的激活均依赖于钙离子和钙调蛋白的作用。其中,由eNOS产生的NO主要通过扩张血管,增加脑血流量起到保护作用;nNOS来源的NO在缺血早期产生神经毒作用,但nNOS半衰期短,产生的NO量少,对神经系统的毒性作用相对较小。第3种为诱导型(iNOS),在生理条件几乎不存在或水平极低,其表达为非钙依赖性,可由炎症因子、内毒素等诱导激活,iNOS作用时间长,可催化生成大量NO[6]。过量合成的NO可通过介导兴奋性氨基酸的毒性、生成大量氧自由基、引起钙超载、损伤线粒体、直接损伤DNA及诱导细胞凋亡等加重缺血脑损伤[7]。因此,iNOS被认为是一种“病理型”的酶。
近年研究表明,在脑缺血再灌注损伤过程中,NOS是决定NO发挥损伤或保护双重作用的关键。脑缺血后NOS活性在缺血各时期均有增高,但在缺血损伤的不同阶段,不同类型的NOS发挥不同的功能作用。脑梗死超早期(<2 h),eNOS活性升高,产生NO在局部扩张脑血管,增加脑血流,发挥脑保护作用,但超过2 h则作用消失。脑梗死早期(2~6 h),nNOS产生大量 NO发挥毒性作用,当脑梗死晚期(>6 h),iNOS产生的 NO可加剧谷氨酸毒性,导致迟发性神经元损伤[8],尤其 iNOS与钙调蛋白结合紧密,产生大量的NO,更加剧了迟发性神经元死亡。据刘巍等[9]报道,脑缺血再灌注损伤时,cNOS在缺血再灌注早期被诱导表达,其活力在再灌注6 h后达到高峰,再灌注9 h,cNOS迅速下降,到再灌注24 h,保持在较低水平。而在这个时刻,iNOS迅速达到高峰,并在此后一直到24 h都保持较高水平表达,同时高水平的iNOS导致脑梗死体积增加。
本实验结果显示,脑缺血再灌注损伤后,模型组大鼠脑组织中NO含量、NOS及iNOS活性均明显上升,提示NO的增加可能来源于nNOS和iNOS的活性增高,而升高的 NO与 NMDA受体结合使大量Ca2+通道开放,胞浆内Ca2+明显升高,引起细胞内钙超载,促发损伤级联反应。随着缺血再灌注损伤的发展和炎症细胞的浸润,以及肿瘤坏死因子α、白细胞介素1β等细胞因子表达增加,可诱导 iNOS产生增多,从而介导神经毒性作用,导致神经元进一步损伤[10]。
本研究表明,人参皂苷Rg1能够抑制损伤脑组织中总NOS的活性,抑制NO的过量产生,从而降低脑缺血再灌注损伤后的神经功能障碍评分,增加海马CA1区锥体细胞存活数,对脑缺血细胞起到保护作用。其可能作用机制是通过抑制体内总NOS活性,尤其是再灌注损伤后高表达的iNOS活性,从而减少NO的过量生成实现的。同时,高剂量治疗组的疗效明显优于低剂量治疗组。
[1]Moro MA,Cárdenas A,Hurtado O,et al.Role of nitric oxide after brain ischemia[J].Cell Calcium,2004,36(3-4):265-275.
[2]张均田.人参研究的最新进展[J].江苏大学学报:医学版,2009,19(3):185-189.
[3]胡霞敏,严常开,胡先敏,等.人参皂甙Rg1对脑缺血再灌注损伤大鼠脑线粒体功能的影响[J].中国新药杂志,2006,15(7):514-517.
[4]陈 勇,孙爱民,陈智贤,等.人参皂苷Rg1对NOS的调控在海马神经元放射性损伤防护中的意义[J].南方医科大学学报,2010,30(7):1522-1525.
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle artery occusion without craniectomy in rats [J].Stroke,1989,20(1):84-91.
[6]Bredt DS,Snyder SH.Nitric oxide mediates glutamatelinked enhancement of cGMP levels in the cerebellum[J].Proc Natl Acad Sci USA ,1989,86(22):9030-9033.
[7]谢集建,杨 勇,陈宝芳.缺氧缺血性脑损伤的发病机制研究进展[J].国外医学:妇幼保健分册,2002,13(1):30-32.
[8]Kawase M,Kinouchi H,Kato I,et al.Inducible nitric oxide synthase following hypoxia in rat cultured glial cells[J].Brain Res,1996,738(2):319-322.
[9]刘 巍,王晶晶,闫 明,等.一氧化氮合酶在大鼠脑缺血再灌注损伤后时间-量的变化[J].中国比较医学杂志,2007,17(9):539-543,560.
[10]Anctil M,Poulain I,Pelletier C.Nitric oxide modulates peristaltic muscle activity associated with fluid circulation in the sea pansy Renilla koellikeri[J].J Exp Biol,2005,208(Pt 10):2005-2017.
