shRNA沉默ROCK1和ROCK2表达对缺氧诱导的大鼠心肌细胞凋亡的影响*
2011-07-31孙国芳李菊香董家龙吴清华程晓曙
孙国芳,丁 浩,李菊香,洪 葵,董家龙,吴清华,程晓曙
(南昌大学第二附属医院心内科,江西省分子医学重点实验室,江西 南昌 330006)
Rho相关的卷曲蛋白激酶(Rho-associated coiled-coil protein kinase,ROCK)是一种具有丝氨酸/苏氨酸蛋白激酶活性并与细胞凋亡相关的Rho结合蛋白[1]。ROCK有2个亚型,ROCK1 和ROCK2,由 2 种不同的基因编码[2]。ROCK1 和ROCK2分别是活化的caspase-3和caspase-2或颗粒酶B的直接裂解产物[3],而且参与了caspase介导的凋亡过程[4]。
本研究原代培养大鼠心肌细胞,一方面利用RNA干扰下调ROCK1和ROCK2的表达,另一方面制备急性缺氧损伤模型模拟临床心肌缺血损伤诱导的心肌细胞凋亡,然后观察心肌细胞凋亡的变化,探讨ROCK1和ROCK2与心肌细胞凋亡的关系,并为与心肌细胞凋亡有关的心血管疾病的治疗提供一种可能的途径。
材料和方法
1 材料
Sprague-Dawley乳鼠(出生1~3 d)雌雄不限,由南昌大学医学院医学实验动物科学部提供(动物合格证为医动字021-9602);培养基DMEM和胎牛血清购自HyClone;抗α-横纹肌肌动蛋白免疫组化试剂盒和FITC羊抗小鼠IgG购自武汉博士德;重组质粒ROCK1-shRNA和ROCK2-shRNA购自上海吉凯;脂质体 LipofectamineTM2000购自 Invitrogen;MTT购自上海普飞生物技术有限公司;DMSO购自Amresco;Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基;ROCK1、ROCK2、caspase-3、p-PI3K和β-actinⅠ抗购自Santa Cruz;Ⅱ抗辣根过氧化物酶IgG购自北京中杉金桥公司。
2 方法
2.1 原代心肌细胞的培养及鉴定 取健康乳鼠心脏,利用0.08%胰酶和1.00%Ⅱ型胶原酶消化心肌组织,离心收集细胞以15%胎牛血清的DMEM培养基充分重悬,200目滤网过滤细胞悬液至培养皿,置CO2培养箱培养,经差速贴壁2 h后,加0.1 mmol/L 5'-BrdU抑制成纤维细胞的生长。小心吸出未贴壁细胞悬液按1×109/L接种到放有盖薄片的培养皿中,48 h后,取有心肌细胞生长的玻片,用37℃ PBS漂洗,4%甲醛固定,加大鼠抗α-横纹肌肌动蛋白单克隆Ⅰ抗1∶50,于4℃湿盒过夜,加FITC羊抗小鼠IgG 1∶50,孵育30 min,缓冲盐水洗2 次,DAPI封片剂染核,显微镜下观察。
2.2 质粒的转染和缺氧处理 将重组质粒ROCK1-shRNA、ROCK2-shRNA和阴性对照shRNA通过脂质体转染大鼠心肌细胞,各质粒序列见表1。在细胞融合率约为90%时进行转染,质粒每孔4.0 μg,脂质体每孔10 μL介导转染。转染6 h后换有血清的培养基培养。因前期实验证实,缺氧6 h时为ROCK1和ROCK2表达的最高峰,所以转染48 h后,将细胞置于缺氧盒(Mitsubishi)中给予缺氧6 h处理。实验分为5组:(1)空白对照组;(2)缺氧组;(3)缺氧+阴性对照shRNA组;(4)缺氧+ROCK1-shRNA组;(5)缺氧+ROCK2-shRNA组。
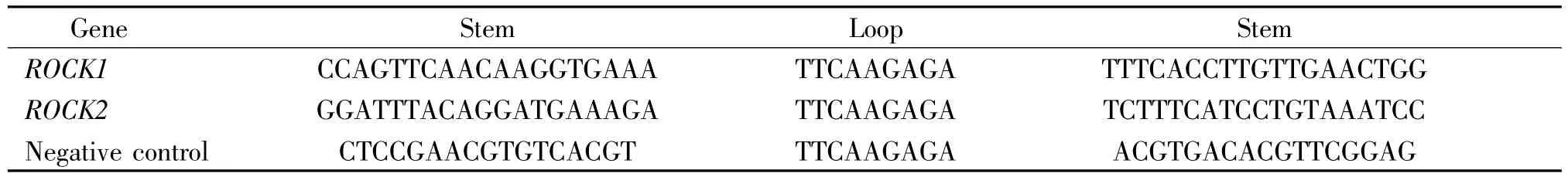
表1 各shRNA构建框架序列Table 1.Sequences of the constructed frames of the shRNAs
2.3 倒置显微镜观察心肌细胞搏动频率与节律在倒置显微镜下连续观察1 min,计算各组心肌细胞的搏动频率,评估搏动节律的变化。
2.4 全自动生化分析仪检测乳酸脱氢酶(lactate dehydrogenase,LDH)含量 各组实验干预后取心肌细胞培养液 400 μL,利用全自动生化分析仪(Beckman)测定LDH含量。
2.5 MTT检测细胞存活率 将细胞种植在96孔板中,空白调零孔只加不含细胞的培养基。实验处理后,每孔加入5 g/L MTT溶液20 μL,继续培养4 h,弃上清,加入 150 μL DMSO,振荡 10 min,酶标仪(Labsystems)测定492 nm处各孔吸光度(A)值。计算细胞存活率,细胞存活率=(A实验组/A对照组)×100%。
2.6 流式细胞仪检测细胞凋亡率 用胰酶消化收集上述各组细胞,PBS洗涤细胞2次,再用500 μL的binding buffer悬浮细胞,分别加入Annexin VFITC和PI各5 μL,最后用FACSCalibar流式细胞仪(Beckton Dickinson)检测。
2.7 Western blotting检测蛋白表达水平 用RIPA法取总蛋白,BCA法测定蛋白质浓度,取20μg进行SDS-PAGE电泳分离蛋白。蛋白转印到硝酸纤维素膜上,3%BSA液4℃封闭过夜。膜分别用ROCK1、ROCK2、caspase-3、p-PI3K 和 β -actin的Ⅰ抗(1∶200稀释)孵育,4℃过夜,Ⅱ抗孵育2 h,DAB显色照相。结果用LabWork 3.0 UVP软件,以目的条带/β-actin的灰度值进行分析。
3 统计学处理
实验均重复3次。应用统计学软件SPSS 13.0进行统计分析,数据采用均数±标准差()表示,多组间比较采用方差分析,组间分析采用q检验。
结 果
1 心肌细胞的鉴定
荧光显微镜显示:本底(图1A)可见细胞呈不规则星型,并伸出伪足,胞浆内可见绿色荧光(图1B)。抗α-横纹肌肌动蛋白阳性的细胞胞浆内有绿色荧光,即证实原代培养的细胞是心肌细胞。
2 shRNA转染和缺氧后心肌细胞搏动频率与节律的变化
空白对照组心肌细胞搏动频率为160次/分左右,节律规整。与空白对照组相比,缺氧后心肌细胞搏动频率明显减慢(P<0.01),搏动幅度变小,节律不规整(P<0.01),而ROCK1-shRNA和ROCK2-shRNA的转染能抑制缺氧导致的这一作用(P<0.05或P<0.01)。缺氧组与缺氧+阴性对照shRNA组之间差异无统计学意义(P>0.05),见表2。
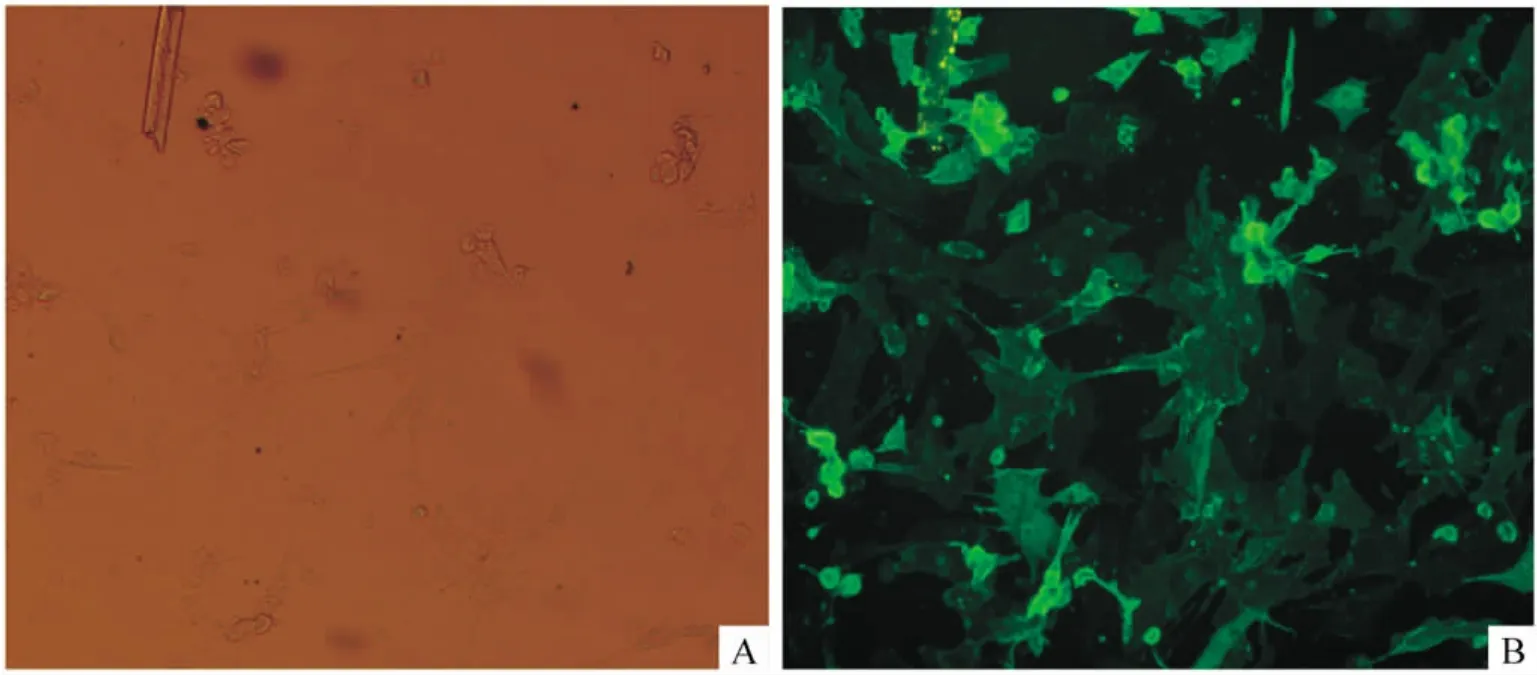
Figure 1.The image of fluorescent microscopy for detecting green fluorescence in cardiomyocytes(×100).A:control;B:experiment.图1 荧光显微镜检测心肌细胞中绿色荧光结果
3 shRNA转染和缺氧后心肌细胞培养液LDH活性、细胞存活率及凋亡率的变化
与空白对照组相比,缺氧后心肌细胞培养液LDH活性明显升高(P<0.01),存活率明显降低(P<0.05),凋亡率明显升高(P<0.01);而ROCK1-shRNA和ROCK2-shRNA的转染能抑制缺氧导致的这一作用(P<0.05或P<0.01)。缺氧组与缺氧+阴性对照shRNA组之间差异不显著(P>0.05),见表3。
4 Western blotting 检测 ROCK1、ROCK2、caspase-3和p-PI3K蛋白表达水平
与阴性对照shRNA组相比,ROCK1-shRNA和ROCK2-shRNA的转染能明显沉默 ROCK1和ROCK2的表达(P<0.05或P<0.01)。空白对照组与阴性对照shRNA组之间差异不显著(P>0.05),见图2。
与空白对照组相比,缺氧后心肌细胞caspase-3蛋白表达明显升高(P<0.05)、p-PI3K表达明显降低(P<0.01),ROCK1-shRNA和 ROCK2-shRNA的转染能抑制缺氧导致的这一作用(P<0.05或P<0.01),缺氧组与缺氧+阴性对照shRNA组之间差异不显著(P>0.05),见图3。
讨 论
ROCK是一种细胞凋亡相关的Rho结合蛋白。静息状态下的ROCK没有酶活性,因为ROCK的激酶活性可能存在一种自我抑制的机制,即通过自身的折返把其催化中心(激酶域)覆盖,这样使得该激酶的Rho结合域(Rho-binding domain,RBD)与ATP的亲和力受到抑制或使得其下游区域不能与底物结合而不被激活[5]。ROCK的活性受细胞外信号和一些胞浆蛋白的调节,ROCK接受Rho传递的活化信号,发生多个氨基酸位点的磷酸化而激活,并介导其下游一系列磷酸化/脱磷酸化反应[6]。细胞凋亡已被认为是心血管疾病发生、发展的基本机制[7-8]。Caspase在细胞凋亡过程中起中枢性的作用[9-10]。而ROCK1和ROCK2分别是活化的caspase-3和caspase-2或颗粒酶B的直接裂解产物,而且参与了caspase介导的凋亡过程[3-4]。但是,下调 ROCK1 和ROCK2的表达能否抑制心肌细胞的凋亡,目前未见相关报道。为此,本研究原代培养大鼠心肌细胞,一方面利用RNA干扰下调ROCK1和ROCK2的表达,另一方面制备急性缺氧损伤模型模拟临床心肌缺血损伤诱导心肌细胞的凋亡,然后观察心肌细胞凋亡的变化。结果显示,缺氧损伤能促进心肌细胞的凋亡、抑制其存活,能增高caspase-3的表达、降低p-PI3K的表达;而ROCK1和ROCK2的表达下调能抑制缺氧导致的这一作用。
表2 shRNA转染和缺氧后心肌细胞搏动频率与节律的变化Table 2.The changes of beat frequency and rhythm of cardiomyocytes treated with shRNA transfection and hypoxia(.n=3)

表2 shRNA转染和缺氧后心肌细胞搏动频率与节律的变化Table 2.The changes of beat frequency and rhythm of cardiomyocytes treated with shRNA transfection and hypoxia(.n=3)
**P <0.01 vs blank control group;#P <0.05,##P <0.01 vs hypoxia+negative control shRNA group.
Group Frequency(min-1)Abnormal beat(min-1)Blank control 157 ±16 1.3 ±0.4 Hypoxia 86 ±7** 17.7 ±1.8**Hypoxia+negative control shRNA 83 ±12 16.4 ±1.5 Hypoxia+ROCK1 -shRNA 103 ±17# 6.5 ±0.6#Hypoxia+ROCK2 -shRNA 111 ±18## 5.7 ±0.4#
表3 shRNA转染和缺氧后心肌细胞培养液LDH活性、细胞存活率及凋亡率的变化Table 3.The changes of LDH activity in culture medium,survival rate and apoptotic rate of cardiomyocytes treated with shRNA transfection and hypoxia(.n=3)
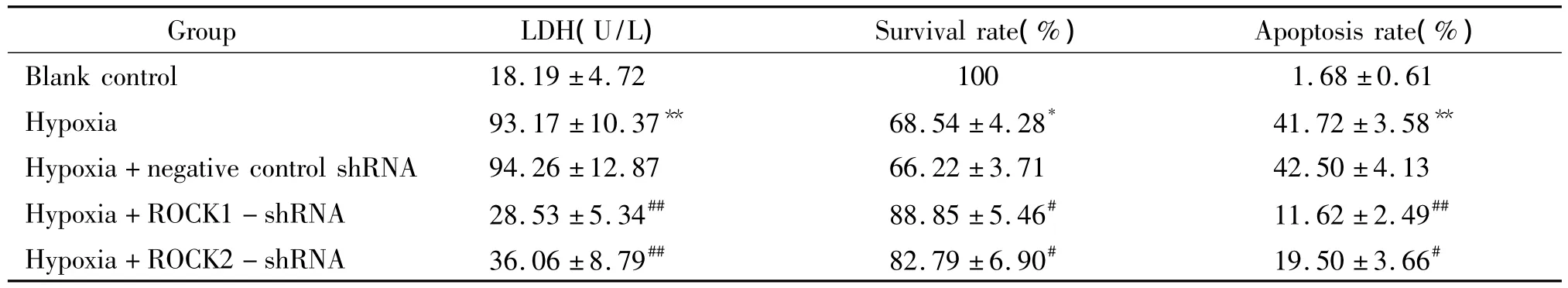
表3 shRNA转染和缺氧后心肌细胞培养液LDH活性、细胞存活率及凋亡率的变化Table 3.The changes of LDH activity in culture medium,survival rate and apoptotic rate of cardiomyocytes treated with shRNA transfection and hypoxia(.n=3)
*P <0.05 ,**P <0.01 vs blank control group;#P <0.05,##P <0.01 vs hypoxia+negative control shRNA group.
Group LDH(U/L) Survival rate(%) Apoptosis rate(%)Blank control 18.19 ±4.72 100 1.68 ±0.61 Hypoxia 93.17 ±10.37** 68.54 ±4.28* 41.72 ±3.58**Hypoxia+negative control shRNA 94.26 ±12.87 66.22 ±3.71 42.50 ±4.13 Hypoxia+ROCK1 - shRNA 28.53 ±5.34## 88.85 ±5.46# 11.62 ±2.49##Hypoxia+ROCK2 - shRNA 36.06 ±8.79## 82.79 ±6.90# 19.50 ±3.66#
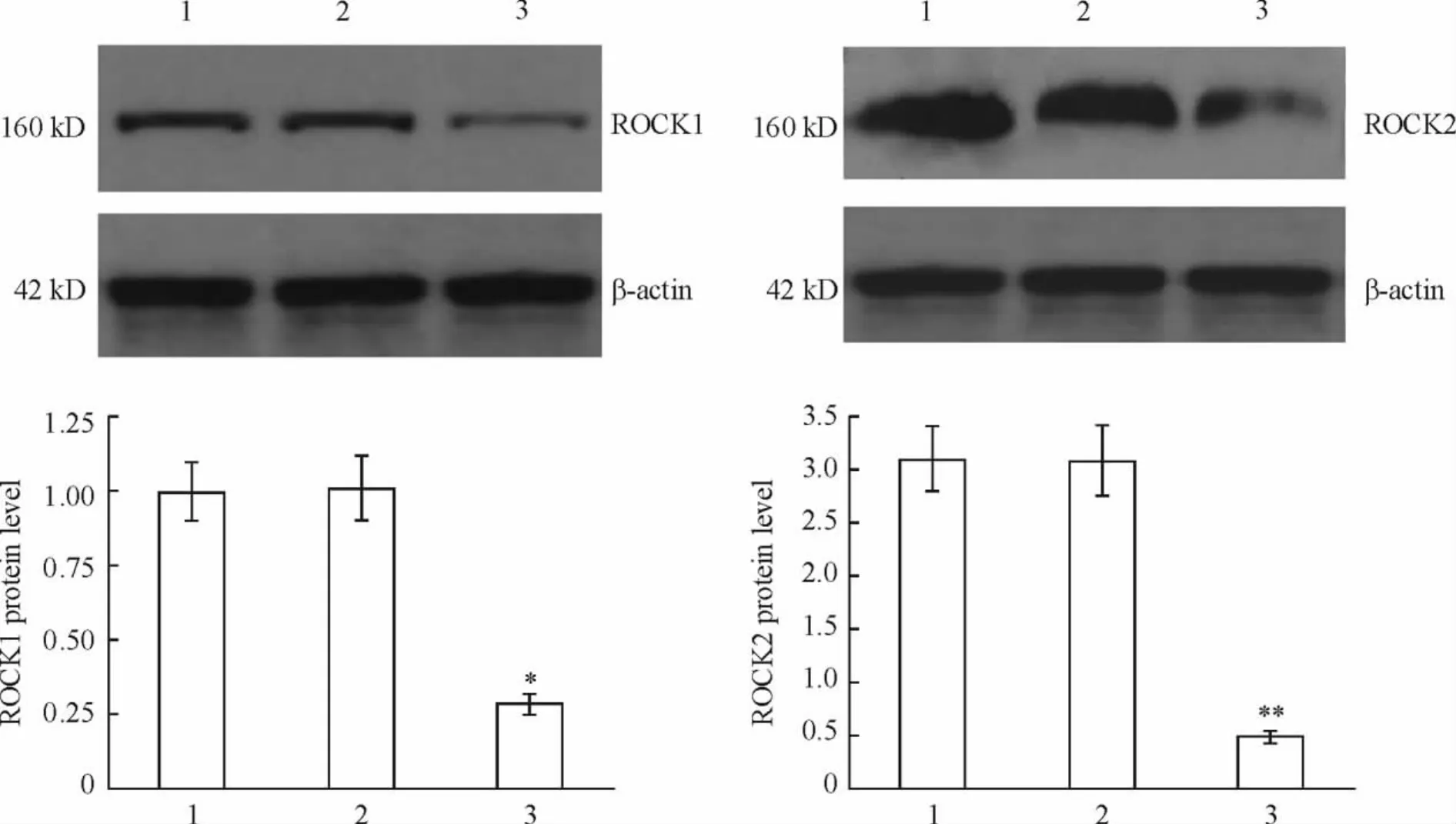
Figure 2.The changes of protein expression of ROCK1 and ROCK2 in cardiomyocytes treated with shRNA transfection.1:blank control group;2:negative control shRNA group;3:ROCK1-shRNA or ROCK2-shRNA..n=3.*P<0.05,**P<0.01 vs negative control shRNA group.图2 shRNA转染后心肌细胞ROCK1和ROCK2的蛋白表达的变化
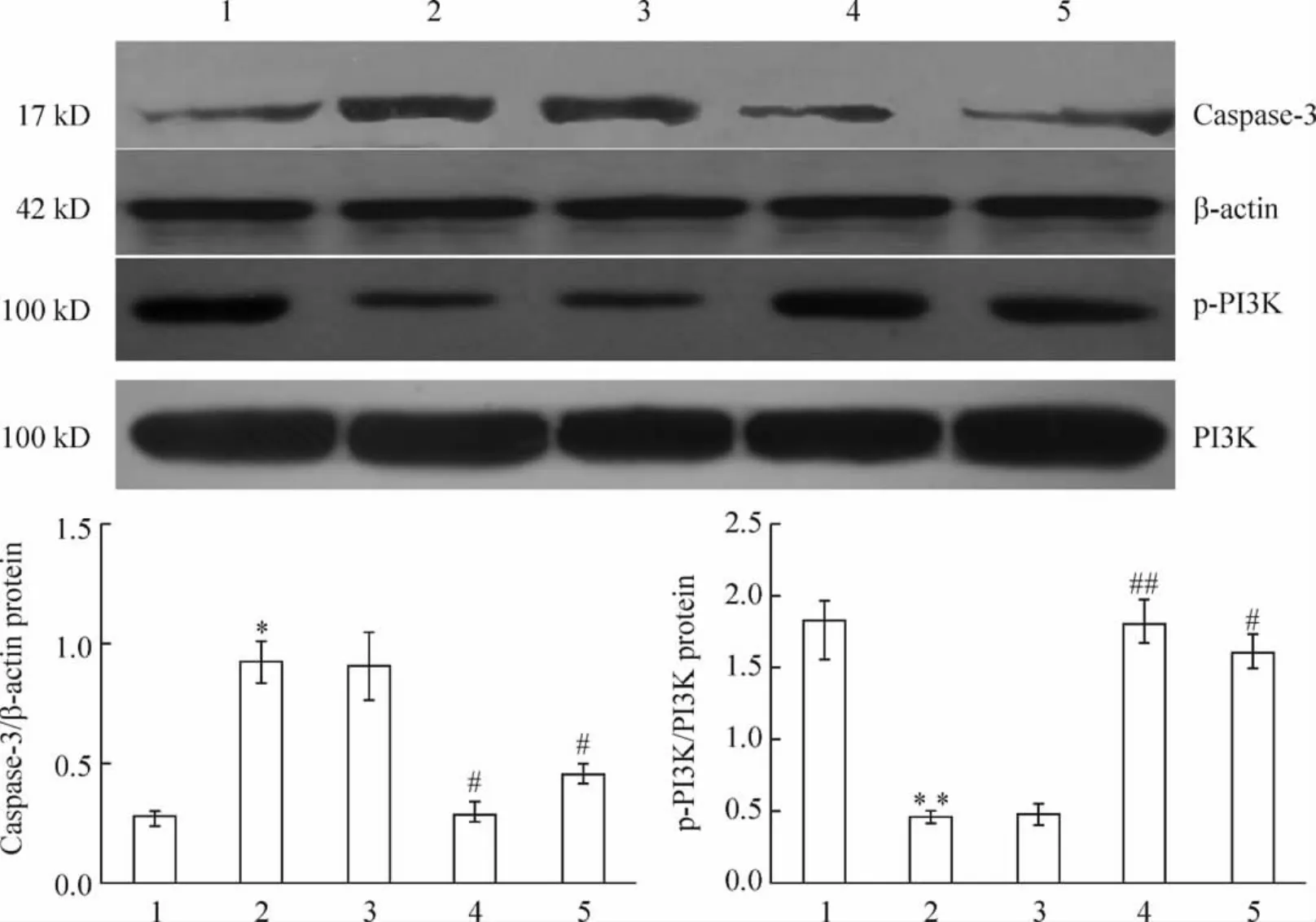
Figure 3.The changes of protein expression of caspase-3(cleaved caspase-3)and p-PI3K in cardiomyocytes treated with shRNA transfection and hypoxia.1:blank control group;2:hypoxia group;3:hypoxia+negative control shRNA group;4:hypoxia+ROCK1-shRNA group;5:hypoxia+ROCK2-shRNA group..n=3.*P<0.05,**P<0.01 vs blank control group;#P<0.05,##P <0.01 vs hypoxia+negative control shRNA group.图3 shRNA转染和缺氧后心肌细胞caspase-3和p-PI3K蛋白表达的变化
心力衰竭和冠心病等心血管疾病发病过程中伴随着心肌细胞的凋亡[11-12]。本研究制备了急性缺氧损伤模型模拟临床心肌缺血损伤诱导心肌细胞的凋亡。而ROCK1和ROCK2表达下调能抑制缺氧导致的心肌细胞凋亡增强、存活降低的作用,这提示我们也许可以通过下调ROCK1和ROCK2的表达来治疗与心肌细胞凋亡有关的心血管疾病。Caspase在细胞凋亡过程中起中枢性作用。激活的caspase作用于其底物蛋白,使蛋白分解引起凋亡[13-14]。ROCK1是活化的caspase-3的直接裂解底物,而ROCK1活化的裂解产物增加时,又能导致caspase-3的激活,对凋亡起正反馈作用[15]。本研究中,缺氧损伤可导致心肌细胞 caspase-3表达升高,而ROCK1和ROCK2表达下调能抑制缺氧导致的caspase-3表达升高作用。这进一步证明,ROCK1和ROCK2表达下调能抑制缺氧导致的心肌细胞凋亡的作用。研究发现,PI3K在缺血预适应和缺血再灌注损伤中被激活,进而抑制心肌细胞凋亡,发挥心肌保护作用[16-17]。p-PI3K是 PI3K的活化状态。本研究中,缺氧损伤可导致心肌细胞p-PI3K表达降低,而ROCK1和ROCK2表达下调能抑制缺氧导致的p-PI3K表达降低作用。综上所述,ROCK1和ROCK2表达下调能抑制缺氧导致的心肌细胞凋亡增强、存活降低的作用,并且其机制与抑制caspase-3活化和增强p-PI3K的表达有关,这为与心肌细胞凋亡有关的心血管疾病的治疗提供一种可能的途径。
[1]Tu D,Li Y,Song HK,et al.Crystal structure of a coiled- coil domain from human ROCK I[J].PLoS One,2011,6(3):e18080.
[2]Breslin JW.ROCK and cAMP promote lymphatic endothelial cell barrier integrity and modulate histamine and thrombin-induced barrier dysfunction[J].Lymphat Res Biol,2011,9(1):3 -11.
[3]Rubenstein NM,Callahan JA,Lo DH,et al.Firestone,selective glucocorticoid control of Rho kinase isoforms regulate cell- cell interactions[J].Biochem Biophys Res Commun,2007,354(2):603 -607.
[4]Ark M,Ozdemir A,Polat B.Ouabain-induced apoptosis and Rho kinase:a novel caspase-2 cleavage site and fragment of Rock -2[J].Apoptosis,2010,15(12):1494-1506.
[5]Doran JD,Liu X,Taslimi P,et a1.New insights into the structure-function relationships of Rho-associated kinase:a thermodynamic and hydrodynamic study of the dimer-to- monomer transition and its kinetic implications[J].Biochem J,2004,384(2):255 -262.
[6]Zhang X,Li C,Gao H,et a1.Rho kinase inhibitors stimulate the migration of human cultured osteoblastic cells by regulating actomyosin activity[J].Cell Mol Biol Lett,2011,16(2):279 -295.
[7]王 群,鹿庆华,蒋卫东,等.胱抑素C对氧化型低密度脂蛋白诱导的人血管平滑肌细胞凋亡的影响[J].中国病理生理杂志,2008,24(12):2319 -2323.
[8]吴 杏,叶任高,汪 涛,等.TNF-α、IL-1β、LPS对心肌细胞影响的研究[J].中国病理生理杂志,2004,20(6):929-934.
[9]Yazdi AS,Guarda G,D'Ombrain MC,et a1.Inflammatory caspases in innate immunity and inflammation[J].J Innate Immun,2010,2(3):228 -237.
[10]Alenzi FQ,Lotfy M,Wyse R.Swords of cell death:caspase activation and regulation[J].Asian Pac J Cancer Prev,2010,11(2):271 -280.
[11]Song YH,Cai H,Gu N,et a1.Icariin attenuates cardiac remodelling through down-regulating myocardial apoptosis and matrix metalloproteinase activity in rats with congestive heart failure[J].J Pharm Pharmacol,2011,63(4):541-549.
[12]Xin W,Lu X,Li X,et a1.Attenuation of endoplasmic reticulum stress-related myocardial apoptosis by SERCA2a gene delivery in ischemic heart disease[J].Mol Med,2011,17(3 -4):201 -210.
[13]Kitazumi I,Tsukahara M.Regulation of DNA fragmentation:the role of caspases and phosphorylation[J].FEBS J,2011,278(3):427 -441.
[14]Korzeniewska-Dyl I.Caspases-structure and function[J].Pol Merkur Lekarski,2007,23(138):403 -407.
[15]Chang J,Xie M,Shah VR,et a1.Activation of Rho associated coiled-coil protein kinase 1(ROCK1)by caspase-3 cleavage plays an essential role in cardiac myocyte apoptosis[J].Proc Natl Acad Sci USA,2006,103(39):14495-14500.
[16]Dhanasekaran A,Gruenloh SK,Buonaccorsi JN,et al.Multiple antiapoptotic targets of the PI3K/AKT survival pathway are activated by epoxyeicosatrienoic acids to protect cardiomyocytes from hypoxia/anoxia[J].Am J Physiol Heart Circ Physiol,2008,294(2):H724 - H735.
[17]Gu X,Feng Y,Shi C,et al.Antiapoptotic mechanism of insulin in reoxygenation-induced injury in cultured cardiomyocytes of neonatal rats[J].J Huazhong Univ Sci Technolog Med Sci,2005,25(6):632 - 635.
