百里醌对血管生成及胰腺癌生长的影响*
2011-07-31吴志豪
刘 岸,王 武,陈 兆,吴志豪
(1温州医学院附属第二医院,浙江 温州 325027;2岳阳市第一人民医院,湖南 岳阳 414000;3温州医学院附属眼视光医院,浙江 温州 325000)
新生血管生成在恶性肿瘤生长和转移中发挥了重要的作用,研究表明血管内皮祖细胞(endothelial progenitor cells,EPCs)具有自我增殖和定向归巢的特性,可定向分化为血管内皮细胞,从而在新生血管生成中发挥重要作用。百里醌(thymoqinone)是近年来从产自中东国家的黑种草籽油中分离出来的主要有效单体,研究发现其具有强大的抑癌效应,可抑制多种恶性肿瘤细胞生长和转移[1,2],还能抑制人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)介导的血管生长[3]。但百里醌对EPCs的影响以及对人胰腺癌血管生长的抑制作用却未见报道。因此,本研究将探讨百里醌对EPCs体外小管生成的影响以及对人胰腺癌血管生长的影响及其可能机制,为百里醌的临床应用提供一定的实验依据。
材料和方法
1 主要药品和试剂
百里醌购自Sigma;胎牛血清(fetal bovine serum,FBS)、含EDTA胰酶和RPMI-1640培养基购自Gibco;EGM-2培养基购自Lonza;人工重组基底膜(Matrigel)购自BD;Ⅰ抗小鼠抗血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)单克隆抗体、兔抗VIII因子多克隆抗体购自Santa Cruz;Ⅰ抗兔抗CD34多克隆抗体购自武汉博士德生物工程有限公司;人纤连蛋白(human fibronectin,HFN)购自Chemicon;ABC免疫组化检测试剂盒和AEC染色试剂盒购自华美生物工程公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)和β-actin抗体购自Epitomics。百里醌用无水乙醇配制成10 mmol/L,-20℃冰箱保存,使用时用不含血清的RPMI-1640培养基稀释成所需浓度。
2 方法
2.1 细胞株及细胞培养 人胰腺癌细胞株PANC-1为本实验室保存,培养在含10%胎牛血清、质量浓度1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养液中,置于37℃、5%CO2的细胞培养箱中培养。细胞单层贴壁生长,至70% ~80%融合时胰蛋白酶消化传代。
2.2 EPCs的分离和培养 参照杨德业等[4]的方法收集2010年9月~2010年12月弃用的健康新生儿脐带血液5例(温州医学院附属第二医院产科),每次采集脐血量约30 mL。采用密度梯度离心法收集脐血中的单个核细胞接种在包被有HFN 10 cm2培养皿中。加入3 mL含10%FBS EGM-2培养液,24 h后更换全部培养液。此后7 d内每天更换50%的培养液,7 d后每3 d更换全部培养液,同时观察细胞生长情况,待原代细胞生长汇合后传代进行下一步实验。
2.3 EPCs的鉴定 取第2代细胞接种至24孔板中,培养至贴壁。采用40 g/L多聚甲醛固定20 min,0.3%H2O2-甲醇液封闭内源性过氧化物酶10 min,PBS浸洗后分别加1∶100稀释的Ⅰ抗小鼠抗VEGFR-2,兔抗VIII因子相关抗原抗体及兔抗CD34抗体于4℃下孵育过夜。Ⅱ抗结合参照ABC免疫组化检测试剂盒说明书进行,之后用AEC染色试剂染色,苏木素复染,在倒置相差显微镜下(Nikon,TS100)观察染色结果。阴性对照组为胰腺癌细胞株PANC-1。
2.4 动物 雌性BALB/c-nu/nu品系的裸小鼠(4-6周龄),体重18-20 g,购自中科院上海动物实验中心,许可证号为SCXK(沪)2007-0005。饲养于温州医学院SPF级屏障系统的洁净层流架内,室温控制在(25±1)℃,相对湿度40% ~60%,动物所需饲料、饮水、笼具和操作器材及其它用品均灭菌处理后使用,实验时按无菌原则操作。
2.5 小管形成实验 4℃下于96孔板中每孔加入100 μL Matrigel,铺平后置37℃培养箱内固定5 h。以4×104cells/well接种于培养板,加入不同浓度百里醌(10 nmol/L、20 nmol/L和40 nmol/L),以溶媒为对照组,每组设5个复孔。37℃培养箱培养12 h后,倒置显微镜下观察并拍照,并计算不同浓度百里醌作用后EPCs小管生成的抑制率。
2.6 Western印迹检测PANC-1细胞中VEGF的表达 收集处于对数生长期的胰腺癌PANC-1细胞,不同浓度百里醌(20 μmol/L、40 μmol/L 和80 μmol/L)(微摩尔级浓度百里醌对于EPCs来说浓度太高,20 μmol/L的百里醌作用48 h可完全杀灭该细胞,因此作用EPCs的百里醌选用纳摩尔级浓度)作用PANC-1细胞48 h后,RIPA裂解液裂解细胞,提取上清液,测量蛋白浓度后取等量蛋白质样品(20 μg/well),8%SDS-PAGE电泳,半干转膜仪转膜,5%脱脂奶粉封闭后滴加兔抗人VEGF抗体为第Ⅰ抗体,HRP标记的羊抗兔IgG为第Ⅱ抗体,ECL显色,X线胶片曝光。
2.7 裸鼠胰腺癌原位移植瘤模型制备及实验干预
①制备胰腺癌皮下移植瘤模型 取3×106个对数生长期的PANC-1细胞悬浮为0.2 mL细胞悬液,注射至裸鼠腋部皮下,待肿瘤生长成1 cm×1 cm×1 cm大小后取出,无菌条件下去除中央坏死组织,选取周围健康肿瘤组织剪成1 mm×1 mm×1 mm的组织块。
②制备外科胰腺癌原位移植模型 戊巴比妥钠(50 mg/kg BW)腹腔麻醉裸鼠,经左上腹直肠旁线切口后,仔细暴露胰腺,术者佩戴手术放大镜后小心剪开胰腺被膜,将瘤块植入胰尾处。以8-0可吸收外科缝线缝合胰腺被膜,将胰腺轻轻送回腹腔,6-0可吸收外科缝线单层缝合腹壁肌层及皮肤。以上所有操作均在超净台内进行。共制备20只裸鼠,随机分成2组,每组10只。手术后第3周开始给药,对照组每只裸鼠1%乙醇0.2 mL灌胃;百里醌给药采用灌胃,剂量为20 mg/kg[2],每周3次,持续给药3周。术后第8周处死老鼠,并计算裸鼠8周生存率;鼠重变化ΔBW(g)=治疗后鼠重-治疗前鼠重;抑瘤率 =1-治疗组与对照组肿瘤实际重量的比值。
2.8 免疫组织化学法检测裸鼠胰腺肿瘤组织中Ki-67、CD34和VEGF的表达 每组各选取5个肿瘤组织,按照Envision法的操作步骤进行免疫组化实验,选取新鲜肿瘤组织经石蜡切片常规脱蜡水化、Ⅰ抗孵育和封片后低倍镜(×100)下寻取血管密度最高的区域,然后高倍镜(×400)下随机选择20个视野,计数每个视野中CD34阳性细胞数;同时在高倍镜下随机选择20个视野,计算每个视野中Ki-67和VEGF阳性细胞所占比例。
3 统计学处理
结 果
1 EPCs鉴定结果
用免疫细胞染色法对细胞染色后发现细胞表面相关抗原VEGFR-2、VIII因子和 CD34表达均为阳性,见图1,此类细胞被认为是正在分化的EPCs。检测胰腺癌PANC-1细胞各抗体表达均为阴性。
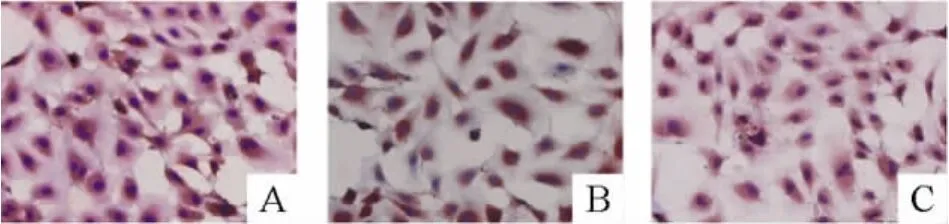
Figure 1.Expression of VEGFR-2(A),Ⅷ factor(B)and CD34(C)in EPCs(×400).图1 EPCs细胞经细胞免疫组化染色检测VEGFR-2、VⅢ因子和CD34的表达
2 百里醌对EPCs体外血管生成的抑制作用
不同浓度百里醌(10 nmol/L、20 nmol/L和40 nmol/L)作用EPCs 12 h后,倒置显微镜下观察,低浓度百里醌(10 nmol/L)对EPCs小管形成无明显影响,20 nmol/L百里醌开始显著抑制小管生成,不仅小管数目减少,而且管腔不完整;以40 nmol/L百里醌抑制EPCs小管生成的效应最显著,见图2。
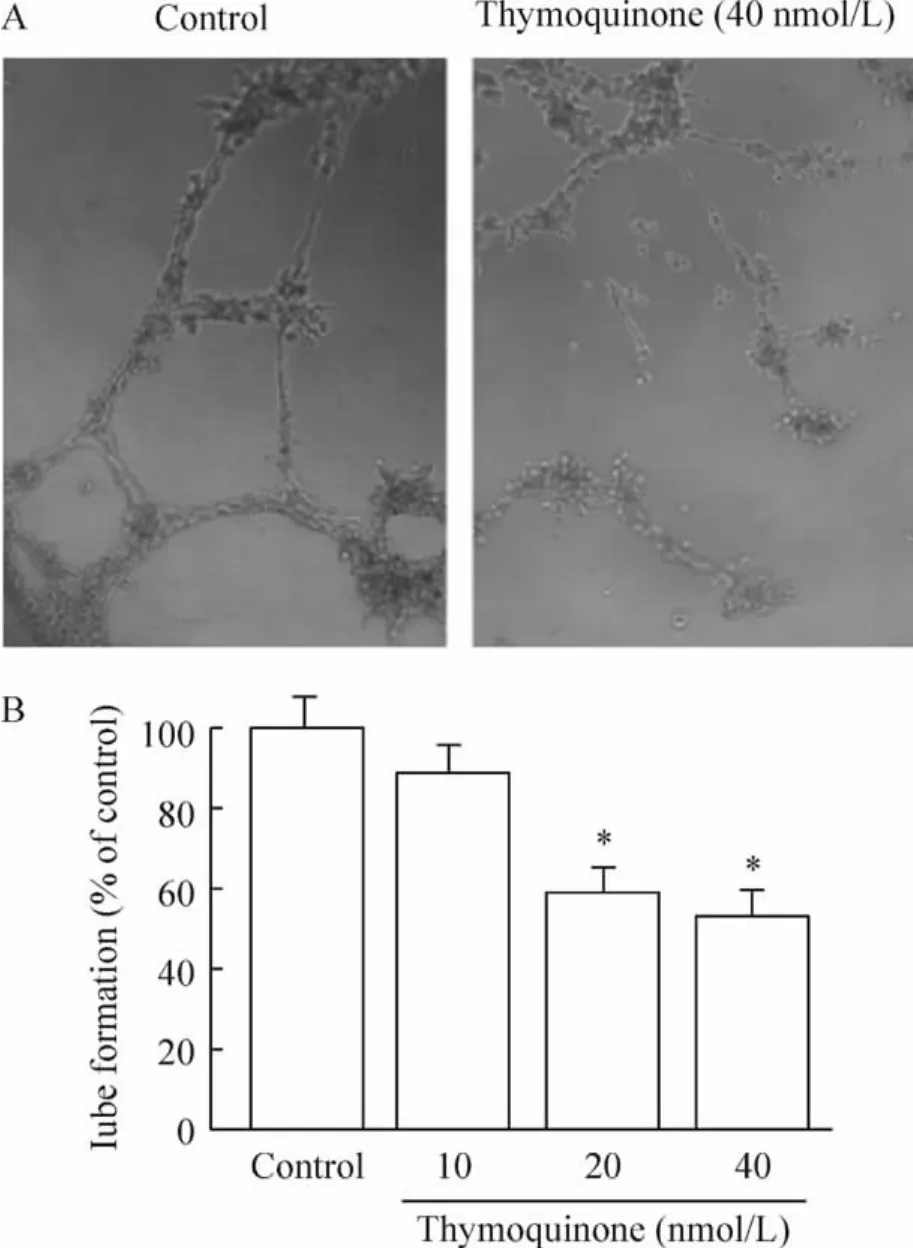
Figure 2.Inhibitory effect of thymoquinone on tubule-like structure formation of EPCs.A:EPCs were cultured on a layer of Matrigel in the presence or absence of thymoquinone for 12 h,and tube formation was determined using a optical microscope(×200);B:tubule-like structure was quantified by manual counting..n=3.*P < 0.05 vs control图2 百里醌对体外EPCs小管形成的影响
3 百里醌对胰腺癌PANC-1细胞中VEGF表达的影响
Western blotting结果表明,低浓度(20 μmol/L)百里醌对胰腺癌细胞VEGF蛋白表达无明显影响,但高浓度(40~80 μmol/L)的百里醌显著抑制胰腺癌细胞中VEGF蛋白的表达水平,以80 μmol/L百里醌抑制作用最明显,见图3。
4 百里醌对体内胰腺癌生长的抑制作用
实验结束后,对照组和百里醌组的鼠重均有不同程度的降低,但对照组的裸鼠体重下降更为明显(P<0.05);实验组少量裸鼠治疗期间出现腹泻、稀便及脱水表现,但疗程结束也随之停止。实验第56 d处死动物后,百里醌组肿瘤平均重量为(0.27±0.06)g,与对照组[(1.12 ±0.22)g]相比较差异显著(P<0.05);但百里醌组对胰腺肿瘤预后无明显影响,见表1。
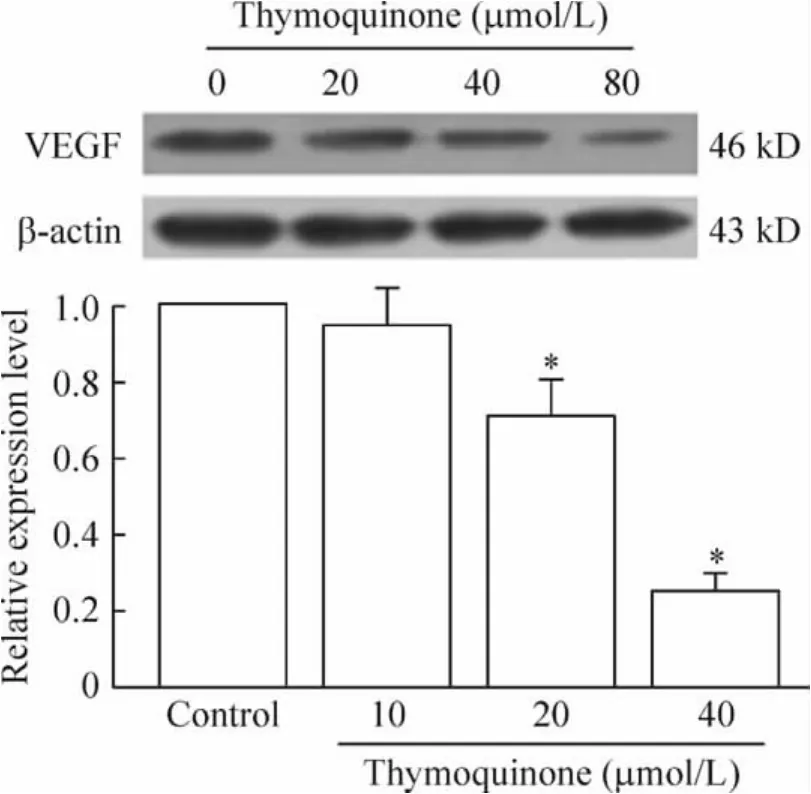
Figure 3.Western blotting analysis of VEGF in whole cell lysates of PANC-1 cells after treated with various concentrations of thymoquinone for 48 h.β - actin protein served as loading control..n=3.*P < 0.05 vs control.图3 不同浓度的百里醌作用于人胰腺癌PANC-1细胞48 h后对VEGF蛋白表达的影响
表1 百里醌对荷瘤裸鼠体重、胰腺肿瘤重量、抑瘤率及生存率的影响Table 1.Effects of thymoquinone on body weight,tumor weight,inhibitory rate and survival rate in tumor-bearing nude mice(.n=10)

表1 百里醌对荷瘤裸鼠体重、胰腺肿瘤重量、抑瘤率及生存率的影响Table 1.Effects of thymoquinone on body weight,tumor weight,inhibitory rate and survival rate in tumor-bearing nude mice(.n=10)
*P <0.05 vs control.
Group Tumor weight(g)Inhibitory rate(%)Survival rate(%) ΔBW(g)Control 1.12±0.22 - 80%(8/10)-0.46 ±0.19 Thymoquinone0.27 ±0.06* 75.9 90%(9/10) -0.15 ±0.07*
5 免疫组织化学法检测裸鼠胰腺肿瘤组织中Ki-67、CD34和VEGF蛋白表达
如图4所示,免疫组织化学染色可见对照组肿瘤组织中大量细胞Ki-67、CD34和VEGF阳性表达。与对照组相比较,百里醌组肿瘤组织中Ki-67、CD34和VEGF阳性表达细胞均明显减少,见表2。各组肿瘤组织切片经PBS代替特异性Ⅰ抗作为空白对照,肿瘤组织切片镜下均无阳性表达。
讨 论

Figure 4.Immunohistochemistry for Ki-67,CD34 and VEGF protein expression in harvested tumors from tumorbearing nude mice(×400).图4 免疫组织化学法检测百里醌对裸鼠胰腺癌原位移植瘤中Ki-67、CD34和VEGF表达的影响
表2 百里醌对肿瘤组织中Ki-67、CD34和VEGF表达的影响Table 2.Effects of thymoquinone on the expression of Ki-67,CD34 and VEGF in pancreatic cancer samples(.n=20)

表2 百里醌对肿瘤组织中Ki-67、CD34和VEGF表达的影响Table 2.Effects of thymoquinone on the expression of Ki-67,CD34 and VEGF in pancreatic cancer samples(.n=20)
*P <0.05 vs control group.
Group Ki-67(%)CD34+vesselsVEGF(%)Control 73.8 ±11.5 17.4 ±3.8 81.6 ±6.5 Thymoquinone 43.6 ±9.6* 6.2 ±1.9* 35.7 ±5.7*
在肿瘤生长过程中,肿瘤大小超过1~2 mm就需要持续血供才能维系生长[5],而且新生血管在肿瘤组织中呈广泛而不规则生长,血管吻合显著增多。一旦肿瘤细胞拥有诱导血管生长的能力,肿瘤生长变得极富有侵犯性,从而为肿瘤侵袭和转移提供便利。近几十年来,Folkman 等[6]和 Kerbel等[7]发现,抑制肿瘤血管生长可抑制肿瘤生长和转移,从而改善病人预后。遗憾的是,当前发现的血管抑制剂具有一定的毒副作用,如COX-2抑制剂塞来昔布可引起粒细胞减少和贫血等不良反应[8]。因此,寻求一种天然低毒的血管抑制剂成为抗癌治疗的迫切需要。在以往研究中,百里醌显示出强大的抑瘤效应,且没有明显的细胞毒性[1],同时,该药可有效抑制HUVECs增殖及其功能,从而在其抑制前列腺癌生长中发挥了一定的作用[3]。这些提示百里醌可以作为一种新型血管生成抑制剂用于肿瘤治疗。
新生血管形成是由一系列步骤组成的生物学过程,包括内皮细胞增殖和迁移、血管管腔的形成与存活[9,10]。作为多种内皮细胞的前体细胞 EPCs是一种来源于骨髓的干细胞,具有运动、增殖和分化为成熟内皮细胞的能力,EPCs在机体肿瘤血管新生过程中起到重要作用。首先,EPCs数量下降会引起血管修复能力下降,从而引发心血管事件[11];其次,体外注射EPCs可显著改善肢体血管新生[12],加速血液循环[13];再次,在新生血管形成中,EPCs占内皮细胞总数的25%之多[14];最后,EPCs在肿瘤生长的早期起到至关重要的作用[15]。在本研究中,我们成功培养出人脐血 EPCs,并经 VEGFR-2、VIII因子和CD34细胞免疫组化证实细胞的内皮属性,且首次发现低浓度百里醌可显著抑制体外EPCs小管形成,具有抑制体外血管生成的能力,与文献报道相近[3];另外,在体内实验中,我们建立起胰腺癌原位移植模型,发现百里醌不仅可在对机体无明显影响的前提下抑制体内胰腺肿瘤生长,还可显著抑制胰腺肿瘤中CD34阳性表达,表明百里醌可抑制包括EPCs在内的内皮细胞在胰腺肿瘤中的血管生成,与我们设想相符。上述结果提示里醌作为一种低毒的抑瘤药物可通过抑制EPCs体内外血管生成,从而可能在其抑制胰腺肿瘤生长中发挥了一定的作用。
VEGF是一种重要的血管新生依赖因子,它一方面可通过增强血管的通透性引起纤维蛋白原等血浆蛋白的外渗,为肿瘤细胞的生长和新生毛细血管网提供最佳基质;另一方面与其受体结合,发挥特异性的内皮细胞分裂原的活性,刺激血管内皮细胞增殖,从而促进血管的新生[7]。大多数肿瘤细胞可分泌VEGF,但缺乏VEGF受体,而内皮细胞表达VEGF受体却很少表达VEGF,因此VEGF在促进内皮细胞在肿瘤组织形成血管的过程中发挥了重要作用。最新研究表明,抗VEGF药物bevacizumab已成为治疗乳腺癌的一线化疗药物[16],显示血管生成抑制剂良好的抗癌前景。在本研究中,胰腺癌细胞株PANC-1中VEGF呈高表达状态,而百里醌不仅可抑制体外胰腺癌细胞中VEGF的表达,还能有效下调体内胰腺肿瘤中VEGF的表达,表明百里醌可通过下调VEGF而抑制胰腺肿瘤中血管生成。
[1]Banerjee S,Kaseb AO,Wang Z,et al.Antitumor activity of gemcitabine and oxaliplatin is augmented by thymoquinone in pancreatic cancer[J].Cancer Res,2009,69(13):5575-5583.
[2]Jafri SH,Glass J,Shi R,et al.Thymoquinone and cisplatin as a therapeutic combination in lung cancer:In vitro and in vivo[J].J Exp Clin Cancer Res,2010,29:87.
[3]Yi T,Cho SG,Yi Z,et al.Thymoquinone inhibits tumor angiogenesis and tumor growth through suppressing AKT and extracellular signal-regulated kinase signaling pathways[J].Mol Cancer Ther,2008,7(7):1789 -1796.
[4]杨德业,张怀勤,季抗挺,等.内皮祖细胞在体外培养成血管样结构的初步观察[J].中国病理生理杂志,2006,22(10):1970-1974.
[5]Seno H,Oshima M,Ishikawa TO,et al.Cyclooxygenase 2-and prostaglandin E2receptor EP2-dependent angiogenesis in ApcΔ716mouse intestinal polyps[J].Cancer Res,2002,62(2):506 -511.
[6]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[7]Kerbel RS.Tumor angiogenesis[J].N Engl J Med,2008,358(19):2039-2049.
[8]Dragovich T,Burris H 3rd,Loehrer P,et al.Gemcitabine plus celecoxib in patients with advanced or metastatic pancreatic adenocarcinoma:results of a phase Ⅱ trial[J].Am J Clin Oncol,2008,31(2):157 -162.
[9]方 英,傅国胜,宋筱筱,等.雷公藤内酯醇对外周血内皮祖细胞的影响[J].中国病理生理杂志,2008,24(12):2315-2318.
[10]Bussolino F,Mantovani A,Persico G.Molecular mechanisms of blood vessel formation[J].Trends Biochem Sci,1997,22(7):251-256.
[11]Kunz GA,Liang G,Cuculi F,et al.Circulating endothelial progenitor cells predict coronary artery disease severity[J].Am Heart J,2006,152(1):190 -195.
[12]Murohara T,Ikeda H,Duan J,et al.Transplanted cord blood-derived endothelial precursor cells augment postnatal neovascularization[J].J Clin Invest,2000,105(11):1527-1536.
[13]Schatteman GC,Hanlon HD,Jiao C,et al.Blood-derived angioblasts accelerate blood-flow restoration in diabetic mice[J].J Clin Invest,2000,106(4):571 -578.
[14]Suzuki T,Nishida M,Futami S,et al.Neoendothelialization after peripheral blood stem cell transplantation in humans.A case report of a Tokaimura nuclear accident victim[J].Cardiovasc Res,2003,58(2):487 -492.
[15]Nolan DJ,Ciarrocchi A,Mellick AS,et al.Bone marrow-derived endothelial progenitor cells are a major determinant of nascent tumor neovascularization[J].Genes Dev,2007,21(12):1546-1558.
[16]Scott LJ.Bevacizumab:in first- line treatment of metastatic breast cancer[J].Drugs,2007,67(12):1793 -1799.
