二甲双胍对高脂饮食诱导的胰岛素抵抗大鼠LPIN1表达及AMPK通路的作用*
2011-07-31庄向华刘元涛倪一虹孙福敦陈诗鸿
庄向华,刘元涛,倪一虹,孙福敦,陈诗鸿
(山东大学第二医院内分泌科,山东 济南 250033)
脂肪组织作为一种内分泌器官,可分泌多种脂肪因子如瘦素、抵抗素、脂联素、内脂素等,在糖脂代谢调节过程中发挥重要的作用[1]。LPIN1蛋白是一种新发现的基因LPIN1表达蛋白,在fld小鼠中基因缺失,其作用缺陷可以导致脂肪细胞分化障碍、糖代谢受损、高脂血症[2]。动物研究表明LPIN1基因表达与肥胖、胰岛素抵抗负相关。LPIN1的生理学作用目前尚未完全明确。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种重要的蛋白激酶,能调节能量代谢,被称为“能量感受器”。除调节机体能量代谢外,AMPK也参与机体胰岛素敏感性的调节。研究发现,AMPK基因剔除可诱导小鼠胰岛素抵抗;而AMPK过表达或AMPK特异性激活剂均具有胰岛素增敏效应[3]。二甲双胍可以激活AMPK信号通路,抑制肝脏的糖异生,促进脂肪酸氧化,改善胰岛素敏感性。本课题从肝脏胰岛素抵抗发病机制出发,通过高脂喂养诱导大鼠产生胰岛素抵抗(insulin resistance,IR),观察大鼠肝脏LPIN1和AMPKα表达、活性的变化。造模成功后应用二甲双胍进行干预,探讨LPIN1在胰岛素抵抗发生过程中可能的作用机制。
材料和方法
1 动物
雄性Wistar大鼠36只,购于山东大学医学院实验动物中心,体重160~200 g,动物的饲养遵照山东大学医学院伦理委员会规定。给予标准饲料,自由取食和饮水。适应性饲养1周后,按体重随机分为2组:对照组(control,Con组)12只,给予大鼠食用的标准饲料,含有5%的脂肪、53%碳水化合物、23%蛋白质,热量含量为25 kJ/kg;高脂饲养组(high-fat diet,HF组)24只,给予高脂饮食,含有22%脂肪、48%碳水化合物以及20% 蛋白质,热量含量为44.3 kJ/kg[4]。高脂饮食饲料购自北京科奥协力饲料有限公司。每周监测大鼠体重和血糖。实验组喂养8周后将高脂组大鼠随机分为高脂(HF)组12只和二甲双胍干预(metformin intervention,MET)组12只,2组除继续喂以高脂饲料外,MET组用二甲双胍灌胃,剂量为200 mg·kg-1·d-1,每周称重1次,据此调整剂量;Con组应用标准饲料继续喂养8周。第16周末再次行钳夹实验评价各组IR情况。大鼠过夜空腹12 h,钳夹实验前颈动脉取血测定血糖,并分离血清于-70℃保存用于生化指标检测;钳夹实验结束后处死动物,留取肝脏标本-70℃保存备用。
2 高胰岛素-正葡萄糖钳夹实验[5]
实验前4~5 d在麻醉下行颈动脉和颈静脉埋植式插管术,在动物清醒、自由活动状态下行钳夹实验。将诺和灵R以13mU·kg-1·min-1的速度持续泵入,每10 min监测1次血糖,保持血糖在4.5~5.5 mmol/L范围内,达到稳态,进行120 min,计算葡萄糖输注率(glucose infusion rate,GIR)。
3 生化指标检测
大鼠尾静脉取血,离心后分离血清,将血清样品放入低温冰箱中保存,供测定时使用。血糖测定采用葡萄糖氧化酶法,使用美国强生公司(Life Scan)强生稳豪型OneTouch UltraEasy血糖仪。血清胰岛素采用放射免疫法测定(Linco Research)。血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)水平应用Beckman DXC 800型生化自动分析仪测定。
4 肝脏TG和TC含量分析
[6]方法进行,组织经氯仿/甲醇抽提后用全自动生化分析仪测定。称取100 mg组织标本放入1 mL氯仿/甲醇(体积比为2∶1)中,用电动匀浆器匀浆。匀浆移入干净试管中,在室温下摇动过夜,然后加入1 mL 0.6%氯化钠混匀,2000 r/min离心15 min使水与有机界面分开,底层的氯仿层小心移入玻璃管,用氮气吹干后再溶于适量乙醇中,用全自动生化分析仪(Beckman)测定。
5 实时定量real-time PCR方法检测基因表达
应用实时定量 PCR检测 LPIN1、AMPKα1、AMPKα2和β-actin mRNA的表达。采用Trizol试剂(Invitrogen)提取总RNA,取100 mg左右的肝脏组织,按照说明书操作,RNA于紫外分光光度计定量后于-80℃储存备用。采用反转录反应试剂盒合成cDNA,按照说明书操作。PCR反应条件:95℃3 min,93 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,40个循环;72℃ 10 min。于每个循环延伸反应最后时刻收集荧光信号。熔解曲线设置:95℃ 1 s,60℃ 2 min,以0.2℃/s的升温速度升温至95℃,升温时连续收集荧光信号。应用实时荧光定量PCR仪(ABI Prism 7500 Detection System)检测。PCR引物由上海生物工程公司合成,引物设计如下:AMPKα1正义链5'-CATTCTTGGTTGCCGAAACA-3', 反义链5'-TGTTTGGATTTCTGTGGGTT-3';AMPKα2正义链5'-TGTAAACACGGGAGGGTTGAA-3',反义链5'-GGCAGACAGAATCTGCTGGAA-3';LPIN1正义链5'-CGCCAAAGAATAACCTGGAA-3',反义链 5'-TGAAGACTCGCTGTGAATGG-3';β-actin正义链5'-TGGTGGACCTCATGGCCTAC-3',反义链5'-CAGCAACTGAGGGCCTCTCT-3'。
6 Western blotting方法检测蛋白水平表达
在冰冻缓冲液中研碎肝脏组织,提取蛋白,在4℃ 20000 r/min离心20 min,小心吸取上清,用BCA法,用标准蛋白拟合曲线,计算蛋白浓度,确定上样量。取50 μg蛋白在95℃温度下变性5 min,SDS-PAGE电泳并转移到PVDF膜。封闭1 h,应用p-AMPKα (Thr172)(Santa Cruz)、AMPKα1、AMPKα2(Abcam)和 LPIN1(Santa Cruz)抗体孵育,加5 μLⅡ抗(1∶2000稀释)与10 mL封闭缓冲液中充分混匀,加入硝纤膜。取出硝纤膜放入发光液,反复浇硝纤膜约5 min,取出硝纤膜,吸干过多液体,保鲜膜包裹硝纤膜,置于曝光盒中曝光、显影、定影。GAPDH为内参照,用多功能数字图像分析仪Kodak Digital Science ID软件进行分析。
7 统计学处理
结 果
1 一般情况和体重变化
实验组大鼠给予高脂饮食后,HF组大鼠与Con组相比,体重、空腹血糖、空腹胰岛素显著增高。血浆中和肝脏内TG、TC水平明显升高(P<0.01)。HF组动物 GIR值[(18.80±1.57)mg·kg-1·min-1]较 Con 组 [(24.31 ±2.65)mg·kg-1·min-1]显著降低(P<0.01),提示存在胰岛素抵抗。应用二甲双胍进行干预后,MET组体重、空腹胰岛素、空腹血糖、TG和TC水平均较HF组下降,有显著差异。MET组GIR值[(21.35±1.26)mg·kg-1·min-1]较HF组显著提高(P<0.05),提示胰岛素抵抗较HF组改善,见表1。
表1 3组大鼠体重、血清学指标以及肝脏脂肪含量的变化Table 1.Changes of body weight,serum indexes and hepatic lipid profiles in the three groups(.n=12)

表1 3组大鼠体重、血清学指标以及肝脏脂肪含量的变化Table 1.Changes of body weight,serum indexes and hepatic lipid profiles in the three groups(.n=12)
*P <0.05,** P <0.01 vs Con group;#P <0.05,##P <0.01 vs HF group.Con:control;BW:body weight;FBS:fasting blood sugar;FINS:fasting insulin;TG:triglyceride;TC:total cholesterol;GIR:glucose infusion rate;HF:high fat;MET:metformin.
Group BW(g)FBS(mmol/L)FINS(mU/L)TG(mmol/L)TC(mmol/L)GIR(mg·kg-1·min-1)TG in liver(mmol/g)TC in liver(mmol/g)Con 360±15 5.10±0.44 19.35±6.38 0.83±0.39 1.14±0.24 24.31±2.65 0.48±0.28 0.26±0.08 HF 438±24** 7.07±1.61* 23.70±7.37* 3.21±1.44** 3.04±1.62** 18.80±1.57** 0.89±0.31** 0.46±0.20**MET 380±18# 6.32±0.95# 18.19±4.27# 1.36±0.24## 1.85±1.39# 21.35±1.26# 0.57±0.29# 0.31±0.18#
2 LPIN1(mRNA和蛋白)表达
与对照组相比,HF组大鼠肝脏组织中LPIN1 mRNA表达水平显著降低(P<0.01),LPIN1蛋白表达水平减少(P<0.01)。应用二甲双胍干预后,大鼠LPIN1 mRNA表达水平较HF组增加(P<0.01);LPIN1蛋白表达水平增加(P<0.01),见图1、2。
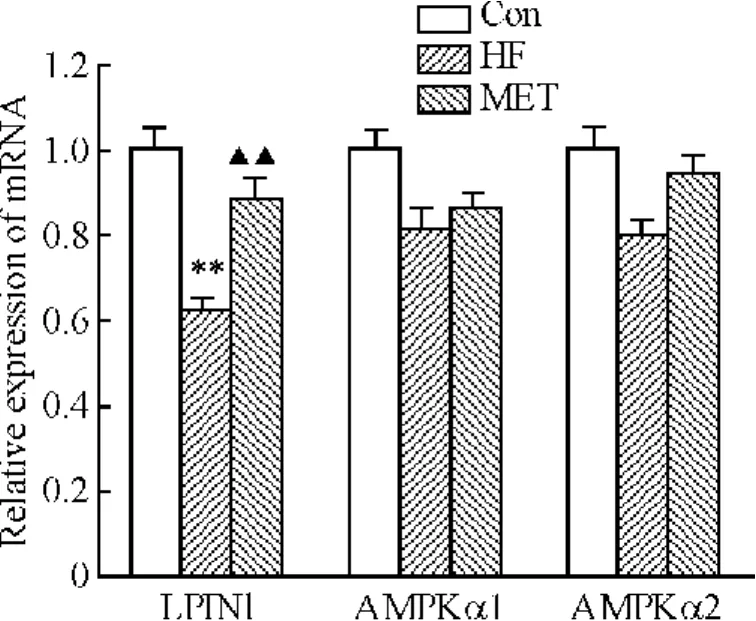
Figure 1.The mRNA expression of LPIN1,AMPKα1 ,and AMPKα2.**P < 0.01 vs Con group;▲▲P <0.01 vs HF group.图1 LPIN1、AMPKα1和AMPKα2 mRNA表达
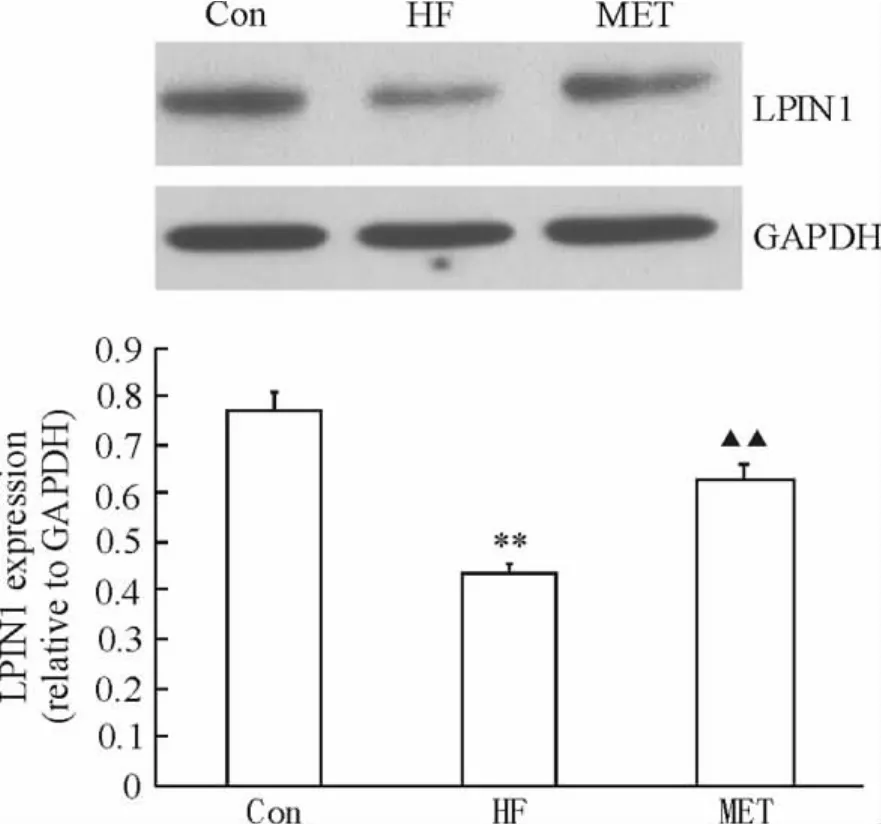
Figure 2.LPIN1 expression in rat livers in the three groups.**P< 0.01 vs Con group;▲▲P<0.01 vs HF group.图2 3组大鼠中肝脏LPIN1蛋白表达
3 AMPKα(mRNA和蛋白)和 p-AMPKα活性变化
3组大鼠肝脏组织AMPKα1和AMPKα2 mRNA和蛋白表达均无显著差异。与Con组大鼠相比,HF组大鼠p-AMPKα(Thr-172)蛋白表达显著降低(P<0.01);与HF组相比,应用二甲双胍干预后p-AMPKα(Thr-172)的表达明显增加(P<0.01),见图 1、3。
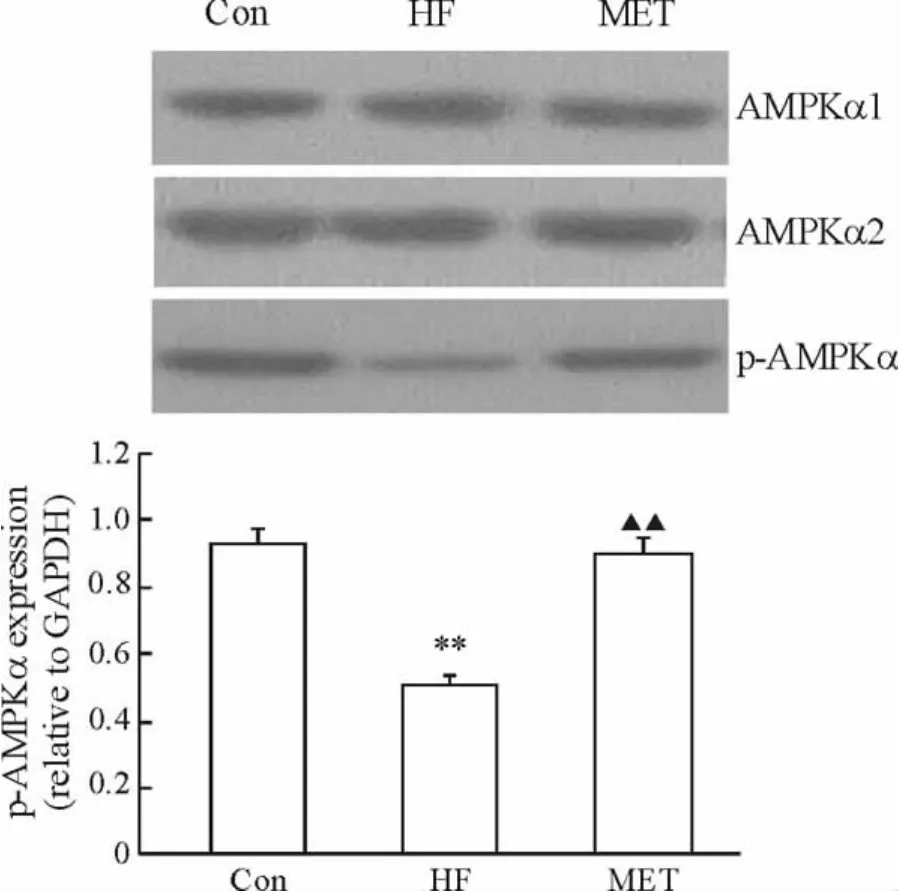
Figure 3.AMPKα1,AMPKα2 and p-AMPKα expression in rat livers in the three groups.** P < 0.01 vs Con group;▲▲P <0.01 vs HF group.图3 3组动物肝脏中 AMPKα1、AMPKα2和 p-AMPKα蛋白表达
讨 论
Lipin是双向调控身体脂肪代谢的一个家族,由脂素基因(LPIN)所表达产生,包括LPIN1、LPIN2和LPIN3。LPIN1在脂肪组织、肝脏、骨骼肌、心脏等多种组织表达[7],在脂质合成和基因表达方面有双重作用,一是作为磷脂酸磷酸酶 (PAP)1发挥促进甘油三酯、磷脂合成作用;二是作为转录协同刺激因子联系肝过氧化物酶体增殖物活化受体(PPAR)γ协同刺激因子1α(PGC1α)和PPARα,调节脂肪酸利用和脂肪合成基因表达[7-8]。研究证明LPIN1和胰岛素抵抗密切相关,aP2转基因鼠中LPIN1的表达和胰岛素敏感性有关,其肝脏和脂肪组织中LPIN1表达水平与血浆胰岛素浓度负相关,而给予HepG2细胞中高胰岛素环境后LPIN1表达下调[8]。芬兰的研究发现人类脂肪组织中LPIN1 mRNA表达水平与血糖、胰岛素、胰岛素抵抗等负相关[9]。健康男性中的LPIN1 mRNA与运动过程中呼吸商、氧消耗等相关,与脂肪酸代谢相关蛋白包括PPAR等表达正相关[10]。Harris等[11]研究发现在胰岛素信号通路中LPIN1是下游靶基因,在胰岛素的刺激作用下,LPIN1蛋白丝氨酸、苏氨酸位点磷酸化。
肝脏是能量代谢的重要器官,也是胰岛素作用的主要靶器官,维持空腹状态下内生性糖的产生和输出、进食后糖的吸收、利用和存储。本研究采用高脂饮食造模,显示与对照组相比,高脂组大鼠体重、空腹血糖、胰岛素、血浆和肝脏中TG、TC水平显著升高。应用高胰岛素-正葡萄糖钳夹实验评价胰岛素抵抗,结果提示高脂饮食组大鼠的GIR显著降低(P<0.01),LPIN1表达明显下调;应用二甲双胍干预后GIR值明显增加,胰岛素抵抗改善,而LPIN1表达水平也显著增加,提示LPIN1与胰岛素抵抗可能存在相关性。
具有胰岛素增敏作用的口服降糖药物二甲双胍,近年来被证实为AMPK激活剂。它可通过激活AMPK抑制肝糖异生,脂质合成,促进肌肉对葡萄糖的摄取和利用。在肝细胞中二甲双胍首先激活AMPK,AMPK中α亚单位(包括α1和α2)是催化亚单位,α亚基上172位苏氨酸磷酸化后,可使乙酰辅酶A羧化酶失活,减少胞浆内丙二酰辅酶A的含量,促进细胞内脂肪酸氧化,调节细胞内糖脂代谢,Liu等[12]发现长期高脂环境可以显著降低大鼠骨骼肌AMPKα表达和活性,证实AMPKα参与高脂环境诱导胰岛素抵抗发生的机制。而本研究显示高脂组大鼠肝脏中AMPKα表达无明显改变,p-AMPKα(Thr-172)磷酸化水平显著降低,二甲双胍干预后p-AMPKα(Thr-172)表达水平较高脂组显著增加,提示在胰岛素抵抗发生以及二甲双胍干预过程中主要是AMPKα活性的改变,与文献资料[1]相符。许多脂肪因子,如瘦素、脂联素,可通过AMPK在骨骼肌和肝脏中发挥作用。瘦素在外周组织通过AMPK活化而增加葡萄糖的摄取[13]。脂联素改善代谢的过程与肝脏中AMPK激活进而减少脂肪酸合成,增加线粒体脂肪酸氧化等有关[14]。LPIN1作为一种新的脂肪因子,与胰岛素抵抗相关,除了已知的上述两方面作用机制以外,是否与AMPK通路有关?目前此方面研究较少。Higashida等[15]应用 AMPK激活剂AICAR处理大鼠股三头肌6 h后,LPIN1 mRNA表达水平显著增加。我们的研究结果显示高脂动物模型中,应用AMPK的另一种激活剂二甲双胍干预后AMPKα活性明显改善,肝脏LPIN1基因以及蛋白表达均较 HF组明显增加,进一步提示大鼠肝脏中LPIN1在AMPK信号通路中可能存在作用,AMPK信号通路的激活可以增加LPIN1表达水平,进而调节糖脂代谢,在胰岛素抵抗发生发展过程中起到调控作用。
总之,本研究证明在饮食导致的肥胖大鼠肝脏中LPIN1蛋白表达、p-AMPKα(Thr-172)磷酸化水平减少,二甲双胍干预后二者表达水平增加。然而,该研究也存在一些不足之处。首先,LPIN1 mRNA通过选择性剪接产生2个蛋白质异构体LPIN1α和LPIN1β,它们在不同位点共同调节糖脂代谢[2]。本研究中的引物和抗体不能区别2种异构体。另外,本研究在基因和蛋白表达水平提示LPIN1可能在AMPK信号通路中存在潜在作用,未来研究可通过转基因或基因沉默方法进一步验证LPIN1和AMPK信号通路之间的确切调控机制。
[参考文献]
[1]Pandzi Jaksi V.Adipocytokines as mediators of metabolic role of adipose tissue[J].Acta Med Croatica,2010,64(4):253-262.
[2]Peterfy M,Phan J,Reue K.Alternatively spliced lipin isoforms exhibit distinct expression pattern,subcellular localization,and role in adipogenesis[J].J Biol Chem,2005,280(38):32883-32889.
[3]Viollet B,Horman S,Leclerc J,et al.AMPK inhibition in health and disease[J].Crit Rev Biochem Mol Biol,2010,45(4):276-295.
[4]Zhang M,Lv XY,Li J,et al.The characterization of high-fat diet and multiple low-dose streptozotocin induced type 2 diabetes rat model[J].Exp Diabetes Res,2008,2008:704045.
[5]Muniyappa R,Lee S,Chen H,et al.Current approaches for assessing insulin sensitivity and resistance in vivo:advantages,limitations,and appropriate usage[J].Am J Physiol Endocrinol Metab,2008,294(1):E15-E26.
[6]Virkamäki A,Korsheninnikova E,Seppälä-Lindroos A,et al.Intramyocellular lipid is associated with resistance to in vivo insulin actions on glucose uptake,antilipolysis,and early insulin signaling pathways in human skeletal muscle[J].Diabetes,2001,50(10):2337-2343.
[7]Phan J,Péterfy M,Reue K.Lipin expression preceding peroxisome proliferator-activated receptor-γ is critical for adipogenesis in vivo and in vitro[J].J Biol Chem,2004,279(28):29558-29564.
[8]van Harmelen V,Rydén M,Sjölin E,et al.A role of lipin in human obesity and insulin resistance:relation to adipocyte glucose transport and GLUT4 expression[J].J Lipid Res,2007,48(1):201-206.
[9]Wiedmann S,Fischer M,Koehler M,et al.Genetic variants within the LPIN1 gene,enconding lipin,are influencing phenotypes of the metabolic syndrome in humans[J].Diabetes,2008,57(1):209-217.
[10]Donkor J,Sparks LM,Xie H,et al.Adipose tissue lipin-1 expression is correlated with peroxisome proliferatoractivated receptor α gene expression and insulin sensitivity in healthy young men[J].J Clin Endocrinol Metab,2008,93(1):233-239.
[11]Harris TE,Huffman TA,Chi A,et al.Insulin controls subcellular localization and multisite phosphorylation of the phosphatidic acid phosphatase,lipin 1 [J].J Biol Chem,2007,282(1):277-286.
[12]Liu Y,Wan Q,Guan QB,et al.High-fat diet feeding impairs both the expression and activity of AMPKα in rats'skeletal muscle [J].Biochem Biphys Res Conmmun,2006,339(2):701-707.
[13]Morris DL,Rui L.Recent advances in understanding leptin signaling and leptin resistance[J].Am J Physiol Endocrinol Metab,2009,297(6):E1247-E1259.
[14]Lele RD.Pro-insulin,C peptide,glucagon,adiponectin,TNF alpha,AMPK:neglected players in type 2 diabetes mellitus[J].J Assoc Physicians India,2010,58(30):35-40.
[15]Higashida K,Higuchi M,Terada S.Potential role of lipin-1 in exercise-induced mitochondrial biogenesis[J].Biochem Biophys Res Commun,2008,374(3):587-591.
