锌对酒精性肝损害小鼠保护作用的研究
2011-07-30张素云许秀举
张素云,许秀举
1.内蒙古自治区包头市蒙医中医医院消化内科,内蒙古包头 014040;2.包头医学院,内蒙古包头 014040
随着人们生活水平的提高及经济活动日趋活跃,饮酒人数越来越多,现在饮酒已经成为很多人生活中必不可少的一部分。但酒精引起的相关疾病也逐渐被人们所认识。酒精可引起肝脏、胃、心脏、脑组织等多个脏器的损害,尤其是酒精性肝病发病率最高。酒精性肝病已成为男性的第四大死因[1]。目前,解酒保肝已成为医学界与生物界迫切需要解决的问题。本研究采用一次大剂量白酒灌胃的方法,制作白酒模型[2],探讨急性大量饮酒对肝组织酶的影响以及不同剂量锌对急性酒精性肝损害小鼠的干预作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 昆明种小鼠,均为雄性,体重18~24 g,由内蒙古大学实验动物中心提供,为清洁级动物。合格证号为SCXKC蒙2002-0001。
1.1.2 主要试剂 葡萄糖酸锌,北京高科药物有限责任公司生产;红星二锅头酒,红星股份有限公司生产;谷胱甘肽过氧化酶(GSH-Px)、丙二醛(MDA)、肝组织谷丙转氨酶(ALT)、肝组织谷草转氨酶(AST)测定试剂盒,均由南京建成生物工程研究所提供。
1.2 实验方法
1.2.1 动物分组及处理 将50只健康昆明种小鼠(均为雄性)随机分为5组,每组各10只,分别为空白对照组,白酒对照组和锌低、中、高3个剂量组,含锌剂量分别为1.25、2.50、5.00mg/kg。其中空白对照组和白酒对照组饮用自来水;其他各组饮用自由溶于水的锌溶液。各组大鼠均采用自由饮用的方式,连续饮用30 d。在实验期间,每周称一次体重,观察小鼠的一般状况。第30天时对小鼠进行空腹白酒灌胃实验。实验时采用一次大剂量白酒灌胃的方法[2],按12 ml/kg体重对各组小鼠进行灌胃,16 h后处死小鼠,取小鼠肝组织,测定各项指标。
1.2.2 肝组织匀浆的制备 处死小鼠后立即打开腹腔取出肝组织,制成组织匀浆。组织匀浆用低温离心机离心10 min,取适量上清液进行MDA、GSH-Px、ALT、谷AST的测定。
1.2.3 各项生化指标测定 肝匀浆谷胱甘肽活性、MDA含量测定:采用二硫代对硝基苯甲酸法(DTNB法)测定肝匀浆中GSH-Px,硫代巴比妥酸法(TBA法)测定肝匀浆中MDA含量。肝匀浆ALT、AST含量测定:采用赖氏法测定,按试剂盒说明操作进行。
1.3 统计学分析
采用SPSS 11.5统计软件包进行分析,计量资料数据均以均数±标准差 (±s)表示。采用单因素方差分析 (One-Way ANOVA)比较组间差异。
2 结果
2.1 实验动物的一般情况
在整个实验过程中,所有小鼠活动正常,健康状况良好,无死亡现象发生。随着实验的进行,各组小鼠体重逐渐增加,但各组间平均体重比较,差异无统计学意义(P>0.05)
2.2 小鼠肝组织酶测定结果
见表1。由表1可见,白酒对照组及各剂量锌组与空白对照组比较,肝组织谷胱甘肽明显下降,差异有高度统计学意义(P<0.01)。各剂量锌组与白酒对照组比较稍有升高,但差异无统计学意义(P>0.05)。说明饮白酒可使肝组织受损,谷胱甘肽过氧化物酶明显下降,但葡萄糖酸锌干预对肝组织的谷胱甘肽保护作用不明确。
表1 小鼠肝组织谷胱甘肽测定结果[±s,mmol/(kg·min)]
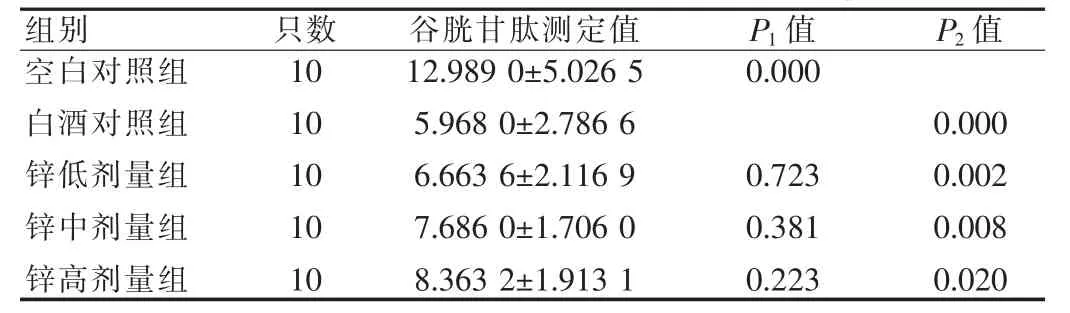
表1 小鼠肝组织谷胱甘肽测定结果[±s,mmol/(kg·min)]
注:P1值表示与白酒对照组比较,P2值表示与空白对照组比较
?
2.3 小鼠肝组织丙二醛测定结果
见表2。从表2可见,白酒对照组与空白对照组相比,肝组织丙二醛明显升高,差异有高度统计学意义(P<0.01)。各剂量锌组与白酒对照组比较明显降低,差异有高度统计学意义(P<0.01)。说明饮白酒可使肝组织受损,丙二醛明显升高,经葡萄糖酸锌干预可使肝组织中丙二醛下降。
表2 小鼠肝组织丙二醛测定结果(±s,μmol/g)
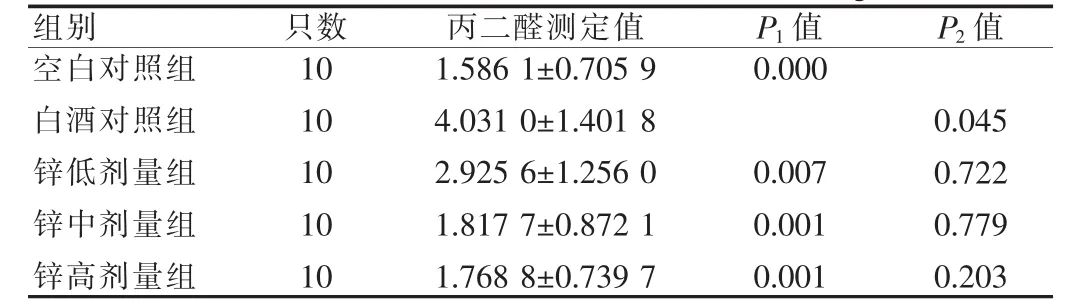
表2 小鼠肝组织丙二醛测定结果(±s,μmol/g)
注:P1值表示与白酒对照组比较,P2值表示与空白对照组比较
P2值空白对照组白酒对照组锌低剂量组锌中剂量组锌高剂量组组别 只数1010101010丙二醛测定值1.5861±0.70594.0310±1.40182.9256±1.25601.8177±0.87211.7688±0.7397 P1值0.0000.0070.0010.0010.0450.7220.7790.203
2.4 小鼠肝组织谷丙转氨酶测定结果
见表3。由表3可见,白酒对照组与空白对照组相比,肝组织谷丙转氨酶明显升高,差异有统计学意义(P<0.05),不同剂量锌干预与白酒对照组相比,谷丙转氨酶有所下降,仅高剂量锌组与白酒对照组相比,差异有统计学意义(P<0.05)。说明葡萄糖酸锌对酒精性肝损害小鼠谷丙转氨酶影响与剂量相关。
表3 小鼠肝组织谷丙转氨测定结果(±s,U/L)
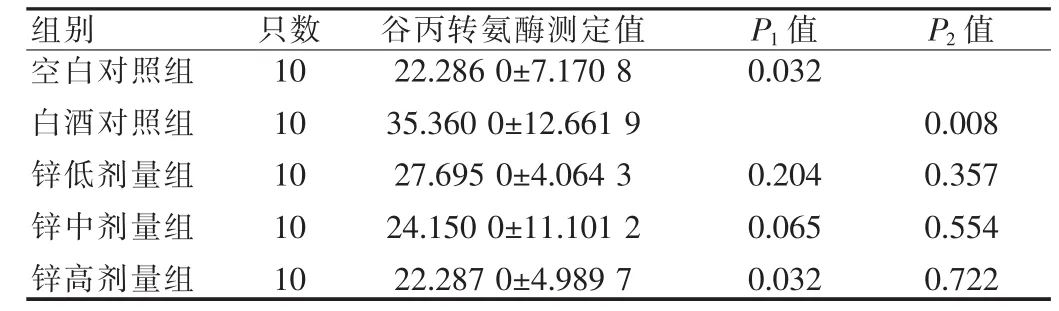
表3 小鼠肝组织谷丙转氨测定结果(±s,U/L)
注:P1值表示与白酒对照组比较,P2值表示与空白对照组比较
P2值组别 只数1010101010空白对照组白酒对照组锌低剂量组锌中剂量组锌高剂量组谷丙转氨酶测定值22.2860±7.170835.3600±12.661927.6950±4.064324.1500±11.101222.2870±4.9897 P1值0.0320.2040.0650.0320.0080.3570.5540.722
2.5 小鼠肝组织谷草转氨酶测定结果
见表4。从表4可以看出,白酒对照组与空白对照组相比,肝组织谷草转氨酶明显升高,差异有统计学意义(P<0.05),不同剂量锌干预与白酒对照组相比,谷草转氨酶有所下降,中、高剂量锌组与白酒对照组相比,差异有统计学意义(P<0.05)。说明葡萄糖酸锌对酒精性肝损害小鼠谷草转氨酶有影响。
表4 小鼠肝组织谷草转氨酶测定结果(±s,U/L)
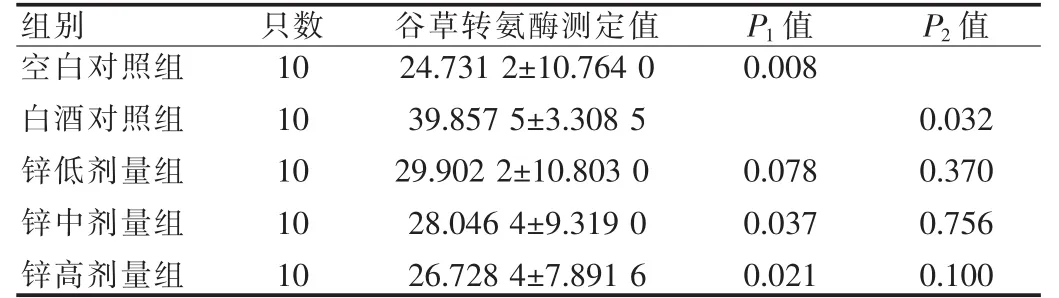
表4 小鼠肝组织谷草转氨酶测定结果(±s,U/L)
注:P1值表示与白酒对照组比较,P2值表示与空白对照组比较
?
3 讨论
酒精引起急慢性肝损害的原因非常复杂,研究普遍认为与脂质过氧化、炎症介质、内毒素、细胞因子和免疫调节等多种因素有关[3-4]。有研究证实,脂质过氧化在酒精性肝病发生、发展中起重要作用[5],从某种角度上来讲,脂质过氧化是机体正常生理过程,但过度的脂质过氧化却可以造成肝脏损伤[6]。抑制脂质过氧化反应是减轻肝脏损害的有效途径。目前,国内外陆续有报道,N-乙酰半胱氨酸、卵磷脂及很多中药,如三七、丹参、枳黄芳、决明子、鹿茸等对酒精性肝损伤具保护作用,其机制均与其抗氧化作用有关。但微量元素锌对酒精性肝损伤保护作用研究很少。锌是人体内的含量仅次于铁的15种微量元素之一,具有抗氧化作用,能抑制脂质过氧化或硫醇氧化,维持生物膜的正常生理功能。本研究利用锌的抗氧化作用来观察其对急性酒精性肝损害的营养保护作用。MDA是氧自由基与生物膜多不饱和脂肪酸发生脂质过氧化的产物,与氧自由基的量一致,GSH-Px是细胞内抗脂质过氧化作用保护系统的主要成分,不仅是肝细胞损伤的标志,也反映体内对脂质过氧化拮抗能力的高低,所以,本研究以MDA和 GDH-Px作为反映机体脂质过氧化水平。ALT、AST是肝细胞受损后主要释放的酶,其测定结果直接可反映肝细胞损伤程度,故本项研究将其列为观察指标。常用的锌源包括无机锌、有机合成锌和有机锌,它们的生物学效价存在很大差异。本项研究中所使用的是葡萄糖酸锌,是有机合成锌。
本研究结果显示:①白酒可造成急性酒精中毒小鼠肝脏功能及脂质过氧化损害。②锌对酒精性肝损害小鼠具保护作用,并且与锌剂量相关,在允许范围内,锌剂量越大,保护作用越强。在本研究中,各剂量组葡萄糖酸锌均可使谷胱甘肽过氧化物酶升高,但与白酒对照组相比,差异无统计学意义,与理论不相符[4,7],分析可能有以下原因:①实验动物的样本数较少,结果离散度较大。②可能与锌源类型有关,不同锌源吸收、利用度不同。③与乙醇处理的剂量和时间、动物品系及小鼠灌白酒后处死时间有关。为此,在今后的科研工作中笔者建议尽量增加样本量,选择吸收、利用度更好的锌源,如氨基酸螯合锌,同时增加测定肝组织中酶的种类,如一氧化氮、超氧化物歧化酶、乙醇脱氢酶,试图找到更能反映锌对酒精性肝损害起保护作用的酶类,为锌对酒精性肝损害起保护作用提供理论依据。
[1]Ronaid GT,Blar UB,Iimuro Y,et al.Role of kuffer cell,endotoxin,and free radicals in hepatoxicity due to prolonged alcohol consumption:studies in female and male rats[J].J Nutr,1997,127(suppl):903-906.
[2]段荟,付成效,绉瑾.黄芪对酒精性肝损伤小鼠MDAGSH和TG的影响及肝脏保护作用的研究[J].陕西医学杂志,2010,39(3):271-272.
[3]McClain CJ,Barve S,Barve S,et al.Tumor necnosis factor and alcoholic liver disease[J].Alcohol Clin Exp Res,1998,22(5 suppl):248-252.
[4]杜时雨,房龙.脂质过氧化反应大鼠急性酒精性肝损害中的作用[J].胃肠病学和肝病学杂志,2008,17(7):600-602.
[5]Arteel GE.Oxidants and antioxidants in alcohol-induced liver disease[J].Gastroenterology,2003,124(1):778-790.
[6]Hoek JB,Pastorino JG.Ethanol oxidative stress and cylokine-induced liver cell injury[J].Alcohol,2002,27(2):63-68.
[7]Enty B,Berson A,Pessayre D.Microvesicular steatosis and steatohepatitis role of mitochondrial dysfunction and lipid peroxidation[J].J Hepatol,1997,26(suppl 1):13-22.
