红花提取物对肾缺血再灌注损伤的影响
2011-07-30曹译心张翠薇马跃荣
曹译心 ,张 旭 ,张翠薇 ,何 颖 ,马跃荣
1.泸州医学院组织学与胚胎学教研室,四川泸州 646000;2.泸州医学院病理教研室,四川泸州 646000;3.泸州医学院药学院中药学实验室,四川泸州 646000
肾脏缺血再灌注损伤(ischemia reperfusion injury,IRI)是常见的临床疾病,可导致急性肾功能衰竭。红花是治疗慢性肾脏疾病常用的活血化瘀药物,有一定的临床疗效,但在IRI方面尚无研究。本研究建立IRI大鼠模型并利用红花提取物进行干预,旨在观察红花提取物是否对IRI具有保护作用。
1 材料与方法
1.1 实验动物
动物为清洁级、健康9周龄SD大鼠,雌雄不拘,体重180~220 g,均由泸州医学院动物实验中心提供。
1.2 主要试剂
红花注射液(主要成分:红花黄色素、红花醌苷、红花素、新红花苷,20 ml/支;十堰麦克制药有限公司)。大鼠血肌酐(Scr)和尿素氮(BUN)试剂盒(购自上海碧云天生物技术有限公司)、内皮素-1(ET-1)放免试剂盒(购自北京经纬博恒生物科技开发有限公司)、超氧化物歧化酶(superoxide dismutase,SOD)和血丙二醛(MDA)检测试剂盒(南京建成生物医学公司)。
1.3 方法
1.3.1 实验分组 将40只大鼠随机分为4组(每组各10只):缺血再灌注组(阳性对照组)、假手术组(阴性对照组)、红花低剂量干预组和红花高剂量干预组。按照文献[1]的方法处理如下:均以戊巴比妥钠(5 mg/kg)腹腔麻醉,腹部正中切口,暴露双侧肾,之后各组分别处理如下,①缺血再灌注组,缺血前10 min,肾静脉给予等容积生理盐水,夹闭双侧肾动脉,60min后去除动脉夹,同法再给生理盐水,缝合切口。24 h后各组大鼠以1.5%戊巴比妥钠(40 mg/kg)腹腔麻醉后,腹部正中切开,于下腔静脉采血;同时取双肾。②假手术组,不夹闭双侧肾动脉,不给生理盐水,其余同缺血再灌注组。③红花低剂量干预组和红花高剂量干预组分别以10 ml/kg和20 ml/kg的红花注射液代替生理盐水,其余同缺血再灌注组。
1.3.2 检测方法 采集的血液经离心后取血清按试剂盒方法分别测定Scr、BUN和MDA的的含量。取一侧肾按其重量加生理盐水制成10%的组织匀浆,按试剂盒方法测定SOD,同时用放免法测定肾组织ET-1含量。取另一侧肾进行石蜡切片行HE染色。
1.3.3 肾脏的病理学观察 肾组织以中性缓冲甲醛固定,石蜡包埋,切成4 μm厚的切片,行HE染色,用普通光学显微镜检查。观察肾缺血再灌注后肾小球、肾小管充血、变性、坏死及白细胞浸润等病理变化。
1.4 统计学分析
采用SPSS 16.0统计软件进行分析,计量资料数据以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 肾功能指标的变化
假手术组Scr及BUN含量均低于其他各组,差异有高度统计学意义(P<0.01);缺血再灌注组和红花低剂量干预组之间比较,差异无统计学意义(P>0.05);但红花高剂量干预组明显低于缺血再灌注组和和红花低剂量干预组,差异有统计学意义(P<0.05)。 见表1。
表1 各组大鼠Scr和BUN的变化(±s)
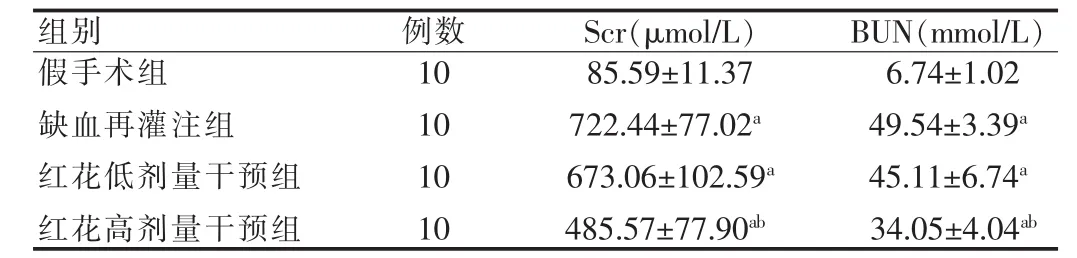
表1 各组大鼠Scr和BUN的变化(±s)
注:与假手术组比较,aP<0.01;与缺血再灌注组和红花低剂量干预组比较,bP<0.05
组别 例数10101010假手术组缺血再灌注组红花低剂量干预组红花高剂量干预组Scr(μmol/L)85.59±11.37722.44±77.02a 673.06±102.59a 485.57±77.90ab BUN(mmol/L)6.74±1.0249.54±3.39a 45.11±6.74a 34.05±4.04ab
2.2 ET-1、SOD和MDA检测
ET-1的含量水平,假手术组均低于其他各组,差异有高度统计学意义(P<0.01);缺血再灌注组和红花低剂量干预组之间比较,差异无统计学意义(P>0.05);红花高剂量干预组明显低于缺血再灌注组和和红花低剂量干预组 (P<0.05)。SOD的含量水平,假手术组均高于其他各组(P<0.01);红花低剂量干预组和红花高剂量干预组之间比较,差异无统计学意义(P>0.05),但二者都同时高于缺血再灌注组(P<0.05)。MDA的含量水平,假手术组均低于其他各组(P<0.01);红花低剂量干预组和红花高剂量干预组之间比较,差异无统计学意义(P>0.05),但二者都同时低于缺血再灌注组(P<0.05)。见表2。
表2 各组大鼠ET-1、SOD和血MDA的变化(±s)
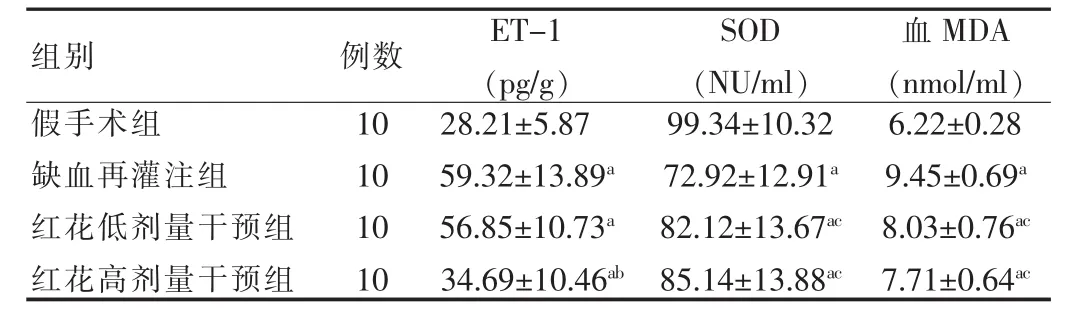
表2 各组大鼠ET-1、SOD和血MDA的变化(±s)
注:与假手术组比较,aP<0.01;与缺血再灌注组和红花低剂量干预组比较,bP<0.05;与缺血再灌注组比较,cP<0.05
?
2.3 病理组织学改变
除假手术组外,各组均出现不同程度的肾小球毛细血管扩张充血,肾小球囊腔扩张,肾小管上皮细胞空泡样变性,近曲小管管壁肿胀,管腔变小及少量炎症细胞浸润。其中,以缺血再灌注组最重,甚至还出现肾小管上皮细胞颗粒样变以及明显的肾小管坏死、管腔堵塞和刷状缘脱落。此外,肾小管腔可见炎症细胞和蛋白管型,而红花高剂量干预组最轻。见图1。
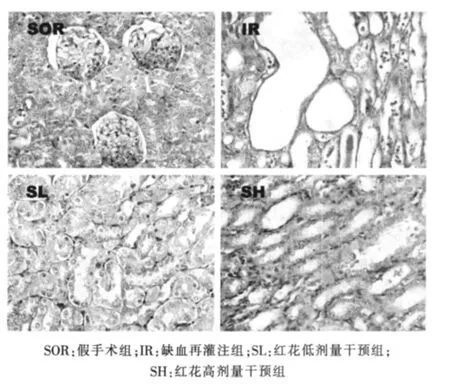
图1 各组大鼠肾组织病理学改变(HE染色,×400)
3 讨论
IRI属急性肾损伤的范畴,在临床上十分常见,但目前尚无有效的防治方法。IRI所致的急性肾功能衰竭在临床较为常见,IRI系氧自由基引起的微循环血流障碍以及由细胞因子介导的对内皮细胞及实质细胞的免疫损伤。缺血期间,首先造成器官的ATP储备衰竭,继而通过无氧代谢提供能量,表现为糖酵解增加。灌注早期,大量注入的血氧一时不能充分利用,作为各种氧化酶的底物而产生氧自由基。再灌注时往往存在红细胞外渗,同时红细胞又易受到氧自由基的攻击,出现形态改变和聚积,导致血液黏度增加,红细胞溶解,进而产生大量血红蛋白。血红蛋白通过损伤脂质双分子层、细胞骨架、细胞代谢酶及DNA,并促进氧自由基产生,从而加重内皮细胞损伤[2]。本研究结果显示缺血再灌注后大鼠的Scr和BUN显著上升,说明其肾功能显著减退,表明IRI对肾功能影响显著。
红花属菊科植物,其主要活性成分有红花黄素、脂肪酸、黄酮醇类、红花多糖、链烷双醇、豆甾醇和红花胺等。红花有活血通经、去瘀止痛的功能[3]。红花提取物能抑制血小板聚集,降低血液黏度,其有效成分红花黄色素能延长凝血酶原时间和凝血酶时间[4]。
SOD是广泛存在于需氧物体内的一种金属酶,能催化超氧阴离子自由基产生歧化反应,是体内最为重要的自由基清除剂。可以歧化O2生成H2O2,从而保护细胞不受毒性氧自由基损伤[5]。MDA是机体内氧自由基代谢中产生的脂质过氧化产物,它可以反映该体系中脂质过氧化自由基的存在及反应的程度,引发细胞膜大分子物质(如蛋白、脂质等)相互交联、聚合,从而加重细胞膜变性和功能障碍[6]。
本实验结果显示相对假手术组,缺血再灌注组SOD含量显著减少,MDA含量显著升高,BUN、Scr明显增加。表明缺血再灌注后,肾组织因为SOD的显著减少,清除氧自由基的能力降低,导致肾结构被破坏,同时功能下降。同时本实验应用红花提取物干预缺血再灌注损伤过程,发现相对没有使用红花提取物干预的组分,干预组SOD含量较高,MDA含量明显较低,而对应的BUN、Scr明显较低,说明红花提取物可能能在一定程度上维持缺血性肾脏组织中的SOD活性,进而可以保持较高的氧自由基清除能力而起到保护肾脏的作用。
综上所述,本研究发现红花提取物可以减轻IRI的程度,可改善相应的肾功能。但其具体机制有待进一步研究。
[1]谢智慧,曹瑞,陈宗,等.高压氧干预对大鼠肾缺血再灌注损伤保护作用的实验研究[J].中华物理医学与康复杂志,2010,32(2):98-101.
[2]梁钢,黄巨恩,张肃,等.表没食子儿茶素没食子酸酯对肾缺血再灌注损伤的保护作用[J].中国药理学通报,2003,19(1):97-100.
[3]郭晓凤.中药红花的研究进展[J].中国民族民间医药,2008,17(2):73-74.
[4]贾菲菲,柴秋彦,贾俊.红花黄色素B抗凝作用研究[J].山西中医学院学报,2009,10(3):13-15.
[5]杨佳丹,董志,欧阳净.两维来司钠对实验性大鼠脑缺血再灌注损伤的保护作用[J].重庆医科大学学报,2007,32(6):578-580.
[6]Patel NS,Sharples EJ,Cuzzocrea S,et al.Pretreatment with EPO reduces the injury and dysfunction caused by ischemia/reperfusion in the mouse kidney in vivo[J].Kidney Int,2004,66(3):983-989.
