干旱胁迫对橙红丹桂叶片光合性能的影响
2011-07-30吴家胜
刘 鹏,张 雪,吴 江,梅 丽,吴家胜
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300)
在自然条件下,干旱胁迫是环境胁迫的重要因子之一,干旱胁迫对植物生长和代谢的影响是多方面的,其中对光合作用的影响尤为突出[1~2],而光合作用又是植物体内重要的代谢过程,它的强弱对植物生长发育及抗逆性都有重要影响,因而可用光合作用参数作为判断植物生长和抗逆性强弱的指标[3~4]。
桂花(Osmanthus fragrans)属于木犀科(Oleaceae)木犀属(Osmanthus),树干端直,树冠圆整,四季长青,花期正值仲秋,香飘数里,是我国人民喜爱的传统园林花木,同时桂花也是香精、药材、食品和轻工业等的宝贵原料。桂花主要分布于我国长江流域各省及华南地区,不耐寒冷干燥,在干旱瘠薄地种植,生长瘦长,发育不良。目前,有关桂花的研究主要集中在品种分类、精油含量、桂花的繁殖、培养和管护、生长发育过程中的相关指标变化[5]。对桂花的光合作用也有初步研究[5~9],但均不系统和深入,对干旱胁迫下桂花光合性能的研究更少且研究内容和方法相对简单不全面[9]。本文较系统地研究了干旱胁迫对桂花光合性能的影响,通过分析初步判断桂花对干旱胁迫和光照强度的适应性,为桂花的栽培和管护以及在干旱和半干旱地区的推广提供理论依据。
1 实验材料和方法
1.1 试验材料
供试苗木为3年生橙红丹桂(Osmanthus fragrans“Chenghongdangui”)扦插容器苗(由杭州园林绿化工程有限公司提供),生长状况和外形基本一致,平均苗高为26.5 cm,平均地径为4.56 mm。2008年3月将橙红丹桂移栽到容量为5 L的硬质塑料花盆中,栽培基质为临安牧家桥附近花岗岩发育的沙壤土,装盆土量为3.5 kg,其土壤的田间持水量为28.8%,pH值为6.16,速效钾浓度为65.87 mg/kg,有效磷浓度为4.02 mg/kg,水解氮浓度为112.03 mg/kg,有机质含量为24.2 g/kg,并在盆下再套一个塑料托盆,防止水肥和基质的流失。实验前期进行常规的管护,防病虫害,除去杂草,并保证土壤水肥充足。
1.2 试验设计及处理
本实验在浙江农林大学东湖校区简易大棚内进行,采用盆栽控水法人工模拟干旱胁迫,设置5个不同梯度的干旱处理:15%土壤田间持水量(W1)、30%土壤田间持水量(W2)、45%土壤田间持水量(W3)、60%土壤田间持水量(W4)和75%土壤田间持水量(ck)。每个处理30盆。采用随机区组实验设计。利用称重法控制土壤含水量,于2008年7月20日开始进行干旱处理,7月23日各处理的土壤含水量均达到实验要求的水平,于每日7:00测定每个梯度的土壤含水量,并补足水分,使土壤含水量控制在设定的梯度之内。
1.3 指标测定和数据处理方法
于干旱处理后的第7、第14、第21、第28天,选第二到第三轮生长健康的功能叶测量其光合生理生态指标,并于第15天进行光响应曲线和CO2响应曲线的测定。每个处理重复测定5次,测定时间均为9:30-11:30和14:00-16:00,晴天测定(遇阴雨天则适当提前或延后),测定期间日平均温度为30.4℃,平均湿度为71.3%。
1.3.1 同一光强、温度、CO2浓度条件下的光合生理指标测定 采用美国Licor公司生产的Li-6400便携式光合测定系统进行净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等光合气体交换参数测定,并计算水分利用效率(WUE),WUE=Pn/Tr。测定时,设定光合有效辐射(PAR)为1200 µmol·m-2·s-1、进气 CO2浓度(Ca)为 450 µmol·mol-1、流速为 500 μmol·s-1、温度为(29±1)℃。
1.3.2Pn、Gs、Ci和Tr的光响应曲线测定 利用Li-6400便携式光合测定仪进行光响应曲线的测定。测定条件:光合有效辐射(PAR)设定为 2000、1500、1200、800、400、200、150、100、50 和 0 µmol·m-2·s-1、进气CO2浓度(Ca)设为 450 μmol·mol-1、流速为 500 μmol·s-1、温度为(29±1)℃。
1.3.3 CO2响应曲线测定 利用Li-6400便携式光合测定仪进行CO2响应曲线的测定。测定条件:光合有效辐射(PAR)设定为 1200 µmol·m-2·s-1,进气 CO2浓度(Ca)设为 0、50、100、150、200、400、600、800 μmol·mol-1、空气流量为 400 μmol·s-1、温度为(29±1)℃。
1.4 数据统计分析
数据处理在Excel 2007中进行,并通过SAS 8.0统计软件对数据进行方差和多重比较分析。通过对Pn-PAR进行线性拟合,分别求出光饱和点(LSP),并对Pn-PAR曲线的初始部分(PAR< 200 µmol·m-2·s-1)进行线性回归,求得表观量子效率(AQY)、光补偿点(LCP);在0 ~ 200 μmol·mol-1的CO2浓度范围内,对Pn-Ci进行线性拟合,求出表观羧化效率(ACE)、CO2补偿点(CCP)[7],在0 ~ 1000 μmol·mol-1的CO2浓度范围内,Pn未达到饱和,故无法求得CO2饱和点。
2 结果与分析
2.1 干旱胁迫对桂花叶片光合生理指标的影响
由表1可知,随着干旱胁迫的加剧,桂花叶片的Pn、Gs、Ci和Tr均呈现降低趋势,而WUE则逐渐升高。其中W1处理下桂花叶片的Pn、Gs和Tr的降幅均为最大,与对照相比分别下降了74.14%、79.82%和78.26%,同时W1处理的WUE增幅也为最大(18.93%)。干旱胁迫下,桂花叶片Ci变化并不十分规律,其中W2处理下的Ci要略高于W3处理,但与对照相比明显降低。方差分析表明,不同干旱胁迫下桂花叶片的Pn、Gs、Ci、Tr和WUE均有极显著差异。
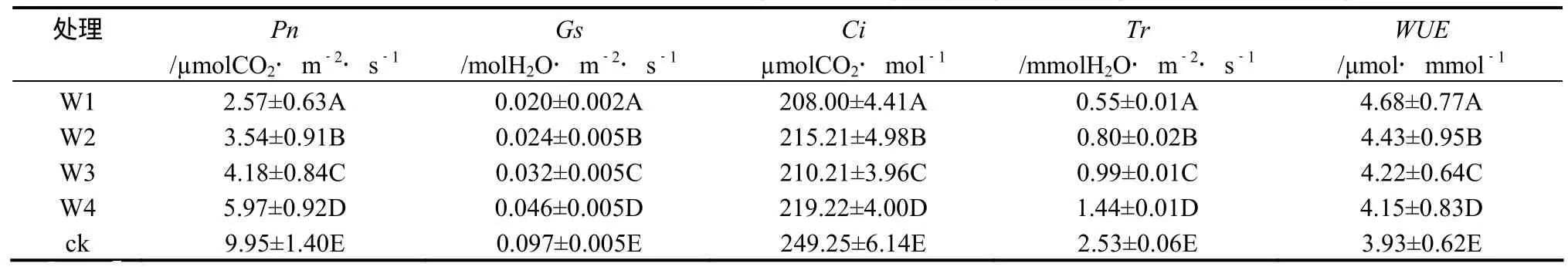
表1 干旱胁迫下桂花Pn、Gs、Ci、Tr及WUE的变化Table 1 Variation in Pn、Gs、Ci、Tr and WUE of O. fragrans “Chenghongdangui” seedling under different drought stress
2.2 干旱胁迫下桂花叶片Pn、Gs、Ci和Tr的光响应
干旱胁迫下,各不同处理间桂花叶片Pn的光响应过程基本相似,在0 ~ 400 μmol·m-2·s-1的低光强范围内,Pn随光强的增加快速上升;当光强超过400 μmol·m-2·s-1时,随光强的增大Pn的上升速度变小,并趋于稳定。当光强超过一定强度时,不同干旱处理下桂花叶片的Pn均呈现下降趋势(图1)。同时随着干旱胁迫的加剧,桂花叶片的表观量子效率AQY、光饱和点LSP逐渐减低,而光补偿点LCP则逐渐升高(表3)。
各不同干旱胁迫间桂花叶片Gs的光响应过程基本相似(图2),在0 ~ 400 mol·m-2·s-1的低光强范围内,Gs随光强的增加迅速上升;当光强超过400 μmol·m-2·s-1时,Gs随光强增加缓慢上升。各不同处理间桂花Ci的光响应过程基本相似,在0 ~ 400 μmol·m-2·s-1的低光强范围内,Ci随光强的增加迅速下降;当光强超过 400 μmol·m-2·s-1时,Ci随光强增加趋于稳定;在 0 ~ 1200 μmol·m-2·s-1光强范围内,W1处理的Ci较高,仅次于ck,但当光强超过1200 μmol·m-2·s-1时,处理W2、W3和W4的Ci略有升高并均超过W1处理(图3)。各不同处理间Tr的光响应过程也基本相似,随光强的增加Tr逐渐升高,且在弱光(0 ~ 200 μmol·m-2·s-1)下Tr的升高速率略高于强光(200 ~ 2000 μmol·m-2·s-1)(图 4)。
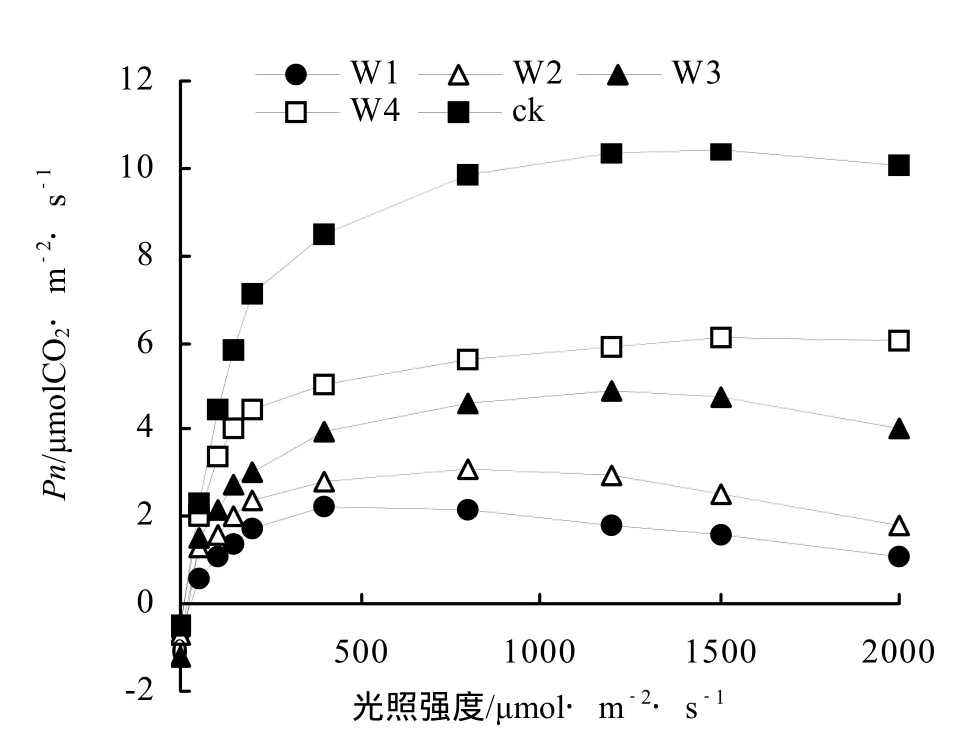
图1 不同干旱胁迫下桂花Pn光响应曲线Figure 1 Light response curve of Pn for O. fragrans“Chenghongdangui” Seeding under different drought stress
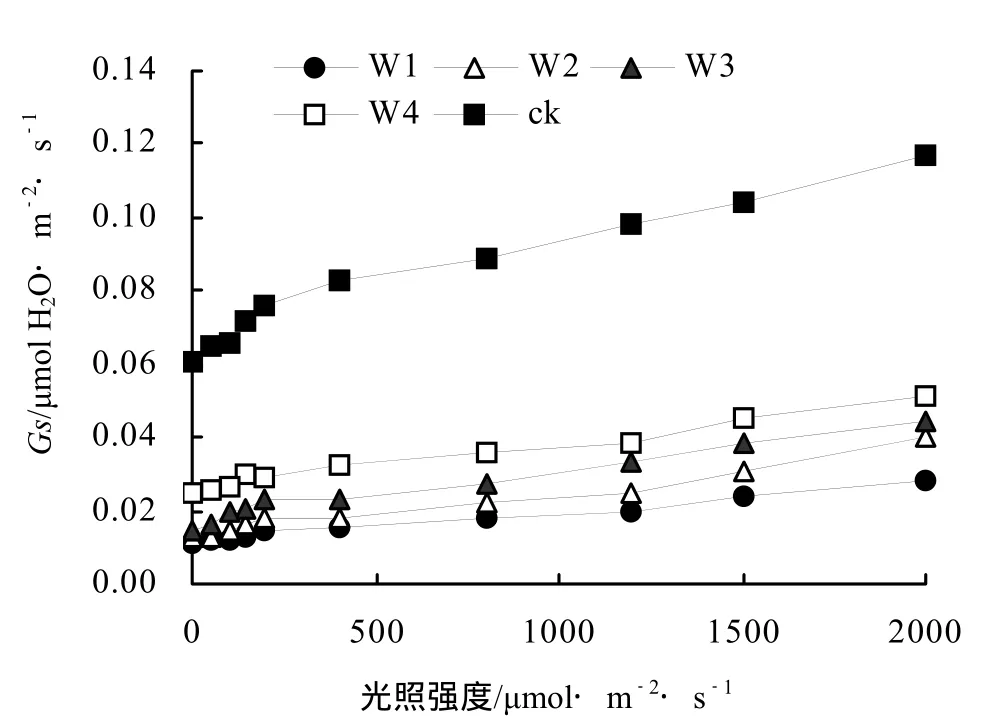
图2 不同干旱胁迫下桂花Gs光响应曲线Figure 2 Light response curve of Gs for O. fragrans“Chenghongdangui”seeding under different drought stress
方差分析表明,不同干旱处理之间桂花的Pn、Gs、Ci和Tr的光响应曲线均存在极显著差异(表2)。
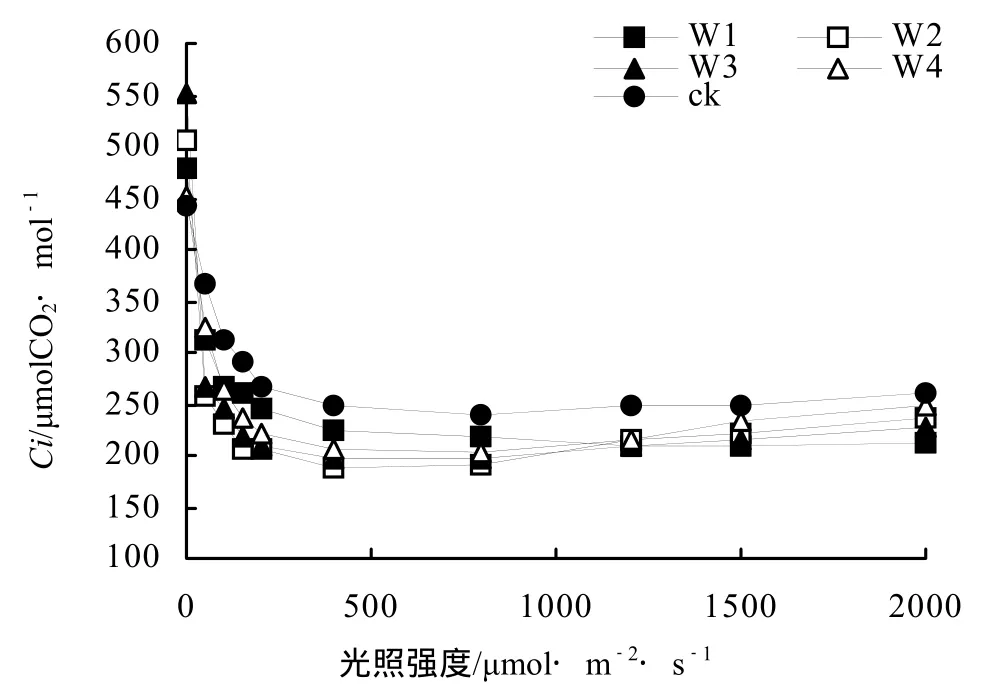
图3 不同干旱胁迫下桂花Ci光响应曲线Figure 3 Light response curve of Ci for O. fragrans“Chenghongdangui” seeding under different drought stress
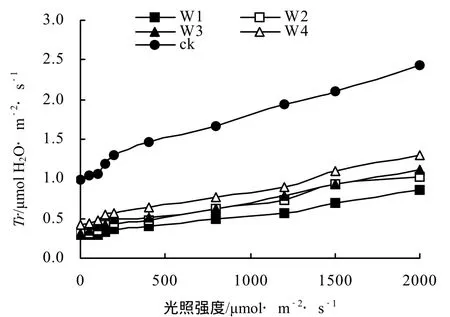
图4 不同干旱胁迫下桂花Tr光响应曲线Figure 4 Light response curve of Gs for O. fragrans“Chenghongdangui” seeding under different drought stress

表2 桂花苗木光合参数方差分析Table 2 ANOVA on photosynthetic parameters of O. fragrans “Chenghongdangui” seedlings
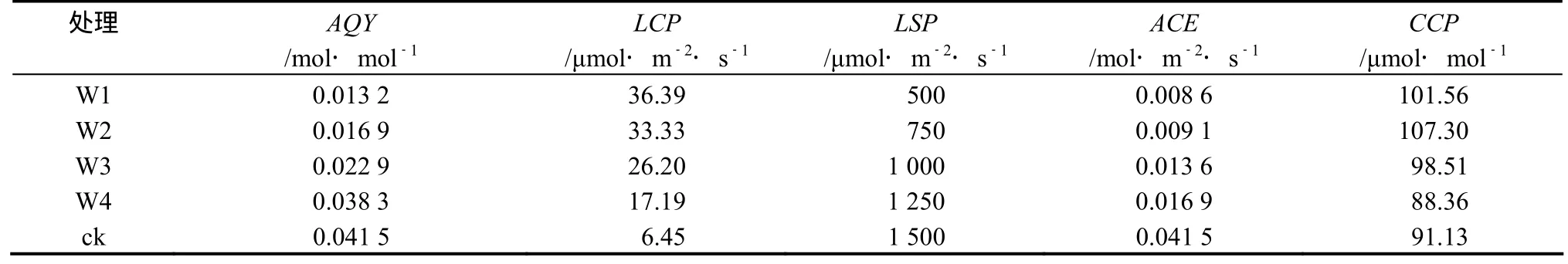
表3 干旱胁迫对桂花表观量子效率、光补偿点、光饱和点、表观羧化效率、CO2补偿点的影响Table 3 Effects of drought stress on AQY, LCP, LSP, ACE and CCP of O. fragrans “Chenghongdangui” seedlings
2.3 干旱胁迫下桂花叶片Pn的CO2响应
由图5可知,在0 ~ 400μmol·mol-1的CO2浓度范围内,不同干旱胁迫处理下的Pn变化趋势基本一致,且随着CO2浓度的升高Pn逐渐升高(图5)。方差分析表明,干旱胁迫对该CO2浓度范围内的Pn影响不显著(F = 1.74,P = 0.1808 > 0.05)。但该CO2浓度范围内不同干旱胁迫下Pn的平均值表现为ck > W4 > W3 > W1> W2(图5)。随着干旱胁迫的加剧桂花表观羧化效率(ACE)逐渐降低,而CO2补偿点(CCP)总体呈现升高趋势,但ck处理的CCP略高于W4处理(表3)。
3 结论与讨论
3.1 干旱胁迫对桂花叶片光合生理指标的影响
桂花的Pn、Gs、Ci、Tr以及WUE对干旱胁迫的反应比较敏感,不同干旱梯度之间存在显著差异,随着干旱胁迫的加剧,桂花的Pn、Gs、Ci和Tr均出现降低趋势,而WUE则逐渐升高(表1),说明干旱胁迫下限制桂花光合速率的主要因素可能是气孔因素。在W2处理下桂花的Ci高于W3,推测在W2处理下限制桂花光合速率的主要原因可能还有非气孔因素。实验结果显示,在W4处理下,桂花叶片光合速率的下降程度显然小于蒸腾速率的下降程度,因而叶片水分利用效率也明显提高,在W1、W2处理下桂花幼苗的光合速率和水分利用效率均会严重下降,而此时的水分利用效率提高的程度却不大(表1)。从高效用水的角度看,桂花的生长适宜的土壤水分应在W4和ck(相对含水量60% ~ 75%)范围内,既可保证桂花具有较高光合作用水平,又能够较大幅度地降低蒸腾耗水,从而维持最高的叶片水分利用效率。
3.2 干旱胁迫下桂花Pn、Gs、Ci、和Tr的光响应
Pn的光响应曲线则可以说明植物净光合速率与光合有效辐射的关系[10],在 0 ~ 2000 μmol·m-2·s-1的光强范围内,桂花Pn的光响应过程基本一致,但不同干旱处理间具有显著差异(表2)。在0 ~ 400 μmol·m-2·s-1的低光强范围内,Pn随光强的增加快速上升,当光强超过各处理的饱和光强(表3)时,Pn呈下降趋势(图1),推测可能是强光导致光呼吸增强或发生光抑制现象引起的[12~13]。在W3、W4和ck处理下并不会导致Pn、Gs、Ci、和Tr光响应过程变化格局的明显变化,但在W1和W2处理下桂花的Pn的变化比较大。同时计算发现,W3、W4和ck处理下的光饱和点LSP分别为1000、1250、1500 μmol·m-2·s-1(表3),但随着干旱胁迫的加剧桂花光饱和点LSP逐渐降低,表明在适宜环境条件下桂花对强光的适应性较高,且在较强光(PAR1000 ~2000 mol·m-2·s-1)范围内能维持较高水平的光合性能(表3,图1);在ck处理下桂花的光补偿点LCP只有6.45 μmol·m-2·s-1,说明桂花光合作用的光补偿点LCP较低,但随着干旱胁迫的加剧,桂花光合作用的光补偿点逐渐升高(表3),说明干旱使桂花对弱光的利用能力减低[11~13]。
AQY是反映植物光合作用对弱光的吸收和转换利用效率的指标[11,14~15],在适宜生长条件下植物的AQY实测值在0.03 ~ 0.05[11],本实验测得在ck和W4处理下桂花的AQY值分别为0.0415、0.0383 mol·mol-1,处于较高水平,说明桂花的光合作用对弱光的光能吸收和转换利用效率较高[11,14~15],但AQY会随干旱胁迫的加剧而明显降低(表3)。
3.3 干旱胁迫下桂花Pn的CO2响应
干旱胁迫下,随着CO2浓度的升高,桂花幼苗的净光合速率显著提高,且0 ~ 400 μmol·mol-1范围内,各个干旱处理的Pn随着外界CO2浓度的升高基本上呈现线性递增趋势(图5)。但干旱胁迫使桂花Pn随CO2浓度增加而升高的速度降低(图5),进一步分析表明干旱使桂花的ACE呈现降低趋势,而CCP基本呈现升高趋势(表3),其中W4处理下的CCP高于ck处理,说明W4处理可能促进了桂花对低浓度CO2的利用,但W4却能使ACE明显降低(表3),W4与ck相比其ACE降低了59.28%。
综上所述,干旱胁迫对桂花光合生理生态特性具有明显影响。干旱导致桂花叶片净光合速率下降,下降的原因主要以气孔限制因素为主,但在重度干旱胁迫下(W1、W2)表现出由气孔限制为主向非气孔限制为主转变的变化趋势,其调控机理有待进一步研究。在含水量比较充足(W4和ck处理)的情况下,桂花对强光(1000 ~ 2000 μmol·m-2·s-1)下有较高利用效率,对弱光(0 ~ 400 μmol·m-2·s-1)也有较高的利用和转化效率[11~13]。
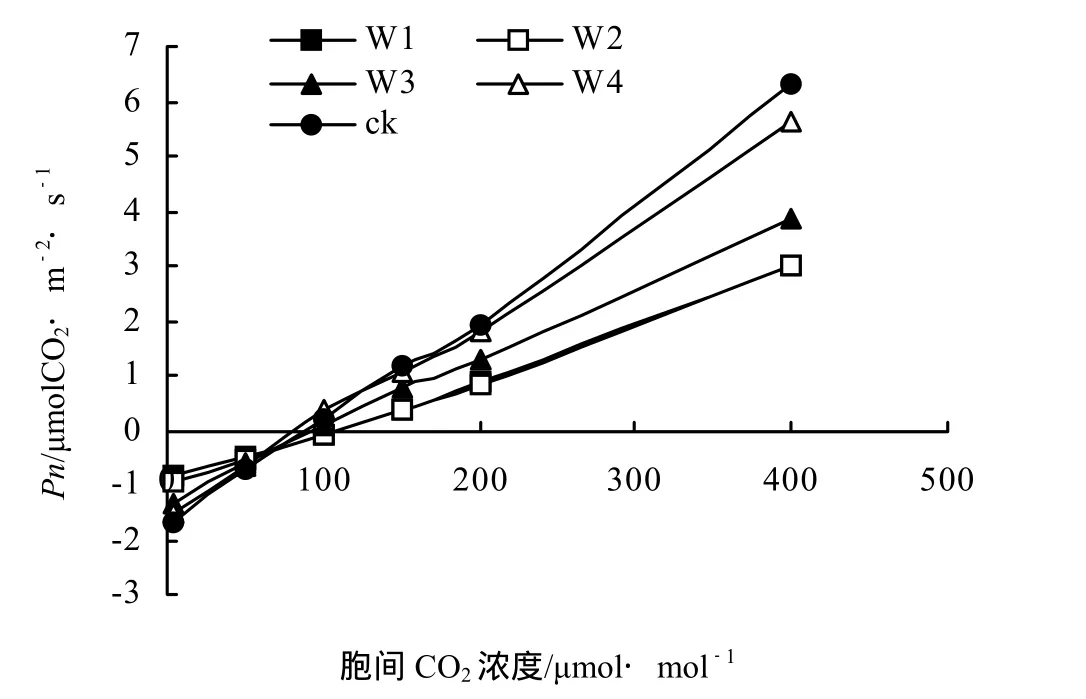
图5 不同干旱胁迫下桂花Pn的CO2响应曲线Figure 5 CO2 response curve of Ci for O. fragrans “Chenghongdangui”seeding under different drought stress
[1]孙志勇,季孔庶. 干旱胁迫对杂交鹅掌楸无性系光合特性的影响[J]. 北方园艺,2010(2):86-89.
[2]姜卫兵,高光林,俞开锦,等. 水分胁迫对果树光合作用及同化代谢的影响研究进展[J]. 果树学报,2002,19(6):416-420.
[3]马清,楼洁琼,王锁民. Na+对渗透胁迫下霸王幼苗光合特性的影响[J]. 草业学报,2010(3):198-203.
[4]周玉梅,韩士杰,张安辉,等. 不同CO2浓度下长白山3种树木幼苗的光合特性[J]. 应用生态学报,2002,13(1):41-44.
[5]陈洪国. 氮磷钾肥处理对桂花生长、花量及光合作用的影响[J]. 园艺学报,2009,36(6):843-848.
[6]王静. 桂花净光合作用与环境因子和生理因子的关系[J]. 安徽农业科学,2010,38(20):10985-10987.
[7]陈洪国,姜军权,孙全. 桂花叶片水分含量及光合生理特性的研究[J]. 安徽农业科学,2006,34(3):417-418.
[8]王丽梅,余龙江,吴耿,等. 桂花不同花期蒸腾作用和光合作用日变化研究[J]. 现代生物医学进展,2008,8(8):1504-1507.
[9]陈洪国. 土壤含水量对桂花幼苗光合作用及渗透调节物质的影响[J]. 安徽农业科学,2006,34(13):2960-2961.
[10]柯裕州,周金星,张旭东,等. 盐胁迫对桑树幼苗光合生理生态特性的影响[J]. 林业科学,2009,45(8):61-66.
[11]刘刚,张光灿,刘霞. 土壤干旱胁迫对黄栌叶片光合作用的影响[J]. 应用生态学报,2010,21(7):1697-1701.
[12]夏江宝,张光灿,刘刚,等. 不同土壤水分条件下紫藤叶片生理参数的光响应[J]. 应用生态学报,2007,18(1):30-34.
[13]柯世省,金则新,林恒琴,等. 天台山东南石栎光合生理生态特性[J]. 生态学杂志,2004,23(3):1-5.
[14]Xu Lingling,Zhang Xianzhou,Shi Peili,et al. Establishment of apparent quantum yield and maximum ecosystem assimilation on Tibetan Plateau alpine meadow ecosystem[J]. Sci CN Series D: Earth Sci,2005(48):141-147.
[15]阎秀峰,王玉杰,王洋,等. 长白山高山红景天的气体交换特性[J]. 木本植物研究,1999,19(3):273-281.
