冬虫夏草对免疫性肝损伤小鼠模型的保护作用研究
2011-07-30方士英徐茂红叶良兵顾宏霞鲍玲玲张小勇皖西卫生职业学院药学系六安237000
方士英 徐茂红 叶良兵 顾宏霞 鲍玲玲 张小勇 (皖西卫生职业学院药学系,六安237000)
冬虫夏草(Cordyceps sinensis(Berk)sacc)属肉座菌目麦角菌科虫草属植物,为虫草菌的子座与其寄主蝙蝠蛾(Hepialus armoricanuss oberthiir)幼虫尸体的复合物,俗称虫草,是我国传统的滋补性中药材。冬虫夏草性温、味甘,具有补肾益肺,止血化痰的作用。用于肾虚精亏、阳痿遗精、腰膝酸痛、久咳虚喘、劳嗽咯血等[1]。天然虫草由于受到严格的寄生性及特殊的生长地理条件的限制,产量有限,药源相当紧缺。近年来,许多研究人员致力于人工虫草新资源、新品种的研究与开发。古尼虫草小孢变种(Cordyceps gunni var minor nov)是在安徽境内发现的古尼虫草的新变种,其虫草多糖对化学性肝损伤具有保护作用[2]。为进一步研究其保肝作用,我们对古尼虫草小孢变种多糖保护免疫性肝损伤作用及其部分作用机制进行了实验研究。
1 材料与方法
1.1 药物 虫草多糖(多糖含量>50%):由安徽林苑虫草研究所提供。BCG:上海生物制品研究所(20030101)。LPS:美国Sigma公司产品。云芝多糖胶囊:南京老山制药有限公司(020401)。SOD测试盒、MDA 测试盒、AST测试盒、ALT测试盒:南京建成生物工程 研究 所(20030702、20030618、20030707、20030702)。IL-1测试盒、TNF-α测试盒:美国 TPI公司产品(2003071512、2003071512)。虫草多糖、云芝多糖(PCV)用前均用10%羧甲基纤维素钠(CMCNa)溶液配成相应浓度。
1.1.1 动物 昆明小鼠,雄性,(20±2)克,由安徽医科大学实验动物中心提供,皖医实动准字第01号。
1.1.2 仪器 Multiskan MK3酶标仪,上海雷勃分析仪器有限公司722S分光光度仪,上海精密科学仪器公司产品。BP211D电子天平,德国Sartarius生产。DL-5M高速冷冻离心机,湖南离心机厂产品。GSY-8电热恒温水浴锅,北京医疗设备厂意成公司产品。
1.2 方法
1.2.1 小鼠免疫性肝损伤模型的制备及给药方法
小鼠适应性饲养2天,随机分成6组,每组10只,即:正常对照组、BCG+LPS模型组、云芝多糖(1 000 mg/kg)阳性对照组。虫草多糖小剂量组:125 mg/kg,中剂量组:250 mg/kg,大剂量组:500 mg/kg。
参照文献[3]制作小鼠免疫性肝损伤模型,即由尾静脉iv 0.2 ml内含BCG 2.5 mg的生理盐水悬液,12天后每鼠尾静脉iv LPS 10μg,16小时后处死小鼠,取血和肝组织作有关检测。在造模过程中,实验组每日灌胃相应剂量的虫草多糖(125、250、500 mg/kg),阳性对照组每日灌胃云芝多糖(1 000 mg/kg),正常对照组和模型对照组灌胃等量10%羧甲基纤维素钠溶液,连续12天。
1.2.2 肝损伤指标的检测 尾静脉iv LPS 16小时后摘除小鼠眼球取血,分离血清,比色法测定ALT、AST;同时,脱臼颈椎处死小鼠,取肝脏左叶相同部位,用10%福尔马林液固定,作病理检查,按肝脏坏死程度进行编秩,累计每组动物肝坏死级数,用秩和检验方法计算每组动物肝脏坏死程度的平均秩次。选肝脏右叶用冷生理盐水漂洗去除积血,拭净后再用冷生理盐水制备10%肝匀浆,分别按TBA法和NBT法测MDA和SOD的含量。用ELISA法测定肝匀浆中TNF-α和IL-1的含量。
1.3 统计学处理 数据应用SPSS软件包进行处理。各项数据以±s表示,用 t检验比较组间差异的显著性。
2 结果
2.1 虫草多糖对血清转氨酶和SOD、MDA的影响
虫草多糖(125、250、500 mg/kg)均可使 BCG+LPS诱导的小鼠血清ALT、AST升高的活性降低,并能降低肝匀浆中MDA的水平,提高SOD的活性,见表1。
表1 虫草多糖对BCG+LPS诱导的小鼠血清中ALT、AST、肝匀浆中 SOD活性和MDA含量的影响(±s,n=10)Tab.1 Influence of CP on ALT、AST activities in serum and SOD activity、MDA contents in liver homogenates in mice induced by BCG+LPS( ±s,n=10)

表1 虫草多糖对BCG+LPS诱导的小鼠血清中ALT、AST、肝匀浆中 SOD活性和MDA含量的影响(±s,n=10)Tab.1 Influence of CP on ALT、AST activities in serum and SOD activity、MDA contents in liver homogenates in mice induced by BCG+LPS( ±s,n=10)
Note:Compared with normal group,1)P<0.01;compared with model group,2)P<0.01.
Groups ALT(U/L) AST(U/L) SOD(U/mg prot) MDA(nmol/mg prot)Normal 380.0±46.8 366.7±89.5 13.8±1.9 1.8±0.6 Model 1 658.7±213.71) 1 111.6±208.11) 2.2±0.71) 17.3±2.41)Low dose 1 351.7±185.32) 866.6±111.72) 4.1±1.12) 14.4±2.92)Medium dose 1 009.3±151.42) 649.2±127.72) 7.9±1.02) 11.8±2.42)High dose 642.7±138.62) 397.6±108.82) 12.2±3.02) 8.0±1.22)PCV 516.0±194.42) 336.2±41.62) 10.0±1.82) 6.5±1.62)
表2 虫草多糖对BCG+LPS诱导的小鼠肝匀浆中TNF-α和 IL-1含量的影响(±s,n=10)Tab.2 Influence of CP on TNF-αand IL-1 production in liver homogenates in miceinduced by BCG+LPS±s,n=10)
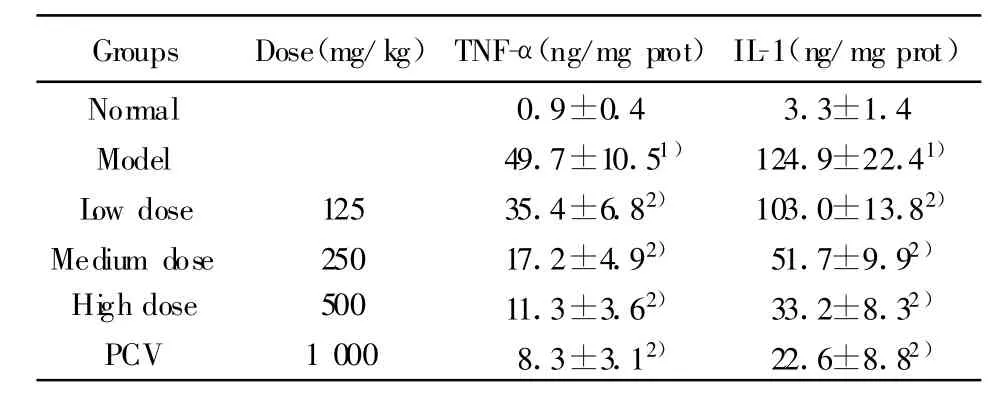
表2 虫草多糖对BCG+LPS诱导的小鼠肝匀浆中TNF-α和 IL-1含量的影响(±s,n=10)Tab.2 Influence of CP on TNF-αand IL-1 production in liver homogenates in miceinduced by BCG+LPS±s,n=10)
Note:Compared with normal group,1)P<0.01;compared with model group,2)P<0.01.
Groups Dose(mg/kg)TNF-α(ng/mg prot)IL-1(ng/mg prot)Normal 0.9±0.4 3.3±1.4 Model 49.7±10.51) 124.9±22.41)Low dose 125 35.4±6.82) 103.0±13.82)Medium dose 250 17.2±4.92) 51.7±9.92)High dose 500 11.3±3.62) 33.2±8.32)PCV 1 000 8.3±3.12) 22.6±8.82)
表3 虫草多糖对BCG+LPS诱导的小鼠肝损害的影响(±s,n=10)Tab.3 Influence of CP on hepatic injury in mice caused byBCG+LPS(±s,n=10)

表3 虫草多糖对BCG+LPS诱导的小鼠肝损害的影响(±s,n=10)Tab.3 Influence of CP on hepatic injury in mice caused byBCG+LPS(±s,n=10)
Note:Compared with normal group,1)P<0.01;compared withmodel group,2)P<0.01.
Groups Degree of hepatic cell narocis Normal 0 Model 44.71)Low dose 33.42)Medium dose 28.32)High dose 11.22)PCV 9.12)

图1 CP对免疫性肝损伤小鼠肝组织病理学的影响(×100)Fig.1 Influence of CP on pathology of hepatic injury in mice caused by BCG+LPS(×100)
2.2 虫草多糖对肝匀浆中TNF-α和IL-1含量的影响 虫草多糖(125、250、500 mg/kg)均可使 BCG+LPS诱导的小鼠肝匀浆中升高的TNF-α和IL-1的含量显著降低,见表2。
2.3 病理检查结果 实验正常对照组小鼠的肝组织结构完整;BCG+LPS模型组小鼠肝细胞排列紊乱,肿胀及气球样变,肝中央静脉周围有大范围的肝细胞变性坏死。随虫草多糖剂量的增大,对肝脏的保护作用也随之增强。其中高剂量的虫草多糖对肝脏具有较好的保护作用。实验中,阳性对照药云芝多糖也呈现出较好的保肝作用。结果见表3,代表性病理图见图1。
3 讨论
给小鼠注射BCG可使巨噬细胞和中性多核细胞聚集于肝脏,使肝脏处于致敏状态。继而用低毒剂量的LPS攻击,可激发这些细胞释放TNF-α等炎症因子,造成肝脏炎症、坏死。本实验在采用序贯注射BCG+LPS后,成功诱导了免疫性肝损伤模型,小鼠血浆中转氨酶水平和肝匀浆中MDA含量显著升高,肝脏出现不同程度炎细胞浸润和坏死。实验中虫草多糖可显著降低BCG+LPS诱导肝损伤后小鼠血清中AST、ALT活性和肝中MDA的含量,并能提高肝中SOD的活性,表明虫草多糖具有抑制肝细胞损伤的作用。
MDA的测定广泛用于发现氧自由基介导的细胞损伤,其含量的高低可间接反映机体细胞受氧自由基攻击的严重程度;而自体的SOD能清除超氧阴离子自由基,保护细胞免受损伤,其活力的高低能反映机体清除氧自由基的能力[4]。本研究模型组小鼠肝组织中MDA显著高于正常组,表明序贯注射BCG+LPS致小鼠肝组织损伤,肝脏氧化代谢改变,线粒体等细胞器功能障碍,能量代谢障碍,引起细胞质膜破坏,肝细胞变性、坏死[5]。实验组冬虫夏草多糖三个剂量组(125、250、500 mg/kg)ig给药明显降低了BCG+LPS诱导的免疫性肝损伤后小鼠血清中升高的ALT和AST水平,抑制肝匀浆中上升的MDA水平和升高降低的SOD活性。表1中实验结果说明虫草多糖可直接清除体内过剩自由基和脂质过氧化物(MDA),或通过增强体内抗氧化酶(SOD)活力起增强抗氧化作用,有效地防止或减轻体内自由基所导致的氧化损伤,增强机体免疫能力。
为进一步探讨虫草多糖对实验性肝损伤的作用机制,我们采用ELISA法对肝组织中TNF-α、IL-1含量进行了测定,结果显示实验组小鼠肝组织中两者的含量明显低于模型组。
TNF-α是肝脏损伤的重要介质,是一种多效的促炎症反应细胞因子,主要由活化的巨噬细胞产生,其对肝产生毒性的机制主要是:刺激细胞产生凋亡的刺激因子,在转录终止水平以下可在体内外诱导小鼠肝细胞凋亡;可诱发中性粒细胞向内皮细胞粘附或活化中性粒细胞,促使其趋化聚集于肝脏,释放蛋白酶或氧自由基,造成肝细胞损伤[6]。更为重要的是TNF-α可作为肝损伤的第一介质,其出现时将引起许多与肝坏死有关的第二介质,如 NO、IL-1、IL-6、IL-8、sIL-2R等的产生,且IL-1等第二介质又增强TNF-α的肝损伤作用,即使少量TNF存在,宿主也会发生组织损伤[6]。
TNF-α单独并不引起明显的肝脏损害,IL-1本身对肝脏也无损伤作用。但IL-1水平的上升可刺激各种免疫细胞和炎症细胞产生TNF-α、IFN-γ、IL-6、IL-8等细胞因子,介导肝脏的炎症免疫损伤。特别是在IL-1存在时,TNF-α致肝损伤作用显著增强。此外,IL-1和 TNF-α、IFN-γ等又可协同作用于肝细胞,使iNOSmRNA表达增加,NO产生增多,肝损伤加重。
实验组小鼠肝匀浆中TNF-α生成明显减少,表明虫草多糖可抑制肝细胞脂质过氧化反应,稳定生物膜,使细胞膜通透性降低,活跃肝细胞生物氧化功能和蛋白质合成,减轻肝细胞变性和坏死,从而恢复肝细胞功能,起到保护肝脏的作用。
免疫性肝损伤的病理机制十分复杂,涉及到机体的免疫功能的紊乱、细胞因子之间的失衡和淋巴细胞活性的改变等。虫草多糖对免疫性肝损伤的保护作用是否与其调节机体免疫功能、降低TNF-α、IL-1的含量、平衡细胞因子等有关值得进一步研究。
1 国家药典委员会编,中华人民共和国药典[M].北京:中国医药科技社,2010:106.
2 方士英,姚宏伟,李 俊 et al.虫草多糖对小鼠化学性肝损伤的保护作用[J].安徽医科大学学报,2004;39(3):201-203.
3 魏 伟,吴希美,李元建.药理学实验方法学[M].第 4版.北京:人民卫生出版社,2010:1130-1131.
4 陈方军,李 俊,王佳佳.玉屏风多糖对小鼠化学性肝损伤的影响[J].安徽医科大学学报,2011;46(1):49-52.
5 杜艳秋,赵 敏.葛根素对大鼠急性乙醇中毒性肝损伤的保护作用[J].中国工业医学杂志,2011;24(1):9-11.
6 李晶媛,李树臣,杨维良.TNF-α诱导肝细胞凋亡机制的回顾与展望[J].世界华人消化杂志,2007;15(6):606-611.
