腘窝淋巴结免疫细胞多种表面分子在PLNA评价致敏性中的综合分析
2011-07-28黄路芬王培训
黄路芬,董 燕,王 青,周 联,王培训
(广州中医药大学免疫与分子生物学技术研究室,广东广州 510405)
免疫介导的药物超敏反应(IDHR)是一种最常见、也最为复杂的药物不良反应[1],迄今为止,尚无有效预测IDHR的方法。目前,针对小分子化学物质(low molecular weight compounds,LMWC)或药物致敏潜能的检测方法中,腘窝淋巴结实验(popliteal lymph node assay,PLNA)是被认可、相对常用的筛选、评价技术[2],已经有超过130种的药物和化学物质运用该方法测试其致敏性,结果与相关部门正式公布出来的结论有较好的一致性[3]。腘窝淋巴结是足趾部注射外源物质发生免疫应答的第一部位和惟一引流淋巴结,因此,在足趾引入的致敏物质势必首先导致腘窝淋巴结及其相关免疫细胞的变化,现有PLNA主要观察淋巴结和淋巴细胞的组织学变化,以及免疫细胞效应阶段的产物。由于细胞表面分子的改变是细胞分化或功能改变的重要标志,因此,本研究通过对PLNA中多种腘窝免疫细胞及其与细胞活化相关的细胞表面分子进行综合评价,以期提高PLNA在预测致敏性或致敏性评价中的可靠性和灵敏性。
1 材料与方法
1.1 动物 ♀ SPF级BALB/c小鼠,6~8周龄,体质量18~22 g,由广东省实验动物中心提供,动物许可证号:SCXK(粤)2008-0002,No.0087659,适应 1周后开始实验。实验在一万级的屏障系统中进行,自由饮食,实验环境执行GB14925-2001标准。
1.2 主要试剂及仪器 氯化汞(HgCl2,贵州省铜仁化学试剂厂);2,4,6-三硝基苯磺酸(TNBS)、D-青霉胺(D-pen)、链脲佐菌素(STZ)均购于Sigma公司;APC-cy7 anti-mouse CD4、PE-cy7 anti-mouse CD8、APC anti-mouse B220、FITC anti-mouse CD69、PC-cy7 anti-mouse CD3、PE anti-mouse CD44、APC anti-mouse CD62L、FITC anti-mouse MHC II、PE anti-mouse CD40L、PE-cy7 anti-mouse CD11C、FITC anti-mouse CD40、PE anti-mouse CD86、PE anti-mouse F4/80,均购于美国Biolegend公司或美国eBioscience公司;FACSCantoII流式细胞仪(美国BD公司);GS-15R高速离心机(美国Beckman公司)
1.3 实验方法
1.3.1 免疫动物 ♀ BALB/c小鼠随机分为对照(Control)组、HgCl2组(50 μg/只)、STZ 组(1 mg/只)、TNBS 组(2.5 mg/只)、D-pen 组(2 mg/只),每组7只。将HgCl2溶于生理盐水、D-Pen和STZ分别溶于PBS(pH=7.2)。固定小鼠,以70%酒精棉球消毒左后侧(处理侧)足趾部,一次性无菌胰岛素注射器(BD Ultra-FineTM)皮下注射给药,进针方向由足跟指向足尖,各组给药体积均为50 μl,对照组给予PBS,对侧不做处理。
1.3.2 淋巴细胞悬液制备 注射5 d后,脱颈椎处死小鼠,70%酒精浸泡10 min,在超净台用解剖镊分离、摘取腘窝淋巴结(PLN),常规制备单细胞悬液。用冷 PBS 洗涤细胞两次(1 200 r·min-1,5 min),细胞计数,细胞浓度调整为1×107cells·L-1。
1.3.3 四色免疫荧光染色 取上述各组淋巴细胞悬液100 μl(1×106cells)于流式管中,加入相应抗小鼠抗体0.5 μg,混匀后,4℃避光放置30 min。然后经 PBS 洗涤两次(1 200 r·min-1,5 min),流式细胞仪分析。
1.3.4 数据处理 全部数据经BD FACSCantoⅡ型流式细胞仪和FACSDiva软件获取和分析。在前散射(FSC)和侧散射(SSC)二维散点图中划出淋巴细胞区,然后对淋巴细胞作选取的荧光强度检测。全部数据使用统计软件包SPSS17.0 for Windows进行处理,数据以±s表示,多组间比较采用Oneway-ANOVA,方差不齐时采用非参数检验进行分析。
2 结果
2.1 PLN中T、B细胞比例及其早期活化分子TNBS组T细胞比例降低,T、B细胞早期活化分子表达升高;HgCl2组T细胞比例增多,但T、B细胞早期活化分子表达及B细胞比例降低;STZ组的CD4+T细胞比例及活化下降,B细胞比例及其活化分子、CD8+T细胞比例及活化分子表达增多;D-Pen组引起变化的指标少且弱(Tab 1)。
2.2 PLN免疫细胞MHCⅡ、协同刺激和活化分子TNBS组T细胞与抗原提呈细胞表面的MHCⅡ分子、T细胞表面的活化分子CD40L以及B细胞协同刺激分子CD86表达明显增高(Fig 1);HgCl2组T细胞表面的 MHCⅡ分子、B细胞协同刺激分子CD86与活化分子CD40表达增高,CD11c+细胞的活化分子 CD40也表达增多,F4/80+细胞与CD11c+细胞比例均降低;STZ组 B细胞表面的MHCⅡ分子表达增高,CD4+T细胞表面MHCⅡ及活化分子CD40L表达比例降低;D-Pen组CD11c+细胞的活化分子CD40表达有所降低(Tab 2)。
2.3 PLN中效应T细胞 TNBS组T细胞表面的CD44分子、CD62L分子表达增多;HgCl2组CD8+T细胞表面的CD44分子表达升高;STZ和D-Pen组该指标变化差异无统计学意义(Tab 3)。
Tab 1Comparison of T,B cell ratio and their relatively early activation molecule(±s,n=7)
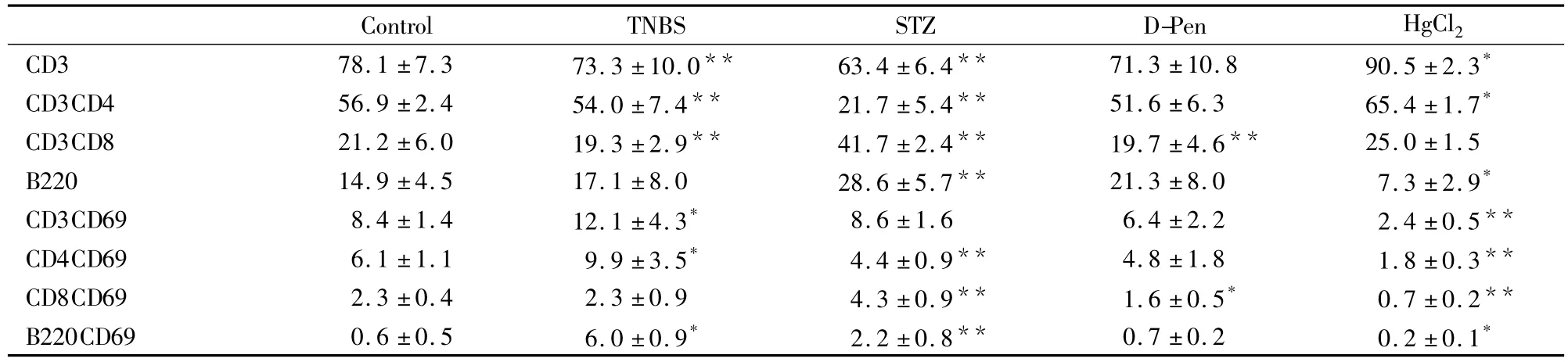
Tab 1Comparison of T,B cell ratio and their relatively early activation molecule(±s,n=7)
*P <0.05,**P <0.01 all groups vs control group.
Control TNBS STZ D-Pen HgCl 2 CD3 78.1 ±7.3 73.3 ±10.0** 63.4 ±6.4** 71.3 ±10.8 90.5 ±2.3*CD3CD4 56.9 ±2.4 54.0 ±7.4** 21.7 ±5.4** 51.6 ±6.3 65.4 ±1.7*CD3CD8 21.2 ±6.0 19.3 ±2.9** 41.7 ±2.4** 19.7 ±4.6** 25.0 ±1.5 B220 14.9 ±4.5 17.1 ±8.0 28.6 ±5.7** 21.3 ±8.0 7.3 ±2.9*CD3CD69 8.4 ±1.4 12.1 ±4.3* 8.6 ±1.6 6.4 ±2.2 2.4 ±0.5**CD4CD69 6.1 ±1.1 9.9 ±3.5* 4.4 ±0.9** 4.8 ±1.8 1.8 ±0.3**CD8CD69 2.3 ±0.4 2.3 ±0.9 4.3 ±0.9** 1.6 ±0.5* 0.7 ±0.2**B220CD69 0.6 ±0.5 6.0 ±0.9* 2.2 ±0.8** 0.7 ±0.2 0.2 ±0.1*
Tab 2Comparison of MHCⅡ+and Co-stimulatory molecules(±s,n=7)

Tab 2Comparison of MHCⅡ+and Co-stimulatory molecules(±s,n=7)
*P <0.05,**P <0.01 all groups vs control
Control TNBS STZ D-Pen HgCl 2 CD4MHC Ⅱ 3.3 ±1.2 6.1 ±1.8** 1.5 ±1.0* 2.3 ±0.4 3.0 ±0.7**CD8MHC Ⅱ 0.7 ±0.2 0.6 ±0.3** 0.8 ±0.3 1.0 ±0.3 2.7 ±1.3**B220MHC Ⅱ 15.2 ±4.1 16.6 ±5.5 20.1 ±8.9* 15.3 ±3.0 21.3 ±7.0 CD4CD40L 2.5 ±0.9 5.3 ±1.7** 1.2 ±0.6* 1.8 ±0.3 2.3 ±0.7 CD8CD40L 2.3 ±0.9 3.8 ±1.0 1.5 ±1.0 1.8 ±0.6 1.8 ±0.5 B220CD86 3.2 ±1.8 20.2 ±3.5** 1.8 ±0.9 1.5 ±0.7 11.0 ±5.5*B220CD40 96.4 ±1.6 97.0 ±1.4 97.8 ±1.0 97.7 ±0.7 98.0 ±1.2*CD11c 5.9 ±1.4 5.2 ±0.8 6.5 ±1.3 4.7 ±1.7 2.2 ±0.8*CD11cMHC Ⅱ 26.5 ±4.6 44.0 ±11.0** 18.5 ±4.4 23.6 ±6.3 29.7 ±11.1 CD11cCD40 89.8 ±1.4 95.3 ±2.2 88.2 ±1.4 88.4 ±3.2* 95.0 ±3.1*CD11cCD86 12.4 ±2.2 12.0 ±1.6 11.7 ±5.5 12.5 ±2.9 9.5 ±3.5 F4/80 0.6 ±0.2 0.9 ±0.3 0.9 ±0.3 0.7 ±0.2 0.2 ±0.1**F4/80 CD40 79.9 ±8.0 83.4 ±8.4 78.0 ±3.7 75.8 ±8.2 80.7 ±7.1
Tab 3 Comparison of the proportion of effector T cells(±s,n=7)

Tab 3 Comparison of the proportion of effector T cells(±s,n=7)
*P <0.05,**P <0.01 all groups vs control
Control TNBS STZ D-PEN HgCl 2 CD4CD44 7.7 ±1.6 20.2 ±4.6**6.3 ±2.0 8.8 ±2.0 15.9 ±15.0 CD8CD44 3.6 ±1.4 9.9 ±2.8** 5.1 ±2.0 6.9 ±1.9 7.8 ±4.9*CD4CD62L 42.4 ±8.4 53.8 ±5.6* 24.3 ±21.0 39.1 ±6.4 42.5 ±16.5 CD8CD62L 49.8 ±8.1 66.1 ±3.1**28.5 ±24.2 41.2 ±12.2 37.3 ±21.3

Fig 1 Flow cytometric analyses the expression of the surface molecules CD40L,CD86,MHC Ⅱon T,B and DC cell in control and TNBS group A,B,C:Control group;D,E,F:TNBS group.
3 讨论
PLNA是检测小分子化合物致敏的常用实验方法,传统及改良后的PLNA主要以腘窝淋巴结的大小、淋巴细胞数量、生发中心的形成及效应产物IgG和IgE等指标评价物质是否具有致敏潜能[4]。但对致敏阶段免疫细胞的变化研究较少,其灵敏性及可靠性还存在一定问题。有研究发现PLNA中致敏物质诱导免疫应答时,腘窝淋巴结部分免疫细胞的表面分子会发生改变[5]。本研究主要针对供试物在致敏阶段所涉及的抗原提呈及免疫细胞的不同类型表面分子变化为指标,探讨综合运用这些指标判断物质致敏潜能的可行性。
IDHR与由变应原引起超敏反应的免疫过程相似[6]。免疫原性物质由APC呈递给特异性T、B细胞后,细胞之间相互作用表达辅助性共刺激分子促使自身的活化,活化后的特异性T、B细胞发生增殖、分泌细胞因子或者抗体产生免疫反应。有研究指出在物质致敏阶段免疫细胞表达的协同刺激分子对特异性免疫应答的产生起决定性作用[7]。本研究针对物质的致敏阶段选取了对抗原呈递、细胞增殖、生发中心形成、免疫反应类型及T、B细胞活化与过敏性疾病密切相关的表面分子MHCⅡ、协同刺激分子CD40、CD40L、CD86进行了检测。结果显示MHCⅡ+分子在 HgCl2、TNBS组 T细胞和 CD11c+细胞上表达升高;CD40分子在HgCl2组的B细胞和CD11c+细胞上表达升高;CD40L分子在TNBS组CD4+T细胞表面表达增高;B细胞的协同刺激分子CD86在HgCl2、TNBS组中高表达。
APC与特异性T、B细胞相互作用表达协同刺激分子使T、B细胞发生早期活化。有研究表明在T细胞介导的药物过敏反应中,T细胞的早期活化极其重要[8]。它的上调是真正的特异性T细胞分泌细胞因子后使旁观 T细胞的 CD69+表达增多。STZ、TNBS组引起了T、B细胞早期活化标志CD69+的上调;但D-Pen组CD8+T细胞的CD69+表达下调,尤其是HgCl2组T、B细胞皆低表达CD69+,并经多次重复实验验证,分析也可能与物质本身的毒性有关,有待进一步研究。
特异性的T、B细胞活化后发生增殖,部分增殖细胞在致敏物质的刺激下转化成为效应T细胞。效应 T细胞 CD44+分子表达上调,但低表达CD62L+分子。HgCl2和 TNBS组 T细胞表面的CD44+分子表达上调。
抗原呈递细胞在免疫反应中有重要作用。本研究检测了CD11c+细胞(在PLN中,是树突状细胞的主要表面分子)、巨噬细胞(F4/80)比例及其表面分子变化,发现巨噬细胞的相关变化较弱,树突状细胞及其表面分子的变化明显,较适合用于致敏性评价的研究。
上述结果说明具有致敏潜能的物质在引发上述指标的变化上存在差异,不能依据单一细胞表面分子的变化判断物质的致敏性。HgCl2和TNBS可引发上述多个指标发生变化,并基本与致敏反应免疫学规律一致,而STZ和D-Pen组发生相应变化的指标数量相对少。
本研究通过对在PLNA中常用的具有致敏潜能的物质在诱导免疫应答时细胞多个表面分子的变化综合分析后认为:HgCl2和TNBS具有较强的致敏能力;STZ和D-Pen致敏潜能较弱,尤其是D-Pen;对怀疑有致敏性的物质在致敏阶段引起的细胞表面分子变化进行综合分析,可以评价其致敏潜能。该方法可以更早期的对药物致敏性给予预测及评价,对现有PLNA的可靠性和灵敏性有补充作用。另外,在药物诱导特异性免疫反应时,相关免疫细胞分泌的细胞因子对于免疫反应的类型有决定性的作用,利用流式细胞术检测细胞因子作为其致敏性的一个评价标准也值得探索研究。
[1] Gutting B W,Updyke L W,Amacher D E.Investigating the TNPOVA and direct popliteal lymph node assays for the detection of immunostimulation by drugs associated with anaphylaxis in humans[J].J Appl Toxicol,2002,22(3):177 -83.
[2] Lovik M,Alberg T,Nygaard U C,et al.Popliteal lymph node assay to study adjuvant effects on respiratory allergy[J].Methods,2007,41(1):72 -9.
[3] Pieters R.The popliteal lymph node assay:a tool for predicting drug allergies[J].Toxicology,2001,158(1-2):65 -9.
[4] 刘兆华,刘兆平,周庚寅.腘窝淋巴结试验在药物超敏反应研究中的应用[J].中国药理学与毒理学杂志,2009,23(1):70-5.
[4] Liu Z H,Liu Z P,Zhou G Y.Popliteal lymph node assay used in studies of drug hypersensitivity[J].Chin J Pharmacol Toxicol,2009,23(1):70 -5.
[5] Tuschl H,Landsteiner H T,Kovac R.Application of the popliteal lymph node assay in immunotoxicity testing:complementation of the direct popliteal lymph node assay with flow cytometric analyses[J].Toxicology,2002,172(1):35 -48.
[6] Nierkens S,Aalbers M,Bleumink R.Drug-induced type 1 and type 2 immune responses are characterized by distinct profiles of cell kinetics,cytokine production,and expression of co-stimulatory molecules in the popliteal lymph node assay[J].J Immunotoxicol,2005,2(3):141 -50.
[7] Uetrecht S B.The danger hypothesis applied to idiosyncratic drug reactions[J].Curr Opin Allergy Clin Immunol,2003,3(4):235 -42.
[8] Porebski G,Gschwend-Zawodniak A,Pichler W J.In vitro diagnosis of T cell-mediated drug allergy[J].Clin Exp All,2011,41(4):461-70.
