血管紧张素Ⅱ1型受体拮抗剂用于脓毒症大鼠的实验研究
2011-07-28廖丽君郭建荣贾东林沈华春
廖丽君,郭建荣,贾东林,喻 君,沈华春
(1.宁波大学医学院附属李惠利医院麻醉科,浙江宁波 315040;2.北京大学
第三医院麻醉科,北京 100083;3.皖南医学院附属弋矶山医院麻醉科,安徽芜湖 241001)
脓毒症时机体发生一系列的炎症反应和抗炎反应,释放大量细胞因子和炎症介质的同时,循环和组织内肾素-血管紧张素系统(renin-angiotensin system,RAS)高度激活,其在脓毒症的病理过程中发挥的作用尚未阐明。本研究通过血管紧张素Ⅱ1型受体(angiotensinⅡ 1 receptor,AT1R)拮抗剂氯沙坦(losartan,LOS)在内毒素(LPS)诱导的脓毒症大鼠的干预效果,探讨AT1R拮抗剂在脓毒症大鼠中的保护作用及可能机制。
1 材料与方法
1.1 实验动物与分组 清洁级♂SD大鼠30只,体质量200~220 g(由宁波大学实验动物中心提供)。大鼠腹腔注射戊巴比妥钠(30 mg·kg-1)后股动、静脉穿刺置管分别用于动脉测压和静脉给药。将大鼠随机分成对照组(Control组):生理盐水,iv,n=10;脓毒症组(LPS组):细菌内毒素(LPS,O127B8,Sigma 公司)12 mg·kg-1,iv,n=10;氯沙坦组(LOS组):氯沙坦(MSD 公司)50 mg·kg-1ip,30 min 后LPS 12 mg·kg-1iv,n=10。实验全程监测平均动脉压(MAP)、心率及呼吸的变化。脓毒症模型制作成功的标志是以注射LPS后大鼠MAP下降25%~30%并能维持该水平为标准。LPS注射6 h后采血待检,随即处死大鼠取出胸主动脉立即放入液氮速冻,然后转入-80℃备检。
1.2 检测指标及方法 注射LPS 6 h后各组大鼠心脏穿刺采血5~6 ml检测下述指标:①硝酸盐还原酶法测定血浆一氧化氮(nitric oxide,NO)浓度;②TBA法测定血浆丙二醛(MDA)浓度;③ 酶联免疫(ELISA)法测定细胞因子IL-1β及TNF-α的血浆浓度。④逆转录-聚合酶链反应(RT-PCR)法检测大鼠胸主动脉IκB mRNA的表达,各组PCR反应产物经凝胶电泳、图谱扫描后,采用Totalab图像分析软件对PCR电泳扫描图进行分析,以IκB mRNA的积分光密度值与β-actin mRNA的积分光密度值的比值表示 IκB mRNA的表达水平。⑤ Western blot法检测大鼠胸主动脉IκB蛋白的表达。胸主动脉匀浆裂解后依次进行蛋白定量、电泳分离、转膜、封闭,加入1∶500稀释的抗IκB单克隆抗体(SC-371,Santa Cruz公司)孵育,TBST洗膜,加入二抗孵育,TBST洗膜、ECL胶片曝光、显影、定影。将图片进行密度扫描,以IκB的积分光密度值与β-actin的积分光密度值的比值表示IκB蛋白的表达水平。
2 结果
2.1 各组大鼠血浆NO、MDA、IL-1β及TNF-α浓度的变化 与对照组比较,LPS组NO、MDA、IL-1β及TNF-α的血浆浓度均明显升高(P<0.01),而在LOS治疗组中,以上各指标均较LPS组明显回落(P<0.01),但仍较正常大鼠升高(P<0.01)。见Tab 1。
Tab 1 Plasma concentrations of NO,MDA,IL-1β and TNF-α in each group(±s,n=10)

Tab 1 Plasma concentrations of NO,MDA,IL-1β and TNF-α in each group(±s,n=10)
**P<0.01 vs control;##P<0.01 vs LPS
Group NO/μmol·L -1 MDA/μmol·L -1 IL-1β/μg·L-1 TNF-α/μg·L -1 Control 53.7 ±8.35.48 ±0.5 92.6±10.6 78.4±25.7 LPS 545±78.7** 19.2±3.6** 564.9±51.8** 724.8±75**LOS 269.7 ±29.9**## 10.8±1.1**## 371.5±47.4**##489.8±56.3**##
2.2 各组大鼠胸主动脉IκB mRNA和蛋白的表达情况 与正常对照组比较,静脉注射LPS诱导而成的脓毒症大鼠胸主动脉IκB mRNA的表达(189±27)和蛋白的表达(77±12)均受到明显抑制(P<0.01),分别下降了31.5%和42.9%;而在 LOS治疗组中,大鼠胸主动脉 IκB mRNA的表达(233±25)较 LPS组升高了23.3%(P<0.01),IκB 蛋白的表达(103±13)较 LPS组升高了 33.8%(P<0.01),但治疗组IκB mRNA和蛋白的表达仍未恢复到正常水平,明显低于对照组(P<0.01),见Tab 2、Fig 1、2。
Tab 2 Expressions of IκB mRNA and protein in rat aortas of each group(±s,n=10)

Tab 2 Expressions of IκB mRNA and protein in rat aortas of each group(±s,n=10)
**P<0.01 vs control;##P<0.01 vs LPS
B Pro Control 276±35 135±14 Group IκB mRNA Iκ LPS 189±27** 77±12**LOS 233±25## 103±13##
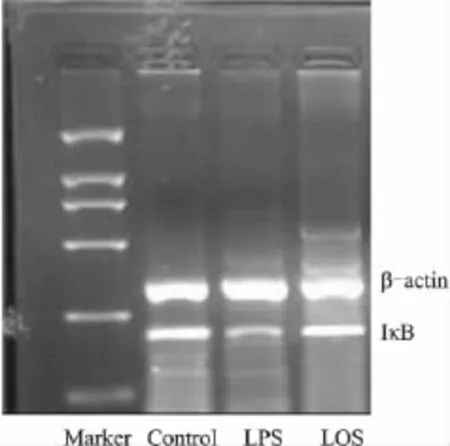
Fig 1 Expressions of IκB mRNA in rat aortas of each group
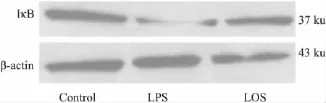
Fig 2 Expressions of IκB protein in rat aortas of each group
3 讨论
脓毒症模型的制作有多种方法,我们采用静脉内一次性注射大剂量的LPS诱导脓毒症的模型,与直接给予细菌或盲肠结扎并穿孔等制作方法比较,模型稳定、便于脓毒症的严重阶段的实验研究,与我们以往报道基本一致[1]。炎症介质过度释放、炎症反应失控是脓毒症的中心环节,即使病因去除病程仍在进展,容易演变成脓毒性休克和多器官功能障碍,病情凶险,死亡率高[2]。因此如何干预或阻止脓毒症的恶化进程成为近来研究的热点。
肾素-血管紧张素系统(RAS)可独立存在于血管、心脏、肾脏等局部组织器官中,作为激素的血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)被证实也是一种促炎因子,在脓毒症严重阶段机体RAS系统异常激活,AngⅡ在血浆和局部组织器官内急剧增高[3],其生物学作用主要依赖AT1R介导,促使大量促炎细胞因子、活性氧族、脂质过氧化物等生成,严重损害组织细胞[4-5]。本研究检测出脓毒症大鼠血浆IL-1β和TNF-α等促炎细胞因子浓度明显升高,自由基NO及脂质过氧化物MDA的血浆浓度也比对照组明显升高,这与以往的报道基本一致[6-7]。当应用AT1R拮抗剂氯沙坦干预脓毒症大鼠后,发现IL-1β、TNF-α及NO、MDA等的血浆浓度均明显回落,可见过度激活的RAS受到抑制后,机体炎症反应得到一定的控制,同时NO释放减少,脂质过氧化程度也降低,从而控制或延缓脓毒症的病理进程。为进一步探讨AT1R拮抗剂对脓毒症大鼠的可能保护机制,本研究选用了NF-κB的主要抑制蛋白IκB进行评价。LPS作为病原相关分子模式(pathogen-associated molecular pattern,PAMP)与其模式识别受体(pattern recognition receptor,PRR)结合后通过多条信号转导途径介导 NF-κB 活化[8],而 NF-κB 参与了炎症过程中多种信号转导途径,IL-1β、TNF-α等促炎细胞因子的生成大多受 NF-κB的调控[9],并且NF-κB与促炎细胞因子形成一个循环放大的过程[10],此外,LPS、NF-κB 及促炎细胞因子都能激活诱导型一氧化氮合酶(iNOS),活化的iNOS刺激血管内皮细胞、平滑肌细胞、单核/巨噬细胞等大量合成释放NO从而加重脓毒症的病理反应[11],因此干预NF-κB的活化成为研究的热点。在本实验中通过RT-PCR和Western blot方法发现感染性休克时大鼠胸主动脉IκB mRNA和蛋白的表达均明显下调,并且蛋白表达下降的幅度较mRNA更为明显,推测IκB蛋白表达低下除了与基因转录水平下调有关外,还与IκB蛋白部分被磷酸化转化成p-IκB相关,从而促使活性 IκB绝对数量低下,导致 NF-κB大量激活发挥系列生物学作用。当应用氯沙坦干预后,脓毒症大鼠IκB mRNA和蛋白的表达均明显升高。由此推测,异常激活RAS受到抑制后,表达上调的IκB在胞质中与NF-κB二聚体结合形成复合物,抑制NF-κB进入细胞核发挥转录激活作用,并且也可直接在细胞核内抑制NF-κB与DNA的结合,甚至还能够将NF-κB复合体从DNA上移开,与NF-κB 结合后使得 NF-κB/IκB 复合体从核内排出[12],导致 NF-κB 的生物活性明显降低。
综上所述,AT1受体拮抗剂通过抑制过度激活的RAS系统,减轻促炎细胞因子、自由基NO和脂质过氧化物等对脓毒症大鼠产生明显的抗炎作用,该保护作用可能与其提高IκB表达继而降低NF-κB的活性相关。
[1] 廖丽君,景 亮.抗氧化剂对内毒素性休克大鼠α1-肾上腺素能受体mRNA表达的影响[J].中华麻醉学杂志,2006,26(2):155-8.
[1] Liao L J,Jing L.Effect of antioxidant on the gene expression of α1-adrenergic receptors during endotoxic shock in rats[J].Chin J Anesth,2006,26(2):155 -8.
[2] Shapiro N,Howell M D,Bates D W,et al.The association of sepsis syndrome and organ dysfunction with mortality in emergency department patients with suspected infection[J].Ann Emerg Med,2006,48(5):583 -90.
[3] Bregonzio C,Armando I,Ando H,et al.Anti-inflammatory effects of angiotensinⅡAT1 receptor antagonism prevent stress-induced gastric injury[J].Am J Physiol Gastrointest Liver Physiol,2003,285(2):414-23.
[4] Ferrario C M,Strawn W B.Role of the renin-angiotensin-aldosterone system and proinflammatory mediators in cardiovascular disease[J].Am J Cardiol,2006,98(1):121 -8.
[5] Mehta P K,Griendling K K.AngiotensinⅡ cell signaling:physiological and pathological effects in the cardiovascular system[J].Am J Physiol Cell Physiol,2007,292(1):82 -97.
[6] Sanchez-lemus E,Murakami Y,Larrayoz-Roldan I M,et al.AngiotensinⅡAT1 receptor blockade decreases lipopolysaccharide-induced inflammation in the rat adrenal gland[J].Endocrinology,2008,149(10):5177 -88.
[7] Sang H,Wallis G L,Stewart C A,et al.Expression of cytokines and activation of transcription factors in lipopolysaccharide-administered rats and their inhibition by phenyl N-tert-butylnitrone(PBN)[J].Arch Biochem Biophys,1999,363(2):341 -8.
[8] Cauwels A.Nitric oxide in shock[J].Kidney Int,2007,72(5):557-65.
[9] 马悦颖,刘建勋.AS炎性信号通路与中药干预[J].中国药理学通报,2011,27(6):745 -7.
[9] Ma Y Y,Liu J X.Progression on inflammatory signaling pathway of atherosclerosis and the intervention of TCM[J].Chin Pharmacol Bull,2011,27(6):745 - 7.
[10]刘 义,吴昆鹏,杨巧珠,等.小分子肽(KP)对小鼠成骨前体细胞MC3T3-E1增殖分化及NF-κB表达的影响[J].中国药理学通报,2011,27(3):423 -7.
[10] Liu Y,Wu K P,Yang Q Z,et al.The effect of the small molecular weight peptide(KP)on the proliferation,differentiation of mouse MC3T3-E1 cells and the expression of NF-κB[J].Chin Pharmacol Bull,2011,27(3):423 -7.
[11] Fernandes D,Assreuy J.Nitric oxide and vasular reactivity in sepsis[J].Shock,2008,30(1):10 -3.
[12] Shen L,Mo H,Cai L,et al.Losartan prevents sepsis-induced acute lung injury and decreases activation of nuclear factor κB and mitogen-activated protein kinases[J].Shock,2009,31(5):500 -6.
