芪参益气滴丸对糖尿病大鼠视网膜谷氨酸转运体及谷氨酰胺合成酶表达的影响
2011-07-27邓辉金明苑维潘琳
邓 辉 金 明 苑 维 潘 琳
高浓度谷氨酸(glutamate,Glu)的兴奋性毒性是造成视网膜神经细胞损伤的一个重要因素。已有研究发现,糖尿病视网膜病变(diabetic retinopathy,DR)早期就有Glu循环障碍,导致细胞外Glu过量堆积,浓度升高,引起视网膜神经节细胞死亡〔1-2〕。视网膜Glu浓度的调节主要由Müller细胞通过谷氨酸转运体(glutamate-aspartate transporters,GLAST)和谷氨酰胺合成酶(glutamine synthetase,GS)来完成,GLAST、GS功能及数量的减弱将导致其转运Glu的能力下降。益气活血类中药(芪参益气滴丸)对中枢神经、周围神经具有神经营养因子样作用,能增强胶质细胞的代偿作用、促进损伤变性的神经细胞修复的作用〔3-5〕。本实验通过观察GLAST和GS在糖尿病大鼠视网膜表达的变化,探讨芪参益气滴丸对GLAST和GS表达的影响以及对视网膜神经细胞保护作用的机制。
1 材料和方法
1.1 实验动物
选用SPF级6周龄雄性SD大鼠40只,体重180~220克(购自维通利华实验动物技术有限责任公司)。
1.2 实验药品及仪器
芪参益气滴丸(天津天士力制药股份有限公司,批号20050305);羟苯磺酸钙胶囊(西安利君制药有限公司,批号 060118);链脲佐菌素(streptozocin,STZ)(Sigma公司);兔抗人GLAST多抗、兔抗人GS多抗(abcam公司);LSAB通用试剂盒(Dako公司);牛血清白蛋白(bovine serum albumin,BSA)(Dako 公司);二氨基联苯胺(diaminobenzidine,DAB)(Sigma公司);SAKURA CRM-440型病理切片机;SAKURA Tissue-Tek TECTM5 SM C1-042-SO型组织包埋机;Olympus BH-2光学显微镜;OLYMPUS BX-51数码照相装置;Image Plus Pro6.0图象分析系统。
1.3 动物模型的制作
SD大鼠适应性饲养1周后,随机选取10只为正常对照组(正常组),其余30只制作糖尿病大鼠模型。造模前大鼠禁食12小时,STZ在临用时用无菌0.1 mmol/L,PH 4.4柠檬酸钠缓冲液配成1%STZ溶液,按65 mg/Kg大鼠体重,左下腹腔内一次性注射,正常对照组注射同等体积的生理盐水。72小时后取尾静脉血,用快速血糖仪(Roche血糖仪,乐康全血糖检测试纸)测量血糖。测血糖前8小时大鼠禁食。凡血糖≥16.7 mmol/L者即为糖尿病大鼠模型。
1.4 分组给药
造模成功的糖尿病大鼠随机分为糖尿病模型组(模型组)10只,芪参益气滴丸治疗组(治疗组)10只,羟苯磺酸钙胶囊治疗组(对照组)10只。治疗组和对照组大鼠在造模成功后次日开始给药,每日上午灌胃给药1次,分别给予芪参益气滴丸、羟苯磺酸钙胶囊的药物溶液,剂量均为0.5 g/kg(正常成人剂量的20倍),芪参益气滴丸、羟苯磺酸钙胶囊用蒸馏水配成100 mg/ml的药物溶液,每周配制1次,保存在4℃冰箱。正常组大鼠给予生理盐水1 ml灌胃。实验期间定期测量大鼠体重及血糖,实验周期300 d。
1.5 制备视网膜切片
实验结束后颈动脉放血处死大鼠,立即摘取眼球,置于 4%多聚甲醛(4℃,24 h)固定,沿角膜缘剪开眼球壁,去除角膜、晶状体、玻璃体,余下的眼杯放入固定液中再固定48 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,连续切片(SAKURA CRM-440型病理切片机),切片厚度为 3μm。
1.6 GLAST、GS免疫组织化学染色
采用标记链霉亲合素-生物素过氧化物酶法(labeled strepto-avidin-biotinperoxidase,LSAB), 具体操作步骤如下:①石蜡切片脱蜡,梯度乙醇水化;②流水漂洗5 min,磷酸盐缓冲液(phosphate buffered saline,PBS)洗 5 min,2 次;③ 3%H2O2氧化 15 min,以消除内源性过氧化物酶,流水漂洗5 min,PBS洗5 min,2 次;④滴加 BSA(10%正常牛血清),室温,湿盒孵育20 min;⑤在不同切片上,滴加一抗:兔抗人GLAST 多抗 1∶800 及兔抗人 GS 多抗 1∶50,4℃,湿盒孵育24 h,PBS洗5 min,3次;⑥滴加LSAB二抗,室温,湿盒孵育90 min,PBS洗5 min,3次;⑦滴加LSAB三抗,室温,湿盒孵育 90 min,PBS洗 5 min,3次;⑧DAB显色3 min,流水洗5 min;⑨部分切片苏木素复染30 s~1 min,未复染者作图象分析用,流水洗3 min;⑩梯度酒精脱水,风干,二甲苯透明,中性树脂封片。
所得切片在光学显微镜下观察、拍照,未复染切片用Kodak公司的Image Plus Pro6.0图象分析系统进行定量分析:每只大鼠取2张切片,每张切片在200倍下随机选取10处视野,计算阳性表达的积分光密度(integrated optical density,IOD)值(细胞浆中棕黄色颗粒为阳性表达),IOD值=面积×平均光密度。
1.7 统计学处理
计数资料用均数±标准差表示,用SPSS 10.0软件进行数据处理,均数间的两两比较采用q检验,检验水准为α=0.05。
2 结果
GLAST、GS在各组大鼠视网膜各层组织中均有表达,其中以内颗粒层、神经节细胞层及内丛状层着色反应最强,为深棕褐色,其余各层也可见丝条状贯穿于内外界膜之间的阳性染色,模型组大鼠视网膜着色反应最弱(图1~8)。Image Plus Pro6.0图象分析显示,治疗组、模型组、对照组的视网膜GLAST、GS阳性表达IOD值低于正常组,差异有统计学意义(P<0.05);治疗组 GLAST、GS 的 IOD 值明显高于模型组和对照组(P<0.05)(表 1)。
表1 各组大鼠视网膜中GLAST、GS阳性表达的IOD值(,n=10)

表1 各组大鼠视网膜中GLAST、GS阳性表达的IOD值(,n=10)
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05,③与模型组比较,P>0.05;④与对照组比较,P<0.05。
组别 GLAST GS正常组 7.639±0.695 8.013±0.052治疗组 6.820±0.404①②④ 6.532±0.073①②④模型组 5.491±0.121① 3.142±0.063①对照组 5.749±0.056①③ 4.743±0.232①②
3 讨论
越来越多的研究表明,糖尿病患者的视网膜神经纤维功能改变,出现在可见的微血管改变之前〔6〕。因此除了视网膜微血管损害外,DR还是一种神经组织的慢性退行性病变,包括神经细胞凋亡增加、大胶质细胞反应性增生、小胶质细胞激活和谷氨酰胺(glutamine,Gln)代谢异常。这些变化可改变血管通透性,使过多的谷氨酸(glutamate,Glu)从血液中进入视网膜内,而Glu含量升高也可以诱发视网膜神经的退行性病变〔7〕。
Glu是视网膜最主要的兴奋性神经递质,光感受器、双极细胞和神经节细胞都以Glu为递质〔8〕,不同浓度的Glu代表不同的信号传递,高浓度的Glu具有兴奋性毒性,其产生过多(或)清除减少是引起神经细胞死亡的重要机制。目前知道视网膜通过Glu-Gln循环来维持细胞外Glu浓度的稳定,以保持其正常的生理功能:首先,Müller细胞内合成的Glu在GS的作用下转变为Gln,继而被Müller细胞释放到胞外,再被神经细胞摄取至胞内,在磷酸化的谷氨酰胺酶作用下,转变为Glu,作为神经递质释放到突触间隙,部分Glu与受体结合发挥作用,部分Glu通过Müller细胞胞膜上高亲和力的GLAST结合转运到Müller细胞内,进入下一个循环。在这个循环中,Müller细胞扮演着重要角色,它利用胞膜上的GLAST和胞内的GS对Glu进行转运、降解(GS只存在于 Müller细胞内〔9〕),是视网膜内清除细胞外过量Glu的主要神经胶质细胞。GLAST、GS的功能和数量决定了Müller细胞对视网膜神经节细胞(retinal ganglion cells,RGCs)免受 Glu 毒性损害保护作用的强弱。
在DR时,Müller细胞调节细胞外Glu水平的能力受到损害,Müller细胞将Glu转化为Gln的能力下降,造成视网膜内的Glu水平上升。
本实验采用免疫组化LSAB法测量GLAST、GS在视网膜内的表达,结果糖尿病模型组大鼠视网膜细胞GLAST、GS阳性表达的IOD值较正常组明显减少(P<0.05),提示视网膜 Müller细胞胞膜 GLAST及胞内GS功能的改变可能是导致其转运细胞外谷氨酸的能力受到破坏,使细胞外谷氨酸过量堆积,引起神经细胞死亡的原因。
芪参益气滴丸由黄芪、丹参、三七及降香组成。现代药理研究证实,黄芪可以减少自由基的过氧化反应,增强抗氧化酶的活性,提高动物的耐缺氧能力,减轻神经细胞的损害,促进损伤后神经功能的恢复;丹参素和丹参酮能增强视网膜血管及视神经纤维的耐缺氧能力,改善缺氧缺血损伤所致的线粒体氧化磷酸化功能障碍,调节细胞能量代谢,抑制神经细胞的凋亡,对神经细胞及其轴突具有保护作用;三七皂甙可抑制神经细胞的凋亡过程,对神经细胞损伤具有保护作用。我们在本实验观察到,芪参益气滴丸治疗组视网膜 Müller细胞GLAST、GS阳性表达IOD值较模型组明显增强(P<0.05),提示芪参益气滴丸能够促进Müller细胞GLAST及GS的表达,减轻DM对其功能和数量的影响,从而有效清除细胞外过量的Glu,减轻高浓度Glu的兴奋性毒性作用,可对神经细胞起保护作用。
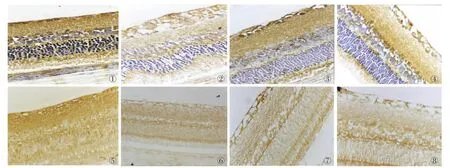
图1 GLAST在正常组视网膜的表达。LSAB法×400,苏木素复染。图2 GLAST在模型组视网膜的表达。LSAB法×400,苏木素复染。图3 GLAST在治疗组视网膜的表达。LSAB法×400,苏木素复染。图4 GLAST在对照组视网膜的表达。LSAB法×400,苏木素复染。图5 GS在正常组大鼠视网膜的表达。LSAB法×400,未复染。图6 GS在模型组大鼠视网膜的表达。LSAB法×400,未复染。图7 GS在治疗组大鼠视网膜的表达。LSAB法×400,未复染。图8 GS在对照组大鼠视网膜的表达。LSAB法×400,未复染。
[1]Barber AJ.A new view of diabetic retinopathy:a neurodegenerative disease of the eye[J].Prog Retin Eye Res,2003,27(2):283-290.
[2]Ward M,Jobling A,Kalloniatis M,et al.Glutamate uptake in retinal glial cells during diabetes[J].Diabetologia,2005,48(3):351-360.
[3]王沙燕,赖 真,耿小英,等.黄芪对脑缺血再灌注星形胶质细胞的影响[J].中国中医基础医学杂志,2003,9(4):41-42.
[4]袁恒杰.丹参素药理作用研究新进展[J].中国医院药学杂志,2006,26(5):604-606.
[5]郭志松,邵换璋.三七总皂甙对脑出血大鼠的神经细胞保护作用[J].中国实用神经疾病杂志,2009,12(11):42-44.
[6]Frank RN.Diabetic retinopathy[J].N Engl J Med,2004,350(1):48-58.
[7]卢 艳.糖尿病早期视网膜神经退行性病变[J].眼科新进展,2007,27(6):460-462.
[8]Kofuji P,Biedermann B,Siddharthan V,et al.Kir potassium channel subunit expression in retinal glial cells:implication for spatial potassium buffering[J].Glia, 2002, 39(2):292-303.
[9]Shaked I,Ben-Dror I,Vardimon L.Glutamine synthetase enhances the clearance of extracellular glutamate by the neural retine[J].J Neurochem, 2002, 83(4):574-580.
