氢氧化钙和洗必泰抑制粪肠球菌的抗菌性检测
2011-07-27陈贵敏葛兰兰
陈贵敏,潘 炜,葛兰兰
(南京军区福州总医院口腔科,福建 福州 350025)
根管内细菌在根尖周炎的发生发展起着重要作用,牙髓治疗的目的就是去除根管内的微生物[1]。目前尽管机械清理和根管预备可以减少根管内的微生物,但还不能完全清除侧支根管、副根管和根尖分歧等部位的微生物[2]。因此,合理的根管用药对于进一步降低根管内细菌是必需的。
氢氧化钙是牙髓治疗中一种常用的药物,可通过增加环境中的pH值而发挥抗菌作用[3]。洗必泰因具有广谱的抗菌性也被作为根管治疗药物用于临床,而且当洗必泰和阴离子结合后还可以逐步释放,能保持长久的抗菌性[4]。有研究报道氢氧化钙与洗必泰联合使用比单独使用氢氧化钙具有更好的抗菌性,同时也具有良好的生物相容性,因此不会对后续的根管充填产生影响[5]。
粪肠球菌是一种G+菌,是持续性感染根管中最常检出的细菌,而且可以进入到牙本质小管深层,具有抵抗牙髓治疗过程中杀菌剂的作用[6]。此外粪肠球菌还具有一定的耐饥饿能力,位于牙本质小管中的粪肠球菌由于营养不足,经常处于一种饥饿状态,饥饿态的粪肠球菌具有更强的抵抗抗菌剂的能力[7-8]。本研究旨在观察比较洗必泰单独或与氢氧化钙联合使用对根管内粪肠球菌的杀菌效果。
1 材料和方法
1.1 离体牙和菌株准备
收集因正畸减数拔除的60个单根牙,PBS清洗表面,用Protaper根管锉预备至F3后,分别从釉牙本质界下2 mm处和根尖上4 mm处截除牙冠和根尖,保留牙根中段约8 mm,贮存于生理盐水中备用。取-70℃冻存的粪肠球菌ATCC 29212(上海坤肯生物化工有限公司),划线接种于BHI琼脂培养基(Difco,美国),37℃厌氧环境下(800 mL/L N2,100 mL/L CO2,100 mL/L H2)培养24 h,挑单克隆菌落接种于5 mL的BHI培养液中过夜培养,调细菌密度为109cfu/mL,备用。
1.2 感染根管模型的构建
所有牙根标本经120℃高温高压灭菌处理20 min后,随机抽取1个根管标本置BHI培养液中,分别置37℃厌氧条件和孵箱中各培养24 h,确定无细菌生长后(以培养液未见混浊为灭菌成功),把所有牙根标本置24孔板中,每孔中一个牙根标本,然后加入粪肠球菌菌悬液,并使之浸没牙根,37℃厌氧条件下培养21 d,每3 d更换1次新鲜菌悬液,并对细菌进行革兰氏染色和形态学鉴定。培养21 d后,取出所有标本用无菌生理盐水冲洗,吸潮纸尖干燥,并随机抽取一个感染的根管模型进行固定,梯度脱水,干燥,进行扫描电镜观察。
1.3 根管封药
将60个成功建立粪肠球菌感染的根管,随机分为3个实验组和1个空白对照组,每组15个牙根,分别用注射器将氢氧化钙糊剂(Meta PEX,美国)、20 g/L洗必泰凝胶、氢氧化钙糊剂联合20 g/L洗必泰凝胶、无菌生理盐水(空白对照组)注满相应组的各样本根管腔内,直至溢出为止,所有操作均在无菌条件下进行。然后去除溢出的药物,用丁香油水门汀封闭各样本冠方和根方开口,每一标本均用无菌湿纱片覆盖,培养皿中37℃置放14 d。
1.4 杀菌效果观察
封药14 d后,去除各样本暂封材料,用5 mL无菌PBS冲洗根管两次,再根据不同药物分别使用相应的中性液冲洗以中和根管内的药物(5 g/L柠檬酸中和氢氧化钙,0.5%吐温80和0.07%大豆卵磷脂中和20 g/L洗必泰凝胶),再用无菌生理盐水冲洗1次,纸尖干燥根管。每个标本先用5号GG钻钻取根管内壁深约 0~100μm,同时用10 mL无菌生理盐水冲洗并收集洗出液,然后再用6号GG钻钻取根管内壁深约100~200μm,同时用10 mL无菌生理盐水冲洗,并收集洗出液,将两次收集的含有牙本质碎屑的洗出液分别置15 mL离心管中高速离心(10000 r/min,4℃,10 min),弃上清,加入1 mL BHI培养液充分震荡2 min,进行10倍梯度稀释后,取100 μL铺于BHI琼脂平板表面,37℃培养24 h,进行菌落计数,计算各组的活菌数,取对数值。
1.5 统计学分析
采用SPSS 15.0统计软件进行单因素方差分析,两两比较采用 Tukey HSD检验,检验水准α =0.05。
2 结果
2.1 粪肠球菌感染根管模型的确定
建模21 d后,扫描电镜发现牙本质小管内有较多的粪肠球菌存在,并且小部分粪肠球菌已渗入到牙本质小管的深层(图1)。

图1 粪肠球菌感染根管模型,牙本质小管内见有粪肠球菌(5000×)
2.2 各处理组不同深度牙本质粪肠球菌计数
无论在根管壁深0~100μm处还是在100~200μm处,空白对照组均有大量的细菌生长。而3个实验组根管内粪肠球菌生长则明显减少,分别与空白组比较,差异均有统计学意义(P<0.05)。各实验组之间相比,氢氧化钙组活菌数最高,与其他两组相比,差异均有统计学意义(P<0.05),其次为洗必泰组,洗必泰联合氢氧化钙组最低,但与单独使用洗必泰组相比,无统计学差异(P>0.05)(图2)。
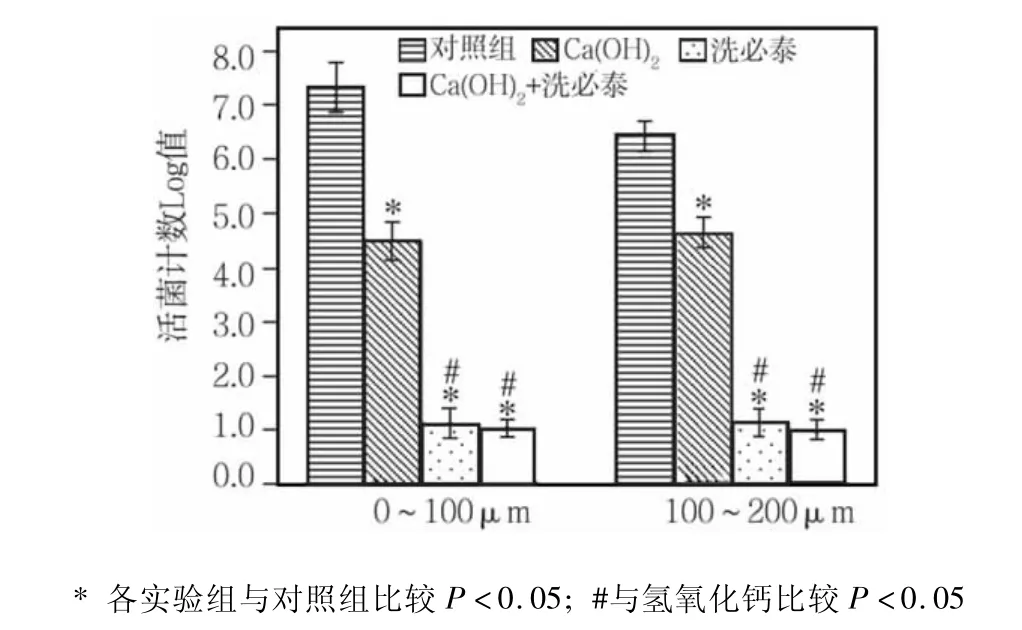
图2 各处理组不同深度牙本质样本粪肠球菌计数比较(log,)
3 讨论
牙髓治疗的主要目的彻底去除根管内的感染物质和微生物,虽然生理性的机械预备可以去除根管内大部分微生物,但由于根管系统的复杂性,合理的根管用药是必不可少的。文献报道根管中粪肠球菌具有高度抵抗抗菌剂的能力,主要因为根管中的粪肠球菌可能处于一种饥饿状态,而饥饿态粪肠球菌具有更强的抵抗抗菌剂的能力;此外,粪肠球菌还可以进入牙本质小管深层,躲避药物的作用[7-9]。而且粪肠球菌具有极强的生命力和适应能力,目前尚缺乏治疗粪肠球菌感染的理想药物。虽然氢氧化钙可以有效去除很多微生物,但一些相关的研究发现,粪肠球菌对氢氧化钙具有一定的抵抗能力[10-12],而对洗必泰可能更敏感[13]。
氢氧化钙的抗菌特性主要归于其碱性和破坏细胞膜、致蛋白质变性、破坏细菌DNA的能力[3];洗必泰可穿透细菌而对细菌发挥毒性作用[14]。氢氧根离子和洗必泰均可通过分裂细胞膜而发挥杀菌作用。此外,洗必泰可以在碱性环境下诱导活性氧簇的产生,活性氧簇产物可通过氧化亚氮破坏细胞壁和质膜,从而抑制粪肠球菌生长[15]。但是也有研究报道,洗必泰和氢氧化钙结合后,会降低洗必泰的抗菌活性[16]。本研究表明洗必泰单独和联合氢氧化钙其抗菌性没有明显差异,并且洗必泰结合氢氧化钙糊剂可以长期保存于根管中,对根除持续性感染的致病菌起着比较重要作用。
本研究在建立粪肠球菌感染根管模型的基础上,分别观察了氢氧化钙、洗必泰以及氢氧化钙联合洗必泰根管封药对根管内粪肠球菌抗菌性,结果显示,各药物处理组均对粪肠球菌有一定的抑制作用,其中以氢氧化钙联合洗必泰组最好,但洗必泰单独或联合氢氧化钙时对粪肠球菌的抑制作用无明显差异,与Zerella等研究相一致[13]。而氢氧化钙的抗菌性最弱,提示洗必泰在牙髓治疗中,特别针对粪肠球菌感染时可能更有效。
[1]Vianna ME,Horz HP,Conrads G,et al.Effect of root canal procedures on endotoxins and endodontic pathogens[J].Oral Microbiol Immunol,2007,22(6):411 -418.
[2]Vianna ME,Gomes BP.Efficacy of sodium hypochlorite combined with chlorhexidine against Enterococcus faecalis in vitro[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2009,107(4):585-589.
[3]Siqueira JF Jr,Lopes HP.Mechanisms of antimicrobial activity of calcium hydroxide:a critical review[J].Int Endod J,1999,32(5):361-369.
[4]Lee Y,Han SH,Hong SH,et al.Antimicrobial efficacy of a polymeric chlorhexidine release device using in vitro model of Enterococcus faecalis dentinal tubule infection [J].J Endod,2008,34(7):855-858.
[5]Kontakiotis EG,Tsatsoulis IN,Papanakou SI,et al.Effect of 2%chlorhexidine gel mixed with calcium hydroxide as an intracanal medication on sealing ability of permanent root canal filling:a 6-month follow-up[J].J Endod,2008,34(7):866 -870.
[6]Haapasalo M,Orstavik D.In vitro infection and disinfection of dentinal tubules[J].J Dent Res,1987,66(8):1375 -1379.
[7]Oliver JD.The viable but nonculturable state in bacteria[J].J Microbiol,2005,43:93 -100.
[8]Signoretto C,Lleo MM,Tafi MC,et al.Cell wall chemical composition of Enterococcus faecalis in the viable but nonculturable state[J].Appl Environ Microbiol,2000,66(5):1953 -1959.
[9]Tong Z,Zhou L,Li J,et al.In vitro evaluation of the antibacterial activities of MTAD in combination with Nisin against enterococcus faecalis[J].J Endod,2011,37(8):1116 -1120.
[10]Evans M,Davies JK,Sundqvist G,et al.Mechanisms involved in the resistance of Enterococcus faecalis to calcium hydroxide[J].Int Endod J,2002,35(3):221 -228.
[11]Gomes BP,Ferraz CC,Vianna ME,et al.In vitro antimicrobial activity of several concentrations of sodium hypochlorite and chlorhexidine gluconate in the elimination of Enterococcus faecalis[J].Int Endod J,2001,34(6):424 -428.
[12]Sukawat C,Srisuwan T.A comparison of the antimicrobial efficacy of three calcium hydroxide formulations on human dentin infected with Enterococcus faecalis[J].J Endod,2002,28(2):102-104.
[13]Zerella JA,Fouad AF,Spangberg LS.Effectiveness of a calcium hydroxide and chlorhexidine digluconate mixture as disinfectant during retreatment of failed endodontic cases[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2005,100(6):756-761.
[14]Lindskog S,Pierce AM,Blomlof L.Chlorhexidine as a root canal medicament for treating inflammatory lesions in the periodontal space[J].Endod Dent Traumatol,1998,14(4):186 -190.
[15]Nishikawa T,Sato E,Choudhury T,et al.Effect of nitric oxide on the oxygen metabolism and growth of E.faecalis[J].J Clin Biochem Nutr,2009,44(2):178-184.
[16]de Souza-Filho FJ,Soares Ade J,Vianna ME,et al.Antimicrobial effect and pH of chlorhexidine gel and calcium hydroxide alone and associated with other materials[J].Braz Dent J,2008,19(1):28-33.
