朱砂七提取物对α-葡萄糖苷酶的抑制作用
2011-07-26王晓梅袁菊丽
王晓梅,袁菊丽
(宝鸡文理学院化学化工系 陕西省植物化学重点实验室,陕西 宝鸡 721013)
随着人们生活方式的改变,糖尿病的发病率日趋升高。糖尿病主要是由于体内胰岛素相对或绝对不足所引起的糖代谢紊乱所致。降低餐后血糖、减少并发症的发生是糖尿病治疗的重要内容。中药治疗糖尿病虽然降糖效果较西药弱,但疗效稳定、作用温和、不良反应少,能有效防治并发症。近年来,从中草药及其提取物中筛选α-葡萄糖苷酶抑制剂的研究引起了很多学者的关注并取得了一定进展[1~3]。
朱砂七为蓼科植物毛脉蓼[Polygonumcillinerve(Nakai)Ohwi]的干燥块根,主产于陕西秦岭,是“太白七药”之一。朱砂七含有多种活性成分,具有清热解毒、凉血利咽、止血止泻、祛风湿、强腰膝、抗肿瘤的功效[4,5]。
作者在此分别提取朱砂七鞣质和朱砂七多糖,考察其对α-葡萄糖苷酶的体外抑制作用,拟为探讨其降糖机理及扩大朱砂七的治疗范围提供参考。
1 实验
1.1 材料、试剂与仪器
朱砂七购自太白山区,经陕西中医学院胡本祥教授鉴定。
α-葡萄糖苷酶,美国Sigma公司;对硝基苯-α-D-吡喃葡萄糖苷(pNPG,纯度99%),美国Merck公司;二甲基亚砜(DMSO),莱阳化工实验厂;去离子水,自制;其余试剂均为市售分析纯。
DK-98-1型电热恒温水浴锅,天津市泰斯特仪器有限公司;752N型紫外可见分光光度计,上海精密科学仪器有限公司;KQ5200E型超声波清洗器,昆山市超声仪器有限公司;BS-244-SS型电子天平,赛多利斯科学仪器有限公司;R-1002型旋转蒸发仪,郑州长城科工贸有限公司。
1.2 方法
1.2.1 朱砂七提取物的制备
1.2.1.1 朱砂七鞣质的提取
称取粉碎的50 g朱砂七,加入750 mL 60%乙醇,于70 ℃下超声提取2次,每次50 min。合并2次提取液,抽滤,弃去残渣,将滤液减压蒸馏,回收乙醇,馏分即为鞣质粗液。加入等体积乙醚萃取,分出水液层,再用等体积乙酸乙酯萃取,水液层经减压浓缩得朱砂七鞣质,乙酸乙酯层经减压浓缩、回收乙酸乙酯而得朱砂七鞣质。
1.2.1.2 朱砂七多糖的提取
称取60 g朱砂七,加入600 mL蒸馏水,于95 ℃回流提取2 h,收集提取液,药渣如法再次提取。合并2次提取液,减压浓缩,向浓缩液加入95%乙醇至乙醇浓度为80%,静置过夜,抽滤,收集滤渣。用95%乙醇、石油醚、乙醚依次洗涤,在50 ℃的干燥箱中烘干而得朱砂七多糖。
1.2.2 朱砂七提取物的分析检测
朱砂七鞣质检测采用醋酸锌络合滴定法及磷钼钨酸比色法。
朱砂七多糖检测采用硫酸-蒽酮法、α-萘酚法。
1.2.3 朱砂七提取物对α-葡萄糖苷酶活性的影响
参照文献[6,7] ,测定朱砂七提取物对α-葡萄糖苷酶的抑制活性。
酶活力单位定义为:37 ℃、pH值6.8条件下,每分钟水解pNPG释放1 μmol 对硝基苯酚(pNP)所需的酶量,定义为一个酶活力单位(U)。
向10 mL试管中依次加入pH值6.8的磷酸盐缓冲溶液1.85 mL、0.1 U·mL-1的α-葡萄糖苷酶50 μL、不同浓度(0 mg·mL-1、0.5 mg·mL-1、1.0 mg·mL-1、1.5 mg·mL-1、2.0 mg·mL-1、2.5 mg·mL-1、3.0 mg·mL-1、3.5 mg·mL-1) 的朱砂七提取物溶液50 μL、0.0116 mol·L-1pNPG 50 μL,将上述反应体系在37 ℃保温30 min后,加入0.1 mol·L-1Na2CO3溶液8 mL终止反应,然后在400 nm波长处测吸光度(A)。朱砂七提取物终浓度分别为0 μg·mL-1、2.5 μg·mL-1、5.0 μg·mL-1、7.5 μg·mL-1、10.0 μg·mL-1、12.5 μg·mL-1、15.0 μg·mL-1和17.5 μg·mL-1。每个浓度体系同时作3个平行,取平均值。同时设不加酶的样品空白组、不加样品的无样品组、不加样品和酶的无样空白组。
按下式计算朱砂七提取物对α-葡萄糖苷酶的抑制率。通过Prism软件求出IC50值。
式中:A样品为加入朱砂七提取物后酶反应的吸光度值;A样品空白为体系中加入朱砂七提取物但未加酶的吸光度值;A无样品为酶与底物反应后的吸收度值;A无样空白为体系中既无朱砂七提取物也无酶的吸光度值。
1.2.4 朱砂七提取物的抑制动力学研究
取不同浓度(0 mg·mL-1、1 mg·mL-1、2 mg·mL-1) 的朱砂七鞣质和朱砂七多糖,再分别加入不同浓度的底物(0.05 mol·L-1、0.1 mol·L-1、0.15 mol·L-1、0.2 mol·L-1、0.25 mol·L-1),测定反应速度,用Lineweaver-Burk作图法确定抑制类型。
2 结果与讨论
2.1 朱砂七提取物对α-葡萄糖苷酶活性的抑制作用(图1)
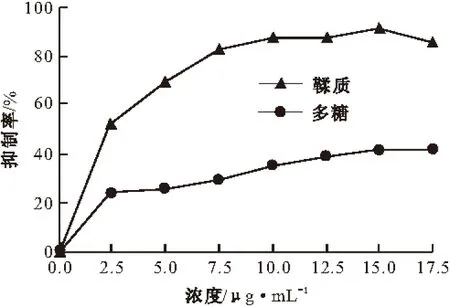
图1 朱砂七提取物对α-葡萄糖苷酶活性的影响
由图1可知,在一定浓度范围内,朱砂七鞣质和朱砂七多糖对α-葡萄糖苷酶活性均有抑制作用,且抑制作用均随提取物浓度的增大而增大。朱砂七鞣质浓度为15.0 μg·mL-1时抑制率最大,为91.3%;浓度继续增大,抑制率无明显变化,IC50值为1.6 μg·mL-1。而朱砂七多糖的抑制作用明显较朱砂七鞣质弱,当浓度为15.0 μg·mL-1时抑制率最大,为41.18%;浓度继续增大,抑制率无明显变化,IC50值为1.3 μg·mL-1。
2.2 朱砂七提取物对α-葡萄糖苷酶抑制类型的测定
在含不同浓度朱砂七鞣质的测活体系中,改变底物浓度([S]),测定酶促反应的初速度,Lineweaver-Burk双倒数作图,结果见图2。

图2 朱砂七鞣质对α-葡萄糖苷酶抑制机理的判断
由图2可知,得到一组相交于x轴的直线,直线斜率随样品浓度的变化而改变,最大反应速度(vmax)随样品浓度的变化而改变,而米氏常数(Km)不变。这可能是因为鞣质是多元酚类化合物,易与酶蛋白活性中心以外的多个部位结合,进而引起酶蛋白发生构象改变以至于活性降低,而对酶与pNPG的结合影响不大。由此判断朱砂七鞣质对α-葡萄糖苷酶的抑制机理当属非竞争性抑制类型。
在含不同浓度朱砂七多糖的测活体系中,改变底物浓度,测定酶促反应的初速度,Lineweaver-Burk双倒数作图,结果见图3。
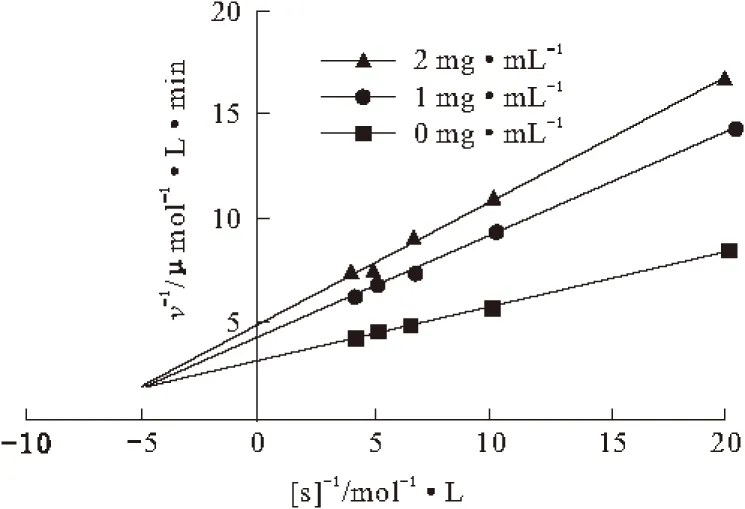
图3 朱砂七多糖对α-葡萄糖苷酶抑制机理的判断
由图3可知,得到一组相交于左上象限的直线,直线斜率随样品浓度的变化而改变,vmax随样品浓度的变化而改变,Km值随样品浓度的增大而增大。这可能是因为所提取的多糖为混合性成分,所含多糖种类较混杂,多糖与酶的结合位点可能为活性中心及活性中心以外的部位。由此判断朱砂七多糖对α-葡萄糖苷酶的抑制机理当属综合性抑制类型。
3 结论
分别提取朱砂七鞣质和朱砂七多糖,以对硝基苯-α-D-吡喃葡萄糖苷(pNPG)为底物,考察朱砂七提取物对α-葡萄糖苷酶活性的影响。结果发现,两种提取物对α-葡萄糖苷酶均具有抑制作用,其中朱砂七鞣质的抑制作用较朱砂七多糖更强;朱砂七鞣质和朱砂七多糖对α-葡萄糖苷酶活性的最大抑制率分别为91.3%和41.18%,IC50值分别为1.6 μg·mL-1和1.3 μg·mL-1。朱砂七鞣质和朱砂七多糖对α-葡萄糖苷酶活性的抑制机理分别属于非竞争性抑制类型和综合性抑制类型。
[1]张冉,刘泉,申竹芳,等.应用α-葡萄糖苷酶抑制剂高通量筛选模型筛选降血糖中药[J].中国药学杂志,2007,42(10):740-742.
[2]Chen H,Feng R,Guo Y,et al.Hypoglycemic effects of aqueous extract ofRhizomaPolygonatiOdoratiin mice and rats[J].J Ethnopharmacol,2001,74(3):225-229.
[3]Kim Y M,Jeong Y K,Wang M H,et al.Inhibitory effect of pine extract onα-glucosidase activity and postprandial hyperglycemia[J].Nutrition,2005,21(6):756-761.
[4]王晓梅,李健,郭进宝.朱砂七总蒽醌抑制亚硝化反应的研究[J].国际中医中药杂志,2010,32(4):355-356.
[5]王晓梅,李宗孝,任莉君.朱砂七多糖的抗氧化作用研究[J].安徽农业科学,2010,38(34):19346-19347,19510.
[6]Chapdelaine P,Tremblay R R,Dube J Y.p-Nitrophenol-α-D-glucopyranoside as substrate for measurement of maltase activity in human semen[J].Clin Chem,1978,24(2):208-211.
[7]张振,周晓惠.龙血竭各部位对α-D-葡萄糖苷酶的抑制作用[J].科技信息,2007,(27):35.
