拮抗油菜菌核病的海洋细菌筛选及其活性物质的分子检测
2011-07-26林建朋邵宗泽孙风芹张智涛喻子牛张吉斌
林建朋,邵宗泽,陈 莉,孙风芹,张智涛,喻子牛,张吉斌
(1.华中农业大学 农业微生物学国家重点实验室 微生物农药国家工程研究中心,湖北 武汉 430070;2.国家海洋局第三海洋研究所 海洋生物遗传资源重点实验室,福建 厦门 361005)
目前农业上对植物病原菌害的生物防治已经取得了一定的进展,但是对于很多的病原菌如油菜菌核、棉花枯萎、小麦纹枯等尚无非常有效的生物防治方法,因此对新型微生物资源和活性物质的寻找迫在眉睫。随着陆地生物源天然产物资源的逐渐减少,从陆地上发现对这些病原菌有抗菌活性的新型天然产物更加困难,因此科学家们将目光投向了占地球表面积达70%以上的海洋环境,尤其是海洋微生物,期待能从中发现具有新型结构的抗菌化合物[1]。海洋环境与陆地差异很大,高盐、高压、低营养、低温、低光照等极端环境赋予了其微生物种类的多样性和代谢方式的特异性[2,3]。
海洋微生物活性物质的相关研究从20 世纪60 年代逐步开始,近几年从海洋微生物中筛选的新型病原微生物拮抗菌及其代谢产物的研究逐年增多,2002 年发表的新型结构的677种海洋活性物质中有约1/5来自海洋微生物[4]。研究人员已从海洋细菌、放线菌和真菌中分离出众多抗菌、抗病毒、抗肿瘤、抗寄生虫的微生物及具有新分子结构的先导化合物[5,6],其中有些已经进入了临床研究阶段,而从海洋微生物中筛选抗重要作物病原菌的拮抗菌的研究仍较少。因此,作者从海洋细菌中筛选对重要作物病原菌有拮抗作用的拮抗菌,对于解决困扰人们的多种重要作物病害问题具有十分重要的意义。
1 实验
1.1 菌种与指示病原菌
海洋细菌共计1021株,由国家海洋局第三海洋研究所海洋生物遗传资源重点实验室和中国海洋微生物菌种保藏管理中心(MCCC)提供。
阳性对照菌株P.fluorescensCHA0、P.fluorescensPf-5、P.fluorescens2-79和P.fluorescensQ8r1-96由美国华盛顿州立大学植物病理系David Weller教授提供。
油菜菌核病病原真菌核盘菌[Sclerotiniasclerotiorum(Lib.) de Bary],由华中农业大学农业微生物学国家重点实验室菌种保藏中心(MGSC)提供。
1.2 培养基
1.2.1 海洋细菌培养基
海水培养基(MB):蛋白胨5 g,酵母粉1 g,天然海水(3.4%盐)1000 mL。
2216E培养基:配方详见文献[7]。
MLB培养基:蛋白胨10 g,酵母粉5 g,NaCl 10 g,蒸馏水1000 mL。
MHLB培养基:蛋白胨10 g,酵母粉 5 g,NaCl 30 g,蒸馏水1000 mL。
M2培养基:蛋白胨5 g,酵母粉1 g,醋酸钠5 g,天然海水1000 mL,pH值7.5~7.6。
PTA培养基:蛋白胨0.5 g,酵母膏0.5 g,葡萄糖0.2 g,蔗糖0.2 g,硝酸铵2 g,无水乙酸钠2 g,马铃薯浸出粉0.5 g,天然海水1000 mL,pH值7.4~7.5。
2 L培养基:蛋白胨10 g,酵母粉2 g,硝酸铵0.2 g,无水乙酸钠1 g,柠檬酸三钠0.5 g,普通肉汁培养基(粉)0.5 g,天然海水1000 mL,pH值7.5~7.6。
1.2.2 植物病原菌培养基
PDA培养基:新鲜去皮土豆200 g,蔗糖20 g,琼脂15 g,蒸馏水1000 mL。
1.3 方法
1.3.1 植物病原真菌核盘菌的活化与培养
从4 ℃保藏的试管斜面上取出小块核盘菌菌丝块,接于PDA培养基平板中央,置于25 ℃培养1~2 d,连续活化2~3次,待用。
1.3.2 海洋细菌的活化与培养
用灭菌处理过的牙签从-80 ℃保藏的甘油管中刮取少量所要筛选的海洋细菌冰块于相应的海洋细菌培养基上,待碎冰融化,水分完全被琼脂平板吸附后,使用接种环将细菌划线分离单菌落,置于20~28 ℃不等的培养箱中培养。待单菌落长出后,分别挑取海洋细菌单菌落于相应摇瓶培养基中,分别于20~28 ℃不等温度摇床培养2~7 d,待用。
1.3.3 抗油菜菌核病海洋细菌的筛选
(1)初筛。采用琼脂孔扩散法[8]筛选活性菌株。提前将活化好的病原真菌菌块接于PDA平板中央,在距平板中央病菌块周围等距离处打孔,在孔中加入20 μL的待测菌液上清,25 ℃培养1~2 d,观察结果并测量抑菌圈大小,每组3个重复,取平均值。
(2)复筛。通过初筛测定有活性的菌株,采用平板对峙培养法继续筛选2~3次,直至最后确定初筛得到菌株的活性。
1.3.4 拮抗假单胞菌活性物质的分子检测
对筛选得到的部分假单胞菌株进行活性物质的分子检测,利用如表1中的特异性引物[9~11]对所挑选的19株活性假单胞菌进行PCR扩增,硝吡咯菌素(Pyrrolnitrin,Prn)合成相关基因prnD的引物为PRND1和PRND2,阳性对照为P.fluorescensCHA0和P.fluorescensPf-5;2,4-二乙酰基间苯三酚(2,4-DAPG)合成相关基因phl的引物为PhlD1和PhlD2,阳性对照为P.fluorescensQ8r1-96;吩嗪(Phenazine,PCA))合成相关基因phzl的引物为PHZ1和PHZ2,阳性对照为P.fluorescens2-79;藤黄绿脓菌素(Pyoluteorin,Plt)合成相关基因pltC的引物为PLTC1和PLTC2,阳性对照为P.fluorescensPf-5。具体反应条件如下:采用25 μL体系:模板DNA 1 μL,上下游引物(10 pmol·L-1)各1 μL,2×Taq PCR mastermix(含染料)12.5 μL,ddH2O 9.5 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性1 min,Tm值退火45 s,72 ℃延伸1 min,计30次循环;72 ℃延伸10 min;4 ℃ forever。PCR产物直接进行0.8%琼脂糖凝胶电泳检测。
挑选目的菌株,对PCR产物进行纯化,连接T载体,挑选阳性转化子送至上海英骏生物技术有限公司(Invitrogen)测序。

表1 PCR反应特异性引物序列
2 结果与讨论
2.1 抗油菜菌核病的海洋细菌筛选结果
以油菜菌核盘菌为指示菌,总计筛选了1021株海洋来源的细菌菌株,分属于168个属,最终筛选得到144株活性菌株,属于40个属,占总筛选菌株数的14.1%、总筛选属数的23.8%。筛选的1021株海洋菌株主要集中在假单胞菌属(Pseudomonassp.)、假交替单胞菌属(Pseudoalteromonassp.)、芽孢杆菌属(Bacillussp.)、交替单胞菌属(Alteromonassp.)、食烷菌属(Alcanivoraxsp.)、微杆菌属(Microbacteriumsp.)等,分别占总筛选菌株数的29.6%、7.1%、7.1%、3.9%、3.8%、2.6%(见表2),另外还包括占总筛选菌株数32.3%的共计330株其它稀有来源的海洋菌属,如:贝尔曼氏菌属(Bermanellasp.)、比齐奥氏菌属(Bizioniasp.)、栖海胆菌属(Echinicolasp.)、生菌丝菌属(Myceligeneranssp.)、赫夫勒氏菌(Hoefleasp.)、预研菌属(Yokenellasp.)、滇微所菌属(Yimellasp.)、居绿藻菌属(Ulvibactersp.)、斯塔普氏菌属(Stappiasp.)、芽孢八叠球菌属(Sporosarcinasp.)等。

表2 拮抗油菜菌核病病原真菌的海洋细菌
其中筛选得到的活性菌株中包含假单胞菌属(Pseudomonassp.)共计50株,占总活性菌株数的34.7%;芽孢杆菌属(Bacillussp.)共计34株,占总活性菌株数的23.6%;科贝特氏菌属(Cobetiasp.)共计6株,占总活性菌株数的4.2%;盐单胞菌属(Halomonassp.)共计5株,占总活性菌株数的3.5%;食烷菌属(Alcanivoraxsp.)共计4株,占总活性菌株数的2.8%;微杆菌属(Microbacteriumsp.)共计3株,占总活性菌株数的2.1%;其它属共计38株,占总活性菌株数的26.4%。
1021株海洋细菌中总计筛选海洋假单胞菌株302株,得到50株活性菌株,活性菌株的比例为16.6%,主要分布在铜绿假单胞菌(P.aeruginosa)、杀香鱼假单胞菌(P.plecoglossicida)、摩氏假单胞菌(P.mosselii)、氧化吲哚假单胞菌(P.indoloxydans)、施氏假单胞菌(P.stutzeri)等种中(见表3),其中尤其以不同来源的铜绿假单胞菌(P.aeruginosa)菌株中活性菌株几率最高,总共筛选了13株铜绿假单胞菌,其中12株对油菜菌核病有抑制活性,筛得率高达92.3%,且12株铜绿假单胞菌对油菜菌核病抑制效果显著,抑菌圈直径平均在20 mm以上。

表3 拮抗油菜菌核病病原真菌的海洋假单胞菌
2.2 拮抗假单胞菌活性物质产生分析
利用特异性引物对筛选得到的19株活性假单胞菌(表4)进行活性物质的分子检测,其PCR扩增结果见图1。

图1 19株活性假单胞菌产活性物质分子检测图
由图1可知,菌株1A00318和SH-46以及阳性对照P.fluorescensCHA0、P.fluorescensPf-5经硝吡咯菌素合成基因的引物PRND1和PRND2扩增得到了大小约为786 bp的片段;菌株1A06832和SH-46以及阳性对照菌株P.fluorescensCHA0、P.fluorescensQ8r1-96、P.fluorescensPf-5经2,4-DAPG合成基因的引物PhlD1和PhlD2扩增得到了大小约为629 bp的片段;菌株1A04311、1A05429和1A01321以及阳性对照P.fluorescens2-79经吩嗪合成基因的引物PHZ1和PHZ2扩增得到了大小约为1408 bp的片段;菌株1A06832、1A00318和SH-46以及阳性对照P.fluorescensCHA0、P.fluorescensPf-5经藤黄绿脓菌素合成基因的引物PLTC1和PLTC2扩增得到了大小约为438 bp的片段。

表4 19株活性假单胞菌及阳性对照菌株信息
将Pseudomonassp.1A00318和SH-46、对照P.fluorescensPf-5经硝吡咯菌素合成基因扩增获得的目的片段(如图2)进行测序分析,证明不是硝吡咯菌素合成基因,表明19株假单胞菌中没有发现硝吡咯菌素合成基因。
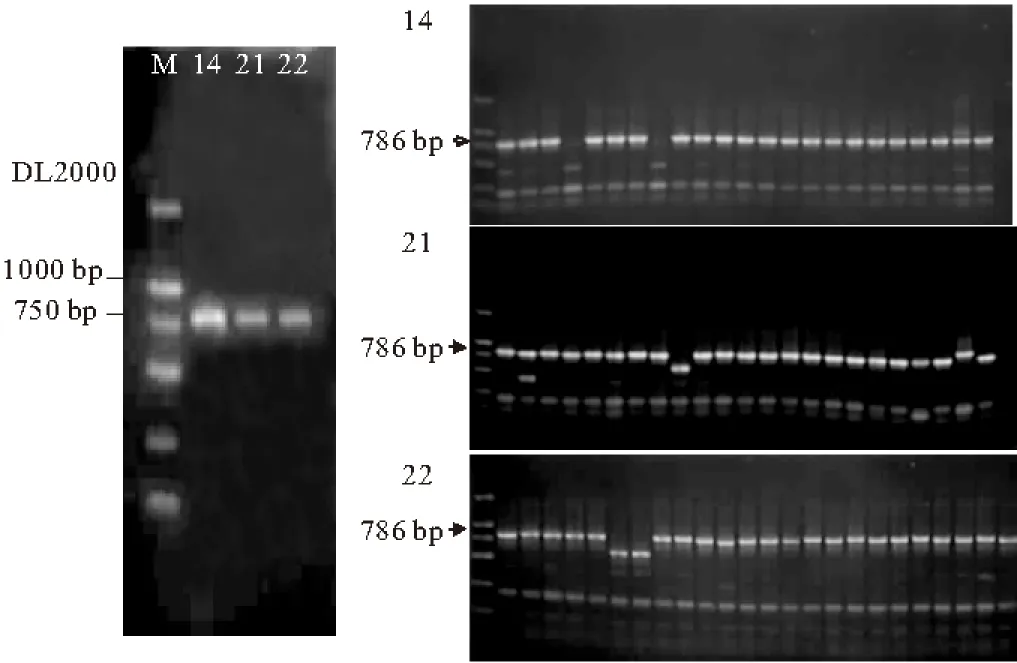
14.P.fluorescens Pf-5 21.1A00318 22.SH-46
3 结论
(1)以油菜核盘菌为病原指示菌,总计筛选了来自168个不同属的1021株海洋来源细菌菌株,最终得到144株活性菌株,筛得率为14.1%。在筛选菌株超过20株以上的属中,发现活性菌株筛得率最高的属分别是芽孢杆菌属(46.6%)和假单胞菌属(16.6%)。
(2)通过比较筛选的302株海洋假单胞菌中的50株活性菌株,发现各个种之间差异明显,其中以不同来源的铜绿假单胞菌活性菌株筛得率和活性最高。
对其中具有较强抗菌活性的19株假单胞菌进行了产活性物质合成基因的分子检测,结果表明,菌株1A06832和SH-46扩增获得了2,4-二乙酰基间苯三酚合成基因的目的片段;菌株1A04311、1A05429和1A01321扩增获得了吩嗪合成基因的目的片段;1A06832、1A00318和SH-46扩增获得了藤黄绿脓菌素合成基因的目的片段;而硝吡咯菌素合成基因片段没有获得。
(致谢:感谢国家自然科学基金资助,感谢国家海洋局第三海洋研究所海洋生物遗传资源重点实验室和中国海洋微生物菌种保藏管理中心(MCCC)给予海洋细菌筛选方面的支持和帮助;特别感谢美国华盛顿州立大学Root Disease Research Unit课题组提供本研究所需的阳性对照菌株。)
[1] 骆祝华,黄翔玲,刘文华,等.海洋微生物抗菌活性的初步研究[J].中国海洋药物,2005,24(2):26-31.
[2] 田黎,陈杰,何运转,等.农用抗生素的新资源——海洋微生物[J].中国生物防治,2003,19(3):121-124.
[3] 李艳华,张利平.海洋微生物资源的开发与利用[J].微生物学通报,2003,30(3):13-115.
[4] 詹萍,梁静娟,庞宗文.产生物活性物质海洋微生物的研究进展[J].玉林师范学院学报(自然科学版),2007,28(3):72-74.
[5] Mayer A M,Hamann M T.Marine pharmacology in 2001-2002:Marine compounds with anthelmintic,antibacterial,anticoagulant,antidiabetic,antifungal,anti-inflammatory,antimalarial,antiplatelet,antiprotozoal,antituberculosis,and antiviral activities;affecting the cardiovascular,immune and nervous systems and other miscellaneous mechanisms of action[J].Comparative Biochemistry and Physiology C-Toxicology & Pharmacology,2005,140(3-4):265-286.
[6] 姜健,杨宝灵,鲁红凯,等.海洋微生物生物活性物质的研究[J].云南大学学报,2004,26(6A):91-95.
[7] Wang F,Wang F P,Li Q,et al.A novel filamentous phage from deep-sea bacteriumShewanellapiezotolerantWP3 is induced at low temperature[J].Journal of Bacteriology,2007,189(19):7151-7153.
[8] Tagg J R,McGiven A R.Assay system for bacteriocins[J].Applied and Environmental Microbiology,1971,21(5):943-944.
[9] Athukorala S N,Fernando W G, Rashid K Y.Identification of antifungal antibiotics ofBacillusspecies isolated from different microhabitats using polymerase chain reaction and MALDI-TOF mass spectrometry[J].Canadian Journal of Microbiology,2009,55(9):1021-1032.
[10] de Souza J T,Raaijmakers Jos M.Polymorphisms within theprnD andpltC genes from pyrrolnitrin and pyoluteorin-producingPseudomonasandBurkholderiaspp.[J].FEMS Microbiology Ecology,2003,43(1):21-34.
[11] Ramarathnam R,Dilantha Fernando W G.Preliminary phenotypic and molecular screening for potential bacterial biocontrol agents of leptosphaeria maculans,the blackleg pathogen of canola[J].Biocontrol Science and Technology,2006,16(5/6):567-582.
