DMA中添加剂对葡萄糖制备5-羟甲基糠醛的影响
2011-07-26张泽会
董 坤,张泽会
(1.中国科学院大连化学物理研究所,辽宁 大连 116023;2.中国科学院研究生院,北京 100039)
面对能源和环境的双重压力,人类亟待寻找一种绿色环保的可再生能源[1,2]。在积极推进的各种方案中,开发生物质能源被认为是解决能源与环境问题的重要途径之一,受到世界各国的高度重视[3~6]。
作为生物质能源中六碳糖脱水产物的5-羟甲基糠醛(HMF)是一种重要的呋喃基化合物,它的分子中含有一个醛基和一个羟甲基,可以通过加氢、氧化脱氢、酯化、卤化、聚合、水解以及其它化学反应,用于合成许多有用化合物和新型高分子材料,如乙酰丙酸、2,5-二甲基呋喃(DMF)、2,5-呋喃二甲酸等,被认为是连接碳水化合物资源与石油工业之间的桥梁[7~9],已成为目前生物质转化研究领域的热点之一。
国内外许多研究人员致力于生物质制备HMF的研究。Dumesic等从果糖出发,研发了水-有机溶剂双相体系的方法,并进一步将分离产物HMF加氢处理,得到了清洁燃料DMF[7,10~12]。此外,以果糖为原料,在离子液体以及离子液体-有机溶剂双相体系中制备HMF的报道也相继出现[13~19],并且有朝着低温方向发展的趋势[17,19]。由于果糖价格比较昂贵,不利于HMF的大规模生产,因而有必要寻找廉价的原料替代果糖。Zhao等[20]研究发现,在离子液体中,CrCl2能够有效地将相对廉价的葡萄糖催化转化为HMF。Yong等[21]利用NHC/Cr催化转化葡萄糖得到HMF的产率高达81%,而且催化剂和离子液体可以重复使用。
Binder等[8]以未处理的玉米秸秆为原料,通过两步法制备了优质燃料DMF。由于离子液体比较贵重,尝试了其它可溶解纤维素以及木质纤维素的溶剂,发现含有LiCl的N,N-二甲基乙酰胺(DMA)是既可以溶解单糖、又能溶解纤维素的溶剂,纤维素在其中的溶解量可达15%。为了提高HMF的产率,他们向溶剂中加入了可溶解纤维素的离子液体。在CrCl2/DMA体系中,葡萄糖制备HMF的产率可达80%,达到了以咪唑离子液体为溶剂时的产率。该方法降低了生产成本,然而反应体系复杂、溶剂回收困难,并且催化剂CrCl2和CrCl3用量较大,不利于大规模推广。
胍盐是一种新型离子液体,具有较高的热和化学稳定性[22,23]、较高的催化活性、较强的生理活性,受到化学家和药学家的广泛关注[24~26],但有关胍盐在生物质利用方面的报道较少。
由于DMA/LiCl体系可以较好地溶解纤维素,作者考虑构建具有DMA结构的酰胺基离子液体,探讨其在生物质利用方面是否具有普通咪唑离子液体不具有的特性。在此,首先参照DMA的结构合成酰胺基离子液体,探讨酰胺基离子液体在葡萄糖转化方面的应用;然后以葡萄糖为原料、DMA为反应溶剂、CrCl3·6H2O为催化剂、胍盐等离子液体作为添加剂,系统地考察添加剂种类、添加剂用量等因素对HMF产率的影响,并初步研究了混合反应体系的反应机理。
酰胺基离子液体结构如下:

R1(R2)=H,CH3,CH3CH2,CH3CH2CH2
1 实验
1.1 试剂与仪器
二氯甲烷(DCM)、乙腈、乙酸乙酯、N,N-二甲基乙酰胺,天津科密欧化学试剂有限公司;二乙胺、N-甲基丁胺、四甲基胍,Alar Aesar;氯乙酰氯、一水合氯化锂、溴化钠、四丁基溴化铵,天津博迪化工有限公司;溴乙烷,ACROS;吡啶,中国医药集团上海化学试剂公司;葡萄糖,ABCR;六丁基胍氯盐,长春应化所;六水合三氯化铬,国药集团化学试剂有限公司。上述试剂除吡啶为化学纯外,其余均为分析纯。N-甲基咪唑(99%),上海化学试剂一厂;1-氯代正丁烷(98.5%),天津市光复精细化工研究所。
PL203型电子天平,Mettler Toledo;DF-101S型磁力搅拌器、DLSB-10/30型低温冷却液体循环泵,巩义市英峪予华仪器厂;RE3000型旋转蒸发仪,上海亚荣生化仪器厂;DZF-6050型真空干燥箱,上海一恒科技有限公司;2XZ-4型真空泵,上海真空泵厂;台式冷冻干燥机,Labconco;INOVA-400型核磁共振仪,Varian;P680型高效液相色谱仪,戴安公司。
1.2 酰胺基离子液体的合成[27,28]
(1)将200 mL二氯甲烷加入到500 mL烧瓶中,加入7.3 g(100 mmol)二乙胺并使其溶解;加入12.8 g(120 mmol)无水碳酸钠,在低温反应器中-10 ℃搅拌,用恒压滴液漏斗滴加10.0 mL(125 mmol)氯乙酰氯,反应液冒出白雾,滴加完后-10 ℃反应2 h,室温反应过夜(20 h);将反应液抽滤,滤液用5%的盐酸溶液萃取2次(2×50.0 mL),弃上清;用 5%碳酸氢钠溶液萃取2次(2×50.0 mL),弃上清;用水萃取3次(3×50.0 mL),有机层用无水硫酸镁干燥,过滤,旋转蒸发除去溶剂;用真空泵抽真空2 h,即得到N,N-二乙基-2-氯乙酰胺。反应式如下:

1HNMR(400 MHz,CDCl3),δ,ppm:4.07(s,2H),3.40(q,J=7.0 Hz,2H),3.36(q,J=7.0 Hz,2H),1.23(t,J=7.0 Hz,3H),1.13(t,J=7.0 Hz,3H)。
(2)同(1)法合成N-甲基-N-丁基-2-氯乙酰胺:
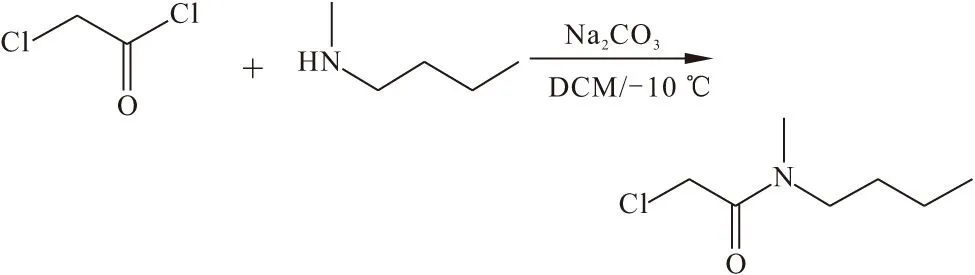
1HNMR(400 MHz,CDCl3),δ,ppm:4.07(s,2H),4.06(s,2H),3.37(t,J=7.0 Hz,2H),3.31(t,J=7.0 Hz,2H),3.05(s,3H),2.94(s,3H),1.61~1.28(m,4H),0.97(t,J=7.0 Hz,3H),0.90(t,J=7.0 Hz,3H)。
(3)将50.0 mL四氢呋喃(THF)加入到100 mL烧瓶中,加入4.5 g(30 mmol)N,N-二乙基-2-氯乙酰胺并使其溶解,加入2.5 mL(30 mmol)甲基咪唑,50 ℃油浴加热,回流反应24 h,反应液出现黄色分层;将反应液上层溶剂倒掉,加入10.0 mL水,振荡溶解,用乙酸乙酯萃取3次(3×20.0 mL);旋转蒸发除去溶剂,真空泵抽真空干燥3 h;油浴100 ℃搅拌,真空泵抽真空3 h,得到黄色玻璃态固体[Et2NCOCH2mim]Cl。反应式如下:
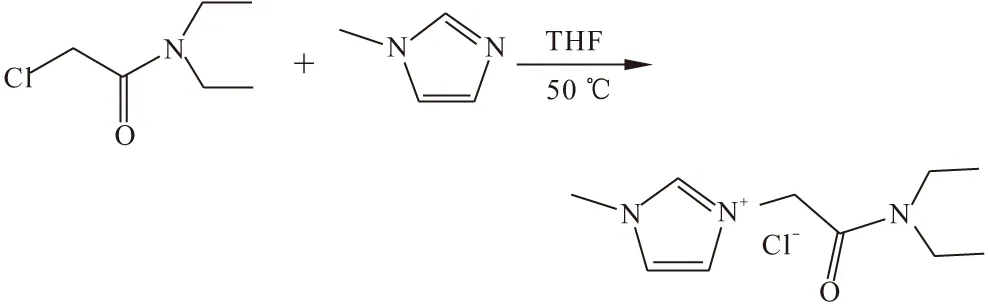
1HNMR(400 MHz,CDCl3),δ,ppm:9.96(s,1H),7.60(s,1H),7.58(s,1H),5.60(s,2H),3.97(s,3H),3.40(q,J=7.0 Hz,2H),3.31(q,J=7.0 Hz,2H),1.25(t,J=7.0 Hz,3H),1.06(t,J=7.0 Hz,3H)。
(4)同(3)法合成黄色玻璃态固体[BuNCH3COCH2mim]Cl:

1HNMR(400 MHz,CDCl3),δ,ppm:9.94(s,1H),9.83(s,1H),7.57~7.42 (m,2H),5.56(s,2H),5.54(s,2H),3.92(s,3H),3.28(t,J=7.0 Hz,2H),3.20(t,J=7.0 Hz,2H),3.02(s,3H),2.81(s,3H),1.54~1.15(m,4H),0.87(t,J=7.0 Hz,3H),0.77(t,J=7.0 Hz,3H)。
1.3 六烷基胍溴盐的合成[29,30]
将100 mL乙腈加入到250 mL烧瓶中,加入25 mL(0.2 mol)四甲基胍并使其溶解,加入8 g氢氧化钠,再加入0.3 g四甲基二乙基胍溴盐作为催化剂,室温下滴加31.5 mL(0.42 mol)溴乙烷,滴加完后40 ℃油浴回流加热反应24 h,反应液变为黄绿色;将反应液抽滤,滤液蒸干溶剂;粗产物加水溶解,再加入2 mL25%(质量分数)氢氧化钠溶液,用石油醚萃取未反应物;向水相中加入20 mL 溴化钠饱和溶液,用二氯甲烷萃取产物,合并有机相,用无水硫酸镁干燥,抽滤,蒸干溶剂;粗产物用乙腈/乙酸乙酯重结晶,然后用真空泵干燥6 h,即得到白色固体六烷基胍溴盐。反应式如下:
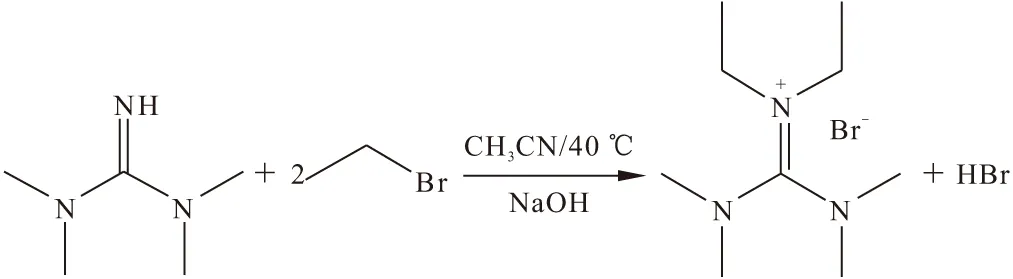
1HNMR(400 MHz,CDCl3),δ,ppm:3.29(t,J=7.0 Hz,4H),3.13~3.04(t,12H),1.22(t,J=7.0 Hz,3H)。
1.4 [Bmim]Br的合成
将12 mL(0.15 mol)甲基咪唑加入到250 mL烧瓶中,加入60 mL四氢呋喃、16.5 mL(0.153 mol)溴丁烷,使其混合溶解,70 ℃油浴搅拌,回流加热反应24 h,反应过程中反应液变浑浊,反应结束后出现黄色分层;将反应液上层倒掉,保留黄色分层相,将其转移至旋转蒸发仪除去溶剂,所得产物用乙酸乙酯洗涤3次(3×50 mL);用旋转蒸发仪在50 ℃除去乙酸乙酯,然后用真空泵干燥3 h,即得到黄色液体[Bmim]Br。
1HNMR (400 MHz,CDCl3),δ,ppm:10.36(s,1H),7.49(s,1H),7.39(s,1H),4.34~4.31(t,2H),4.11~4.06(s,3H),1.93~1.86(m,2H),1.42~1.35(m,2H),0.97~0.94(t,3H)。
1.5 [Bpy]Cl的合成
将1.8 mL(22 mmol)吡啶加入到25 mL烧瓶中,加入2.1 mL(20 mmol)氯丁烷使其溶解,100 ℃油浴搅拌,回流加热反应24 h,反应过程中反应液变浑浊;反应结束后,冷却,加入10 mL乙酸乙酯,析出灰白色固体;将反应混合物抽滤,固体用乙酸乙酯洗涤3次,用乙腈∶乙酸乙酯(1∶2)重结晶,然后用真空泵干燥2 h,即得到灰白色晶体[Bpy]Cl。
1HNMR (400 MHz,CDCl3),δ,ppm:9.59 (d,2H),8.50(t,1H),8.13(t,2H),5.04(t,2H),2.03(m,2H),1.42(m,2H),0.96(t,3H)。
1.6 DMA中葡萄糖转化制备HMF
将100 mg葡萄糖加入到25 mL烧瓶中,加入2 mL DMA使其溶解,再加入10 mg CrCl3·6H2O、一定量的添加剂,120 ℃油浴加热搅拌反应2 h或100 ℃油浴反应6 h。考察不同添加剂、添加剂用量等因素对HMF产率的影响。实验结束后取样,样品用去离子水稀释200倍,用高效液相色谱仪分析产物含量。
1.7 HMF含量的测定
产物HMF含量用P680型高效液相色谱仪进行分析。色谱条件如下:反相C18色谱柱;PDA-100紫外检测器;柱温30 ℃;流动相为乙腈-0.1%(质量分数)乙酸水溶液(体积比15∶85);流速1.0 mL·min-1;检测波长280 nm。
2 结果与讨论
2.1 离子液体添加剂对HMF产率的影响
以DMA为溶剂,考察不同添加剂对葡萄糖转化制备HMF的影响,结果见表1。
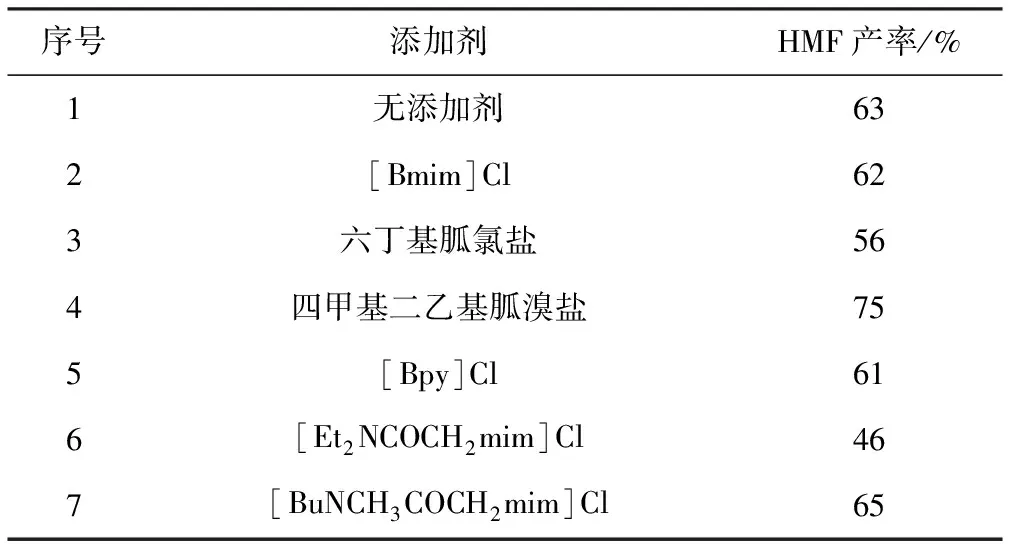
表1 添加剂种类对HMF产率的影响
由表1可知,添加[Bmim]Cl或[Bpy]Cl对反应没有明显的促进作用;添加具有溶剂DMA类似结构的酰胺型离子液体发现,与DMA结构更为类似的[Et2NCOCH2mim]Cl对反应有抑制作用,而[BuNCH3COCH2mim]Cl对反应没有明显的抑制或促进作用;添加胍盐离子液体时,两种不同的胍盐对反应的影响却有显著差异,胍氯盐对反应有抑制作用,而胍溴盐对反应有明显的促进作用。由此可知,当离子液体为氯盐时,阳离子的结构对反应有明显的影响;添加剂的抑制作用可能是由于阳离子与反应体系中的某些分子结合,影响了反应的进行。当离子液体为溴盐时,阴离子在反应中的作用占优势,阳离子对反应的影响减小。
2.2 胍溴盐用量对HMF产率的影响(表2)
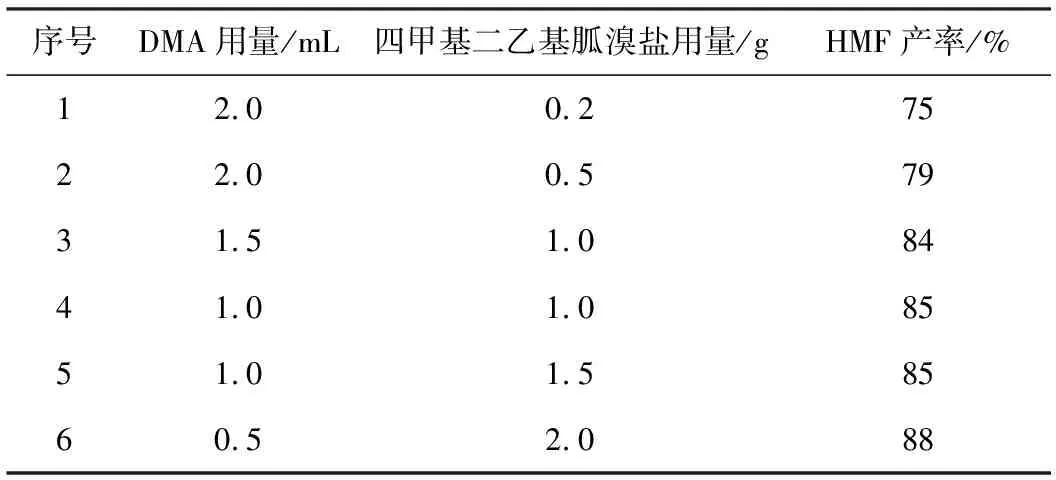
表2 添加剂用量对HMF产率的影响
由表2可知,当溶剂DMA用量不变、只增加胍溴盐的用量时,HMF产率基本呈上升趋势;当胍溴盐用量不变、减少溶剂DMA用量时,HMF产率略微升高。由此可知,溶剂DMA只是充当反应的介质,对反应的进行没有影响;胍溴盐参与反应的进行,对反应有促进作用。
2.3 不同阳离子溴盐对HMF产率的影响
考察不同阳离子溴盐[Bmim]Br、四丁基溴化铵对葡萄糖转化制备HMF的影响,结果如表3所示。

表3 Bmim]Br和四丁基溴化铵对HMF产率的影响
由表3可知,[Bmim]Br和四丁基溴化铵对转化反应具有与胍溴盐类似的促进效果,并且随添加剂用量的增大,促进效果都有所提高。由此判断,添加剂的阴离子在转化反应中起到主要的促进作用。综合实验结果可知,添加剂的阳离子对反应有一定的影响,抑制作用可能是由于阳离子与反应体系中的某些分子结合,影响了反应的进行;当添加剂的阴离子为溴时,阳离子的作用被阴离子溴屏蔽而减弱,阴离子的影响在反应中占据了主导地位。
2.4 反应机理[8]

图1 葡萄糖脱水形成HMF的机理
首先,葡萄糖在CrCl3的催化下,异构化形成果糖,然后果糖迅速脱水形成HMF。铬离子是一个可以进行六原子配位的络合离子,铬离子与葡萄糖络合,形成烯醇式中间体,催化葡萄糖异构化形成果糖。在果糖脱水形成HMF的过程中,需要形成烯醇结构中间体。在形成烯醇结构过程中,有两种路径。果糖呋喃环上的氧质子化,然后脱去一分子水形成呋喃钅翁离子(Ⅱ)。在混合反应体系中阴离子Cl-一方面可以作为碱夺取C1位质子形成烯醇结构(Ⅲ)。另一方面,在混合反应体系中Cl-作为亲核试剂,进攻离子C2形成中间体(Ⅳ),然后脱掉HCl形成烯醇结构(Ⅲ)。最后,烯醇结构(Ⅲ)很容易脱掉两分子水形成HMF。
反应体系中,添加剂的加入促进了反应的进行。从反应机理上看,其促进作用主要是因为卤族离子的添加。实验结果有效地验证了反应机理中卤族原子的作用。溴离子与氯离子相比,具有更好的亲核性,因此对反应的促进作用更加明显。综合实验结果可知,添加剂的阳离子对反应有一定的影响,但当添加剂的阴离子为溴时,阳离子的作用被阴离子溴屏蔽而减弱,阴离子的影响在反应中占据了主导地位。
3 结论
(1)在DMA与添加剂的混合反应体系中,添加胍溴盐对反应的促进作用明显,HMF最高产率达88%。
(2)添加剂的阴、阳离子对转化反应都有影响,其中阴离子的作用占主导地位。
[1] Ragauskas A J, Williams C K, Davison B H, et al.The path forward for biofuels and biomaterials[J].Science,2006,311(5760):484-489.
[2] Parikka M.Global biomass fuel resources[J].Biomass Bioenergy,2004,27(6):613-620.
[3] Phalan B.The social and environmental impacts of biofuels in Asia: An overview[J].Appl Energ,2009,86(1):S21-S29.
[4] Qiu H G, Huang J K, Yang J, et al.Bioethanol development in China and the potential impacts on its agricultural economy[J].Appl Energ,2010,87(1):76-83.
[5] Matsumoto N, Sano D, Elder M.Biofuel initiatives in Japan: Strategies, policies, and future potential[J].Appl Energ,2009,86(1):S69-S76.
[6] Singh A, Smyth B M, Murphy J D.A biofuel strategy for Ireland with an emphasis on production of biomethane and minimization of land-take[J].Renew Sust Energ Rev,2010,14(1):277-288.
[7] Roman-Leshkov Y, Barrett C J, Liu Z Y, et al.Production of dimethylfuran for liquid fuels from biomass-derived carbohydrates[J].Nature,2007,447(7147):982-985.
[8] Binder J B, Raines R T.Simple chemical tansformation of lignocellulosic biomass into furans for fuels and chemicals[J].J Am Chem Soc,2009,131(5):1979-1985.
[9] Moreau C, Belgacem M N, Gandini A.Recent catalytic advances in the chemistry of substituted furans from carbohydrates and in the ensuing polymers[J].Top Catal,2004,27(1-4):11-30.
[10] Roman-Leshkov Y, Chheda J N, Dumesic J A.Phase modifiers promote efficient production of hydroxymethylfurfural from fructose[J].Science,2006,312(5782):1933-1937.
[11] Chheda J N, Roman-Leshkov Y, Dumesic J A.Production of 5-hydroxymethylfurfural and furfural by dehydration of biomass-derived mono- and poly-saccharides[J].Green Chem,2007,9(4):342-350.
[12] Roman-Leshkov Y, Dumesic J A.Solvent effects on fructose dehydration to 5-hydroxymethylfurfural in biphasic systems saturated with inorganic salts[J].Top Catal,2009,52(3):297-303.
[13] Lansalot-Matras C, Moreau C.Dehydration of fructose into 5-hydroxymethylfurfural in the presence of ionic liquids[J].Catal Commun,2003,4(10):517-520.
[14] Moreau C, Finiels A, Vanoye L.Dehydration of fructose and sucrose into 5-hydroxymethylfurfural in the presence of 1-H-3-methyl imidazolium chloride acting both as solvent and catalyst[J].J Mol Catal A:Chem,2006,253(1-2):165-169.
[15] Qi X H, Watanabe M, Aida T M, et al.Catalytic dehydration of fructose into 5-hydroxymethylfurfural by ion-exchange resin in mixed-aqueous system by microwave heating[J].Green Chem,2008,10(7):799-805.
[16] Hu S Q, Zhang Z F, Zhou Y X, et al.Conversion of fructose to 5-hydroxymethylfurfural using ionic liquids prepared from renewable materials[J].Green Chem,2008,10(12):1280-1283.
[17] Chan J Y G, Zhang Y G.Selective conversion of fructose to 5-hydroxymethylfurfural catalyzed by tungsten salts at low temperatures[J].ChemSusChem,2009,2(8):731-734.
[18] Qi X H, Watanabe M, Aida T M, et al.Efficient process for conversion of fructose to 5-hydroxymethylfurfural with ionic liquids[J].Green Chem,2009,11(9):1327-1331.
[19] Qi X H, Watanabe M, Aida T M, et al.Efficient catalytic conversion of fructose into 5-hydroxymethylfurfural in ionic liquids at room temperature[J].ChemSusChem,2009,2(10):944-946.
[20] Zhao H B, Holladay J E, Brown H, et al.Metal chlorides in ionic liquid solvents convert sugars to 5-hydroxymethylfurfural[J].Science,2007,316(5831):1597-1600.
[21] Yong G, Zhang Y G, Ying J Y.Efficient catalytic system for the selective production of 5-hydroxymethylfurfural from glucose and fructose[J].Angew Chem Int Ed,2008,47(48):9345-9348.
[22] Brunelle D J.Phase transfer catalyzed preparation of aromatic polyether polymers[P].USP 5 229 482,1993-07-20.
[23] Brunelle D J.Bis(pentaalkylguanidinium) alkane salts as phase transfer catalysts[P].USP 5 081 298,1992-01-14.
[24] Schneider S E, Bishop P A, Salazar M A, et al.Solid phase synthesis of oligomeric guanidiniums[J].Tetrahedron,1998,54(50):15063-15086.
[25] Duan H F, Zhang S B, Lin Y, et al.Synthesis and properties of a novel room-temperature ionic liquid hexaalkylguanidium salts[J].Chem Res Chin Univ,2004,20(5):568-575.
[26] Xie H B, Duan H F, Li S H, et al.The effective synthesis of propylene carbonate catalyzed by silica-supported hexaalkylguanidinium chloride[J].New J Chem,2005,29(9):1199-1203.
[27] Gathergood N, Garcia M T, Scammells P J.Biodegradable ionic liquids.Part I.Concept, preliminary targets and evaluation[J].Green Chem,2004,6(3):166-175.
[28] Garcia M T, Gathergood N, Scammells P J.Biodegradable ionic liquids.Part Ⅱ.Effect of the anion and toxicology[J].Green Chem,2005,7(1):9-14.
[29] Li S H, Lin Y J, Cao J G.Syntheses and application of new room temperature ionic liquids based on hexaalkylguanidinium salts[J].Chem Res Chinese U,2005,21(2):158-162.
[30] 段海峰,郭旭,李胜海,等.胍盐离子液体的研究进展[J].有机化学,2006,26(10):1335-1343.
