茯苓多糖的纯化及分子量测定
2011-07-25孙晓春苟小军
颜 军,陶 涛,孙晓春,何 钢,易 勇,苟小军,
(1.成都大学 药食同源植物资源开发重点实验室,四川 成都 610106;2.四川抗菌素工业研究所,四川 成都 610052)
茯苓(Poriacocos)是我国传统的名贵中药材,主产云南(云苓)、安徽(安苓)、贵州、广西、湖北、福建(闽苓)等地[1],为多孔菌科真菌茯苓的干燥菌核,属担子菌纲真菌,具有渗湿、健脾、利尿等功能[2]。
茯苓的主要有效成分为茯苓多糖(Tuckahoe polysaccharide, TAP),约占茯苓菌核干重的70%~90%[3,4]。茯苓异多糖具有促进细胞分裂、补体激活、诱变、抗肿瘤、抗癌、增强免疫性等生物活性[5~7],可广泛应用于医疗保健、食品等领域,具有广阔的开发应用前景。茯苓多糖结构及生物活性的研究也逐渐得到重视[8,9]。
目前,有对茯苓多糖进行化学修饰后测定其分子量的报道[10],而对茯苓多糖纯化后进行分子量测定的报道较少。多糖分子量的测定方法有凝胶渗透色谱和光散射联用法(GPC-LS)[11]、高效凝胶排阻色谱法[12,13]、手工装填的凝胶柱色谱法[14]。手工柱色谱法测定的稳定性和重现性差,造成分子量测定的偏差。作者从茯苓中提取水溶性多糖、去蛋白质后用DEAE-650C层析柱进行分离纯化,对纯化后的茯苓多糖采用高效凝胶过滤色谱法(HPGFC)进行分子量的测定。为深入研究茯苓多糖的生物活性及在食品与医疗保健中进一步开发利用提供了可行性依据。
1 实验
1.1 材料、试剂与仪器
白茯苓,购自成都荷花池药材市场,粉碎,过40目筛。
DEAE-650C层析柱,广州市齐云生物技术有限公司。标准系列葡聚糖Dextran (T-10、T-40、T-70、T-500、T-2000)、葡萄糖、苯酚、硫酸、氯仿、正丁醇、乙醇等,均为国产分析纯。
L-2490型HPLC(RI检测器),日本日立;GL-21M 型高速冷冻仪,湘仪;UV/VIS 280PC型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;BS-100A型自动部分收集器、TH-300型梯度混合器、HL-2B型恒流泵,上海青浦沪西仪器厂;电子天平,上海越平科学仪器有限公司。
1.2 茯苓粗多糖的提取[12]
称取一定量茯苓粉,加入4~6倍量的水,熬煮3次,提取时间分别为3 h、2 h、1 h,过滤,合并3次提取液,减压浓缩至适量,在搅拌下加入95%的乙醇,使其含醇量达到80%,静置过夜。析出褐色沉淀后,1000 r·min-1离心10 min,得沉淀,低温干燥,即得茯苓粗多糖。
1.3 茯苓粗多糖的精制
采用Sevag 法反复除蛋白。取茯苓粗多糖溶液4 mL,加入氯仿和正丁醇1 mL[V(氯仿)∶V(正丁醇)=4∶1],充分振荡20 min,离心去除水层与溶剂层交界处的变性蛋白,反复数次,直至溶剂层与水的界面无乳白色沉淀为止。
1.4 茯苓多糖的纯化
将DEAE-650C层析柱水平衡后,取200 mg精制多糖样品溶解于蒸馏水中上样,蒸馏水洗脱60 mL后,以0~3 mol·L-1NaCl溶液梯度洗脱,流速1.0 mL·min-1,每管收集2 mL,分布收集、备用。硫酸-苯酚法检测多糖含量。
1.5 多糖含量的测定[15]
硫酸-苯酚显色液的配制:用50 mL浓硫酸和10 mL水配制实验用硫酸溶液,并加入0.6 g苯酚,配制成显色液。
显色方法:移取1.00 mL待测样品于试管中,加入5.00 mL显色液,振荡混匀。置于沸水浴中保温30 min,立即置于冷水浴中,冷却至室温。以未加葡萄糖溶液作为空白对照。于490 nm处测定系列葡萄糖溶液的吸光度。以葡萄糖浓度为横坐标、吸光度为纵坐标,绘制标准曲线。测定样品溶液490 nm处吸光度,据标准曲线计算多糖含量。
1.6 分子量的测定
采用高效凝胶过滤色谱法(HPGFC)进行分子量的测定。
色谱条件:色谱柱:YMC Pack-Diol 200柱(300 mm×8.0 mm,S-5 μm,20 nm);流动相:蒸馏水;流速:0.8 mL·min-1;柱温:35℃;检测器:示差折光检测器;进样量:20 μL。
标准曲线的绘制:以系列葡聚糖T-10、T-40、T-70、T-500、T-2000和葡萄糖为标准品,分别用流动相溶解配制成2 mg·mL-1溶液进样,记录洗脱峰的保留时间。分子量Mw与其在凝胶柱上的洗脱体积Ve、分配系数Kav存在如下关系:
Ve=a-blgMw
Kav=K1-K2lgMw
Kav=(Ve-V0)/(Vt-V0)
式中:a、b、K1、K2为常数;V0为T-2000的洗脱体积;Vt为葡萄糖的洗脱体积,均以保留时间表示。
以Kav对lgMw进行线性回归处理,得线性回归方程。样品按上述条件上柱,求得Ve,根据其Kav值从标准曲线上求得样品的分子量。
2 结果与讨论
2.1 茯苓多糖的提取
称取茯苓粉末100 g,采用水提醇沉法提取茯苓多糖,得茯苓粗多糖2.1 g,提取率为2.1%。
2.2 纯度鉴定
采用紫外扫描法对除蛋白前后的茯苓多糖溶液进行纯度鉴定,波长范围190~600 nm,紫外扫描结果见图1。
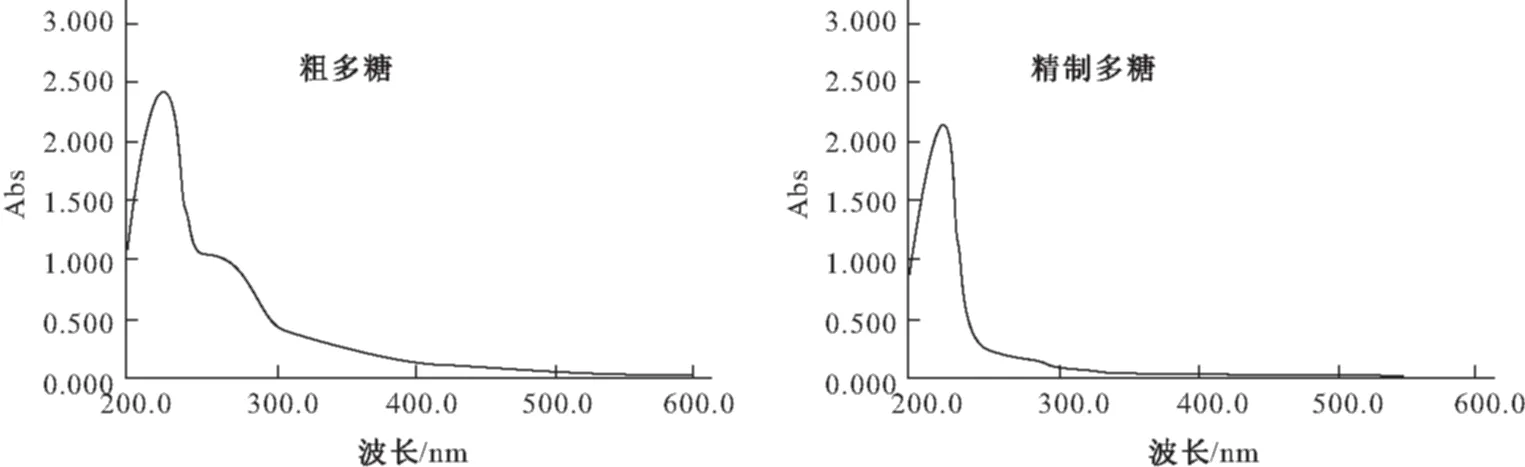
图1 茯苓多糖溶液紫外扫描图谱
由图1可以看出,在270~290 nm处,吸收明显减少,说明Sevag法对茯苓粗多糖中蛋白杂质的去除效果较好。取茯苓粗多糖2 g,采用Sevag 法去杂质,得精制茯苓多糖1.3 g,纯化率为65%。
2.3 DEAE-650C柱层析
将精制多糖溶液进行DEAE-650C柱分离,硫酸-苯酚法显色检测,洗脱曲线见图2。
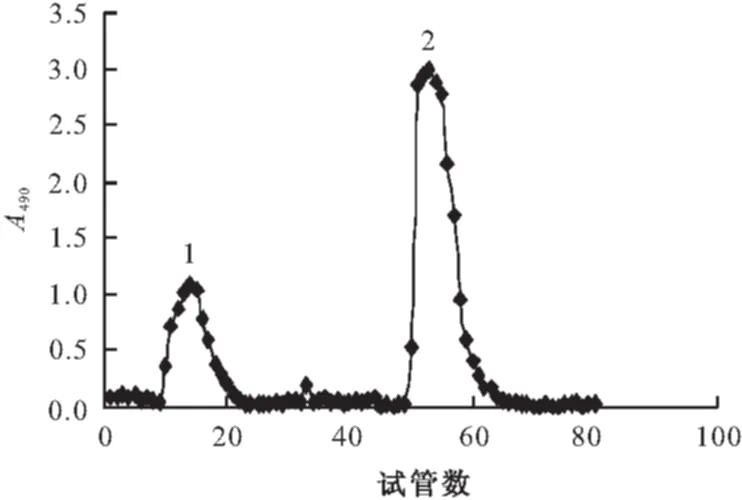
1.TAP1 2.TAP2
由图2可知,DEAE-650C柱层析后得两个洗脱峰,且峰的对称性较好。分别合并10~20管和50~61管的多糖洗脱液,透析后冻干,得茯苓多糖两个组分。峰1为蒸馏水洗脱所得,初步判断为中性多糖组分,命名为TAP1;峰2为NaCl溶液梯度洗脱所得,初步判断为酸性多糖组分,命名为TAP2。
2.4 分子量测定
按1.6方法测定系列标准葡聚糖溶液的保留时间见表1。计算出各分子量标准品的lgMw和Kav,以Kav对分子量的对数作图,结果见图3。多糖分子量在10 000 ~500 000范围内与Kav呈良好线性关系,得回归方程为y=-3.8951x+6.0471,R2=0.9994。
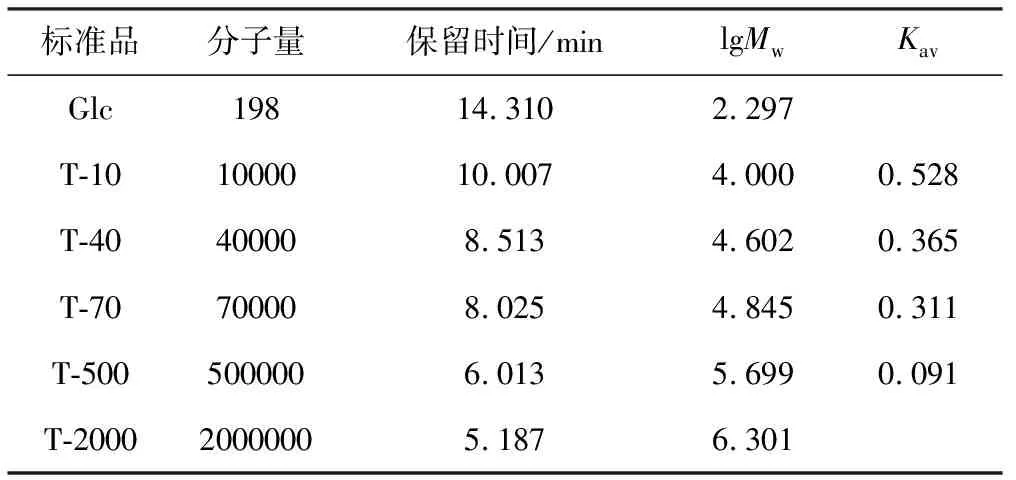
表1 不同分子量标准品的高效凝胶过滤色谱保留时间
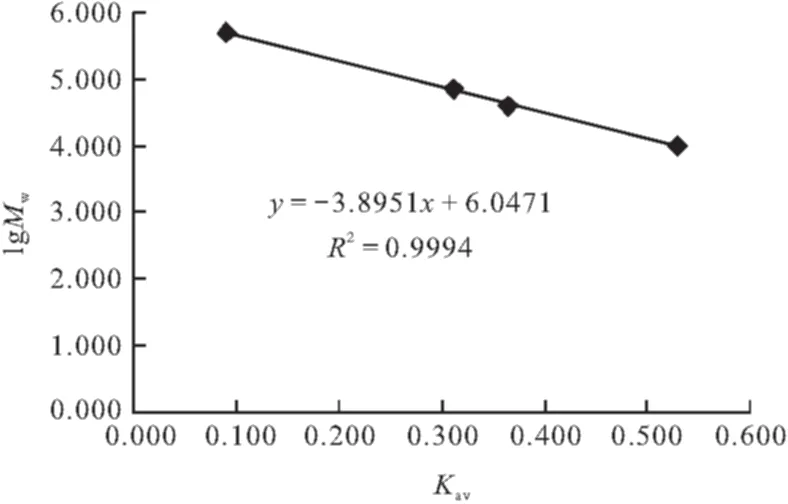
图3 葡聚糖标准曲线
将茯苓多糖两组分TAP1和TAP2溶于蒸馏水中制成质量体积比为2%的溶液,在相同色谱条件下进样分析,保留时间分别为9.820 min和8.473 min。通过回归方程计算得出分子量分别为11 721和44 065。
3 结论
用水提醇沉法对茯苓多糖进行提取,工艺流程简便,提取的粗多糖易纯化,但多糖得率低,仅为2.1%。茯苓提取工艺还待进一步研究。用Sevag法脱蛋白,其条件温和且不引起多糖的降解,但需要重复多次。本实验采用5次Sevag法脱蛋白,紫外扫描检测表明去除效果较好,纯化率为65%。
精制茯苓多糖经DEAE-650C柱层析分离、纯化,获得TAP1和TAP2两个多糖组分。TAP1为蒸馏水洗脱所得,初步判断为中性多糖组分;TAP2为NaCl溶液梯度洗脱所得,初步判断为酸性多糖组分。采用高效凝胶过滤色谱法(HPGFC)测定,中性茯苓多糖TAP1和酸性茯苓多糖TAP2的分子量分别为11 721、44 065。
[1]鲁战会,吴生文,唐健,等.茯苓多糖与产地及炮制方法的关联性研究[J].食品科技,2006,31(11):107-111.
[2]林标声,罗茂春.发酵液中硫酸酯化茯苓多糖的制备及其结构改性的研究[J].食品科技,2010,35(2):130-137.
[3]Wang Y F,Zhang L N,Dong R.Preparation and structure of five derivatives ofβ-(1→3)-D-glucan isolated fromPoriacocossclerotium[J].Chin J Polym Sci,2004,22(1):137-145.
[4]陈莉,郁建平.茯苓多糖提取工艺的优化[J].食品科学,2007,28(5):136-139.
[5]Jin Yong,Zhang Lina,Zhang Mei,et al.Antitumor activities of heteropolysaccharides ofPoriacocosmycelia from different strains and culture media[J].Carbohydrate Research,2003,338(14):1517-1521.
[6]吕苏成,曹巧俐,张力,等.茯苓多糖对正常及荷瘤小鼠免疫功能的影响[J].第一军医大学学报,1990,(3):45-46.
[7]陈春霞.茯苓多糖体的药理药化研究及其临床应用初探[J].中草药,1985,(4):40.
[8]李俊,韩向晖,李仲洪,等.茯苓多糖的提取及含量测定[J].中国现代应用药学杂志,2000,17(1):49-50.
[9]丁琼,张俐娜,张志强.茯苓菌丝体多糖的分离及结构分析[J].高分子学报,2000,(2):224-227.
[10]邱绿琴,梁奇,傅柏绿,等.茯苓多糖的降解及其衍生物的粘度、分子量的测定[J].中国医药导报,2008,34(5):25-26.
[11]Zhang L N,Ding Q,Zhang P Y,et al.Molecular weight and behavior in solution ofβ-D-glucan fromPoriacocossclerotium[J].Carbohydrate Research,1997,303(2):193-197.
[12]颜军,刘嵬,邬晓勇,等.柴胡多糖的分子量测定及单糖组成分析[J].安徽农业科学,2010,38(9):4550-4552.
[13]李昌,谢明勇,聂少平,等.库克Noni 果汁多糖含量及分子量测定[J].天然产物研究与开发,2007,19(1):143-147,179.
[14]许文涛,张方方,罗云波,等.荞麦水溶性多糖的分离纯化及其分子量的测定[J].食品科学,2009,30(13):22-24.
[15]徐光域,颜军,郭晓强,等.硫酸-苯酚定糖法的改进与初步应用[J].食品科学,2005,26(8):342-346.
