壳聚糖-海藻酸钠黄芩微囊的制备及释放性能评价
2011-07-25吴菁菁刘克海
吴菁菁, 吕 敏, 刘克海
(上海海洋大学,上海201306)
黄芩为唇形科植物黄芩Scutellaria baicalensis Georgi的干燥根,具有清热燥湿、泻火解毒、止血、安胎等功效,临床多用于治疗呼吸道感染、急性扁桃体炎、急性咽炎、肺炎及痢疾等疾病。主要成分为黄芩苷、黄芩素、汉黄芩苷等黄酮类化合物[1],其中黄芩苷是其抗菌、抗炎的主要成分之一[2],但黄芩苷半衰期短且生物利用度低,用药剂量大,须频繁给药,使得患者服用顺应性低[3]。将黄芩制成微囊剂,可方便入药,丰富中药剂型,同时可改善释放性能,对探索中药缓释制剂研究具有一定示范意义。
海藻酸钠与壳聚糖均为天然高分子材料,具有良好生物相容性、生物可降解性及低免疫原性,广泛应用于食品、医药等行业[4]。壳聚糖分子链上有大量伯氨基,海藻酸钠分子链上有大量羧基,因此壳聚糖和海藻酸钠可通过正、负电荷吸引形成聚电解质膜,自发形成微囊[5]。该微囊应用于制备中药缓释制剂可使药物释放得以控制,维持血药浓度平稳,延长其在有效浓度范围内作用时间,降低不良反应,并可减少中药提取物刺激性,提高稳定性。此外,微囊通过延长在胃肠道内的滞留时间,提高生物利用度[6]。
1 仪器与试药
1.1 材料
1.1.1 试剂 黄芩(上海荣庆堂实业发展有限公司),壳聚糖(浙江金壳生物化学有限公司),海藻酸钠(国药集团化学试剂有限公司),甲醇为色谱纯(Fisher Chemicals),水为重蒸馏水,其余试剂为分析纯。
1.1.2 仪器 510液相色谱仪,配有Waters486检测器和AnaStar色谱工作站(美国Waters公司);AG135电子天平(感量 0.1 mg;0.01 mg。载量 101 g;31 g。瑞士 Mettler公司);SB2200超声波清洗器(美国Branson公司);TGL-16G高速离心机(上海圣科仪器设备有限公司);RCZ-1B溶出度测定仪(上海黄浦药检仪器有限公司);HH-S11-2-S电热恒温水浴箱(上海新苗医疗器械制造有限公司)。
1.2 黄芩提取 称取黄芩,加水提取3次,每次1 h,第1次加10倍量水,第2次,第3次加8倍量水,滤过,合并滤液,浓缩,备用。
1.3 锐孔-凝固浴法制备黄芩微囊[7]称取海藻酸钠适量,加入黄芩水提液中,50℃水浴搅拌至海藻酸钠溶解,得到一定浓度的海藻酸钠黄芩水溶液,备用。另取壳聚糖与氯化钙适量,加水溶解,制成一定浓度的凝固液,备用。针管吸取海藻酸钠黄芩水溶液,滴入壳聚糖-氯化钙凝固液中,自发形成微囊,固化10 min,分离,用水漂洗,晾干,即得。
1.4 正交试验优选微囊制备工艺
1.4.1 因素水平选择 根据预实验知,采用锐孔-凝固浴法制备微囊,选取药物浓度、海藻酸钠浓度及壳聚糖浓度作为因素,考察因素不同水平对微囊化效果的影响,因素水平设计见表1。
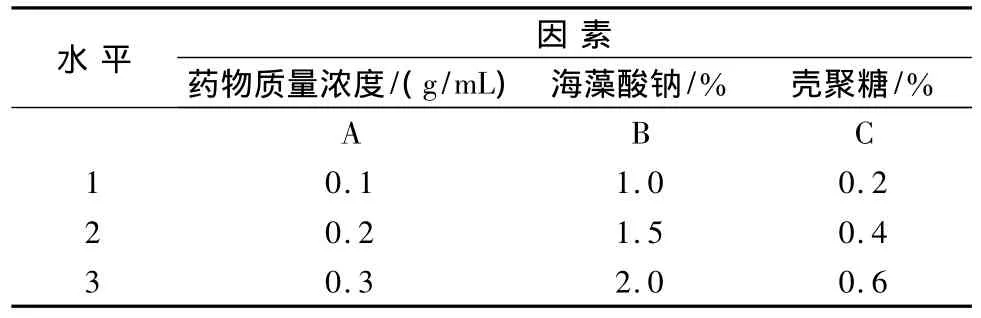
表1 因素水平表
1.4.2 指标确定 选择包封率为指标,其原由及评价方法如下:药物包埋率低,则药物损失大,达不到制剂目的,故制备载药微囊时,要求其包封率尽可能高,其测定方法如下:
(1)样品溶液制备:待测微囊置烧杯中,加水适量,并使药液充分溶出,并转移至100 mL量瓶,加甲醇10 mL,超声处理10 min,用重蒸馏水稀释至刻度,取此液离心10 min(转速为15000 r/min),分取上清液,即得。取黄芩水提液,同法操作。
(2)样品测定[8]:采用高效液相色谱法测定黄芩苷量。色谱条件:Shim-pack VP-ODS(4.6 mm ×250 mm,5 μm)柱;甲醇-0.2 mol/L磷酸二氢钠缓冲液(用磷酸调节pH值至2.7)(48∶52)为流动相;检测波长为275 nm。理论板数按黄芩苷峰计算应不低于5000。记录色谱图、峰面积与进样量作线性回归,绘制标准曲线。黄芩苷进样量在0.05004~0.40032 μg范围内与峰面积呈很好的线性关系,回归方程及相关系数:Y=29.1391 ×105X-1.4582 ×104,r=0.9999(X为黄芩苷进样量μg,Y为峰面积)。
(3)包封率计算:包封率(%)=(m1/M1)×100%(m1∶待测微囊中含药量;M1:投药量)。
1.5 体外药物释放度测定 以200 mL蒸馏水为溶出介质,转速100 r/min,温度为37℃。将一定量微囊放入溶出杯中,在不同时间点取样,并补入等量介质,按上述样品溶液制备样品测定方法进行含量测定,并计算各时间点内释放量累积百分率,同时绘制黄芩苷-时间的释放动力学曲线。释放度(%)=(m2/M2)×100%(m2:某时间点药物累积释放量;M2:微囊内总药量)。
2 结果与分析
2.1 正交试验设计优选微囊制备工艺 锐孔-凝固浴法制备黄芩微囊正交试验结果及方差分析见表2、3。
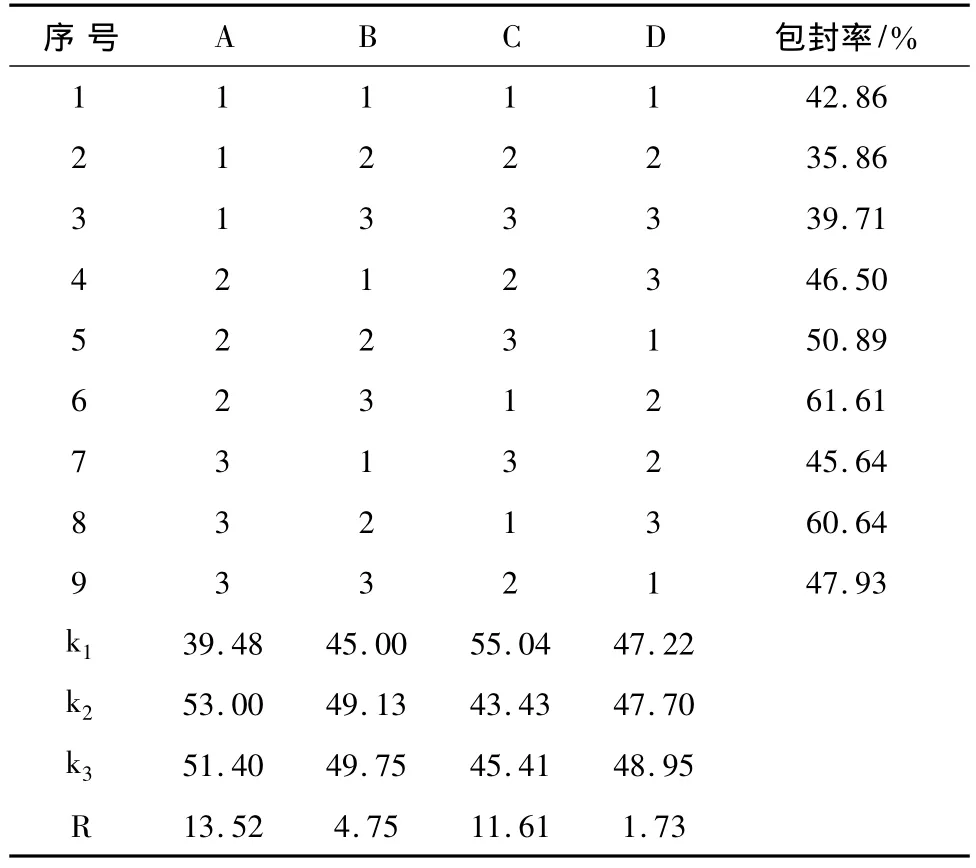
表2 正交实验结果
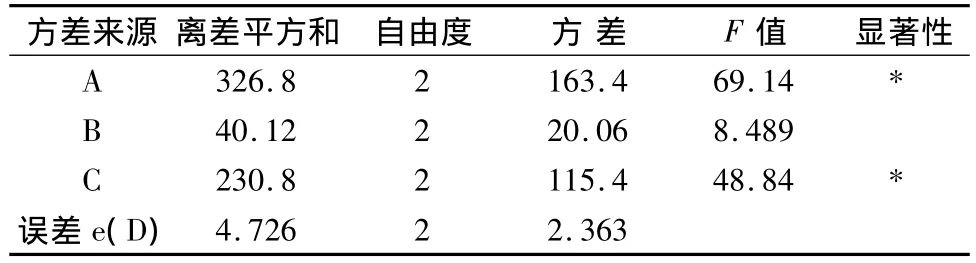
表3 方差分析
由表2直观评定可见,影响包封率的因素顺序为A>C>B,其中A、C影响较大,即药物浓度、壳聚糖浓度有较大影响,其次是海藻酸钠浓度。从表3知,A、C具有显著性差异,对微囊制备工艺有较大影响。
对各因素水平选择,从 A2>A3>A1、B3>B2>B1、C1>C3> C2,宜分别选 A2、B3、C1,故确定优化条件为 A2B3C1,即药物质量浓度0.2g/mL、壳聚糖0.2%、海藻酸钠2%。按上述工艺条件进行重复性验证试验(见表4),平均包封率为63.25%,包埋率变异系数约为1.91%,且微囊成型效果好,大小均匀,说明该工艺合理可行。

表4 重复性验证试验
2.2 黄芩微囊的释放度曲线 根据黄芩微囊体外溶出实验的测定结果,以时间t(单位h)为横坐标,释放度为纵坐标绘图,结果如图1所示。由图可以看出,黄芩苷在2 h内释放40%左右,随后24 h内释放较缓慢,表明该载药微囊有一定缓释作用。药物在前2 h释放较快,主要来自于吸附在微囊表面的药物分子,随后溶剂通过微囊空隙渗入囊内,包封于微囊中的药物溶解于溶剂并从空隙缓慢释放,从而达到缓释作用[9]。
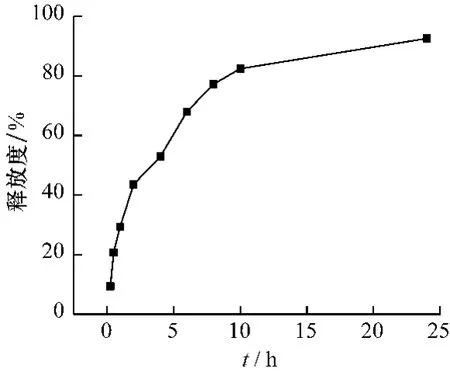
图1 黄芩微囊溶出度释放曲线
2.3 释放方程拟合 由图1的释放数据用零级、一级及Higuchi方程拟合,Q为t时刻药物释放度。结果见表5。

表5 黄芩缓释微囊释放曲线的方程拟合
由表5拟合结果可看出一级方程拟合的相关系数最大(r=0.9989),且Mse最小,说明该方程能较好描述黄芩微囊的体外释药特征,其缓释作用明显。
3 结论
通过L9(34)正交试验确定了锐孔-凝固浴法制备黄芩微囊最佳工艺条件,包埋率可达63.25%,并显示了良好成型效果,达到了微囊制备的目的和要求。其体外释放研究表明,壳聚糖/海藻酸钠黄芩微囊具有明显缓释特征,释药动力学拟合符合一级方程,该方法可用于中药缓释制剂制备,对探索中药缓释制剂研究具有一定示范意义。因中药成分复杂,采用单一成分进行体外释放考察尚不足以全面展现其缓释特征,故在下一步研究中有必要选择多成分或化学指纹图谱作为探索中药缓释制剂的指标。
[1]李玉萍,熊向源,刘建涛,等.黄芩活性成分的制备工艺和检测方法研究进展[J].时珍国医国药,2010,21(4):972-974.
[2]周锡钦,梁 鸿,路新华,等.中药黄芩主要黄酮类成分及其生物活性研究[J].北京大学学报:医学版,2009,41(5):578-584.
[3]薛瑞民,张丽锋,张 敏,等.正交试验优化复方黄芩巴布剂的制备工艺[J].中国药物与临床,2007,7(6):456-457.
[4]Wang J Y,Jin Y,Xie R,et al.Novel calcium-alginate capsules with aqueous core and thermo-responsive membrane[J].J Colloid Interf Sci,2011,353(1):61-68.
[5]何荣军,杨 爽,孙培龙,等.海藻酸钠/壳聚糖微胶囊的制备及其应用研究进展[J].食品与机械,2010(2):166-169,173.
[6]寿旭锋,范春雷.壳聚糖/海藻酸钠微囊在中药提取物缓释制剂中的应用[J].现代生物医学进展,2008,8(5):955-957.
[7]杜双奎,吕新刚,于修烛,等.锐孔法制作食醋微胶囊[J].食品与发酵工业,2009,35(5):85-89.
[8]梁晋伟,宋艳红,李云兰,等.高效液相色谱法测定复方黄芩漱口液中黄芩苷的含量[J].中国药物与临床,2011,11(3):301-302.
[9]陈莉敏,李柱来,王津.萘普生缓释微球制备工艺及性能研究[J].天然产物研究与开发[J].2007,19(5):878-880,889.
