桑树硬枝扦插生根过程中相关生理生化指标的动态分析
2011-07-25刘明鲁张晓峰程嘉翎
刘明鲁 孙 磊,2 张晓峰 聂 浩 程嘉翎,2
(1江苏科技大学,江苏镇江 212003; 2中国农业科学院蚕业研究所,江苏镇江 212018)
桑树属桑科桑属植物,是我国重要的经济树种。扦插作为桑树无性繁殖技术之一,不仅具有保持母株优良特性的优点,而且具有操作简单易行、育苗周期短等特点。但由于桑树枝条难以生根,扦插繁殖成活率低,因此制约了桑树扦插繁殖技术的推广应用。目前,曹邦华等[1]对桑树硬枝扦插过程中插穗基部的过氧化物酶(POD)、多酚氧化酶(PPO)、吲哚乙酸氧化酶(IAAO)的动态活性变化进行了研究,发现这3种酶活性的动态变化与生根过程密切相关,而对桑树硬枝扦插过程中营养物质含量和抗氧化酶系统活性变化的分析鲜见报道,且都将插穗基部作为研究重点,并未将顶芽下皮部和插穗基部作为一个上下联动的整体进行研究;为此我们将插穗基部皮层和顶芽下皮部(上部皮层)作为一个联动系统,研究分析了插穗皮层的含水率、营养物质、渗透调节物质、氧化酶类的动态变化,并探讨了这些因子对桑树扦插生根的影响,以期为桑树优良品种硬枝扦插繁育技术的改进提供理论依据。
1 材料与方法
1.1 材料及主要试剂
1.1.1 供试材料 桑品种:育71-1,选用1年生硬枝枝条的中下部剪制插穗,采自镇江桑树国家资源圃,树龄4年。
1.1.2 主要试剂 愈创木酚、DTT,为 BBI分析纯生化试剂,其余试剂均为国药分析纯。
1.1.3 主要仪器 超低温冷冻储藏箱(中科美菱低温科技有限责任公司),LAB TECH紫外分光光度计(上海精密科学仪器厂),雷磁PHS-2F型pH计(上海精宏实验设备有限公司),ROTANTA380R型冷冻离心机(Hettich ZENTRIFUGEN)。
1.2 试验方法
1.2.1 桑树硬枝扦插及发育过程形态表征调查2011年2月底进行扦插,在镇江桑树国家资源圃中剪取育71-1硬枝插条,剪成17 cm长的插穗1200余根,顶芽距上切口1.5 cm。采用地加温线温床扦插方法,扦插前用消毒净(中国农业科学院蚕业研究所附属蚕药厂生产)对温床进行消毒,将焦糠充分吸水后置于温床中,参照文献[2]的技术处理插穗并扦插,温度控制在28℃,相对湿度70% ~80%。扦插时插穗在温床上部露出第1个芽,扦插后定期喷水。每隔3 d进行1次生根形态观察;扦插21 d时随机抽取50根插穗,调查扦插生根率、生根插条的平均生根数、根长,3次重复。
1.2.2 桑树硬枝扦插生根过程中含水率、营养物质、渗透调节物质含量的测定 扦插的育71-1插穗,自扦插之日起,每隔3 d取20根插穗基部2 cm范围内的皮层(基部皮层)、插穗顶芽下面2 cm范围内的皮层(上部皮层),分别剪碎后混合均匀,参照文献[3]的方法进行插穗基部皮层、上部皮层的含水率、可溶性糖含量、可溶性蛋白含量的测定,参照文献[4]的方法进行插穗基部皮层、上部皮层脯氨酸含量的测定。
1.2.3 扦插生根过程中抗氧化酶活性及生根关联酶活性的测定 检测样品取样同1.2.2的方法,每个检测项目分别准确称取0.5 g新鲜插穗基部皮层与上部皮层,用液氮研磨,加入磷酸缓冲液(PBS)5 mL,在冰浴中研磨成浆,11000 r/min离心20 min,取上清液冷藏备用,3次重复。
参照文献[3]的方法测定超氧化物歧化酶(SOD)和IAAO的活性,参照文献[5]的方法测定抗坏血酸过氧化物酶(APX)的活性,参照文献[4]的方法测定过氧化氢酶(CAT)、POD的活性,参照文献[6]的方法测定PPO的活性。
SOD活性以抑制NBT光化还原率达50%的酶量为1个酶活单位,其结果以鲜质量为U/g表示;APX、CAT、POD以1 g插穗皮层鲜质量1 min改变0.01个OD值为1个酶活力单位(U/g);PPO以1 g插穗皮层鲜质量1 min改变0.1个OD值为1个酶活力单位(U/g);IAAO以1 g插穗皮层鲜质量在1 h内分解破坏吲哚乙酸(IAA)的质量(ug)为1个酶活力单位(U/g)。
1.3 数据处理
试验数据采用Excel软件和Origin软件进行统计分析。
2 结果与分析
2.1 硬枝扦插生根情况及发育过程形态表征
育71-1桑树硬枝插穗参照文献[2]的技术处理诱导,扦插经过21 d时,插穗生根率达到87.8%,生根插穗的平均生根数为19.6根/株,平均根长为3.5 cm。
桑树硬枝扦插生根形态学观测发现,插穗扦插3 d后,绝大部分插穗的切口上木质部与韧皮部交界处的微管形成层产生了少量的愈伤组织突起,到第6天观察到插穗切口及以上3 cm区段部位膨胀并伴有更多的突起;12 d后有大部分的插穗切口以上的皮部突起并伴随皮孔伸出明显的不定根尖,18 d后不定根伸长生长且有少量插穗产生2级侧根;插穗上部皮层无明显形态变化,插穗上的顶芽在第6天开始萌动,第18天已经抽生出新芽(图1)。据此,桑树硬枝扦插生根可大致分为4个时期:0~5 d为愈伤组织的诱导期,6~11 d为不定根生成诱导期,12~17 d为生根表达期,18~21 d为根的伸长期。
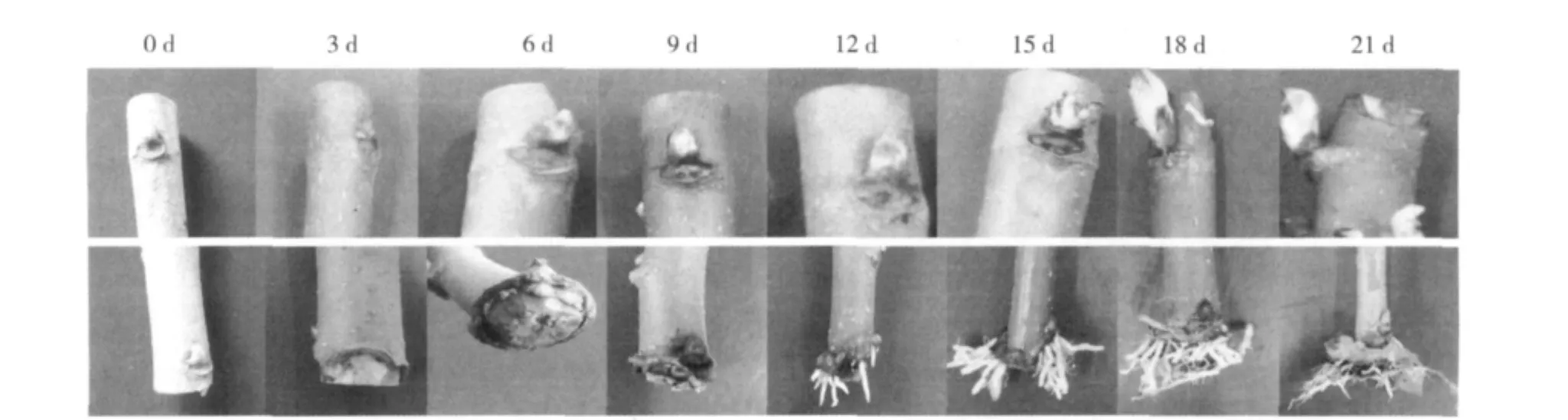
图1 桑树硬枝扦插过程中插穗基部与插穗顶芽形态表征变化
2.2 硬枝扦插过程中含水率的变化
桑树硬枝扦插插穗经人工诱导后,插穗基部皮层的含水率稳步上升,在第12天时达到最大值,之后趋于稳定,上部皮层的含水率变化不大;在整个生根过程中,插穗基部皮层的含水率明显高于上部皮层的含水率(图2)。水分作为一个重要的条件,对于植物的生存起着决定性的作用;插穗基部从扦插基质中吸收水分以适应由离体插穗所造成的机械损伤和水分胁迫,而顶芽下皮部裸露在空气中,处于室温条件下,生理活性较低,含水率无明显变化。
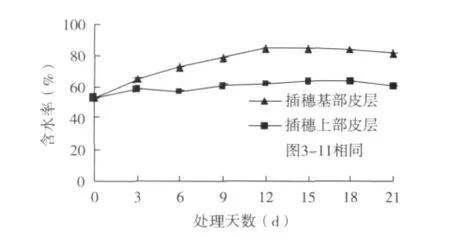
图2 硬枝扦插过程中含水率的变化
2.3 硬枝扦插过程中营养物质含量和渗透调节物质含量的变化
桑树硬枝扦插生根过程中,可溶性糖的含量总体呈下降趋势,在0~3 d变化得尤为剧烈,说明愈伤组织的诱导形成消耗了大量的可溶性糖,插穗上部皮层的可溶性糖和可溶性蛋白含量均高于插穗基部皮层,并且插穗上部皮层的可溶性蛋白含量变化也呈现出阶梯式下降的趋势,表明可溶性糖和可溶性蛋白由茎部向基部运输,以满足基部旺盛的代谢活动的需要。而插穗基部皮层的可溶性蛋白含量表现为先下降后上升再下降的趋势,这是因为在愈伤组织和不定根诱导期(0~11 d),大量消耗了可溶性蛋白以产生愈伤组织,导致蛋白质含量急剧下降;12~17 d愈伤组织膨大生长,并且部分插穗开始生根,可溶性蛋白稍有上升;18~21 d根系生长,插穗顶芽大部分已萌发,可溶性蛋白含量略有下降(图3)。
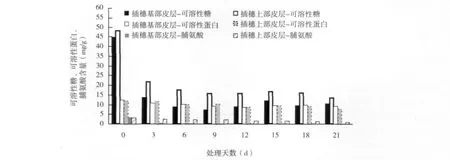
图3 硬枝扦插过程中可溶性糖、可溶性蛋白、脯氨酸含量的变化
桑树硬枝扦插过程中插穗基部皮层和插穗上部皮层的脯氨酸含量和可溶性糖含量变化趋势相似,总体呈下降趋势,在愈伤组织诱导初期(0~3 d),插穗基部皮层的脯氨酸含量急剧下降,之后维持恒定水平;而插穗上部皮层的脯氨酸含量则呈现出阶梯式下降的趋势,表明插穗上部皮层水分、营养和渗透调节系统的变化不如插穗基部皮层的变化剧烈,更多的表现出一种阶段性变化的趋势。(图3)
2.4 硬枝扦插过程中抗氧化酶类活性变化
植物细胞内存在清除氧自由基的酶促保护系统和非酶促保护系统,SOD、APX、CAT、POD是酶促保护系统中的重要成份。
2.4.1 SOD和APX活性变化 扦插过程中插穗上部皮层的SOD活性均高于插穗基部皮层;而插穗上部皮层的APX活性均低于插穗基部皮层(图4-5)。SOD是氧自由基清除酶促防御系统中的重要成员,与植物抗氧化能力直接相关[7];SOD活性也是衡量生根的重要指标[8]。桑树硬枝扦插过程中的SOD活性和APX活性变化与扦插生根相关联,其在生根过程中呈下降趋势。硬枝扦插初期,经过人工诱导,离体插条基部通过吸收基质水分对抗机械损伤和水分胁迫,很快适应了环境,插条遭受氧自由基的危害较小,以后随着不定根的长出和伸长,逐渐处于有利的生存状态。
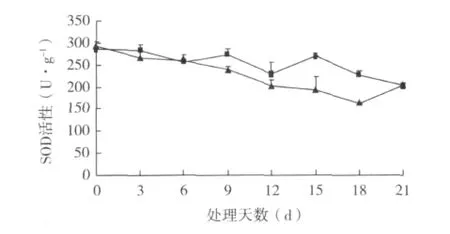
图4 硬枝扦插过程中SOD活性变化
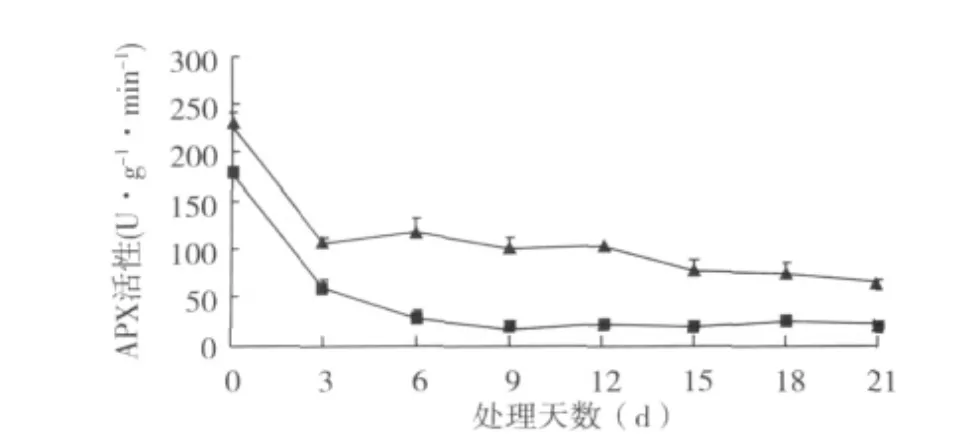
图5 硬枝扦插过程中APX活性变化
2.4.2 CAT活性变化 CAT活性在插穗基部皮层表现出波浪式上升趋势,而在插穗上部皮层则表现为先升高后下降再升高的趋势(图6)。O2-经过SOD的解毒作用生成H2O2,随后存在于细胞质中的H2O2主要由2种胞质APX清除,而CAT则主要降解过氧化物酶体中的H2O2[9]。

图6 硬枝扦插过程中CAT活性变化
2.5 硬枝扦插过程中生根关联酶活性变化
2.5.1 POD活性动态变化 从图7可以看出,插穗基部皮层POD活性呈先升高后下降再升高的趋势,而在插穗上部皮层则表现出先略有上升后相对恒定的趋势。POD通过催化H2O2与其他底物反应,以消除植物在逆境和衰老情况下产生的H2O2,而减少H2O2对生物体的伤害作用。POD不仅与植物抗逆和衰老有关,同时具有与植物生长素氧化酶相似的性质,对植物的生长有调节作用,参与细胞壁多种结构成分的聚合作用,因此POD活性对插条生根起着重要的作用。
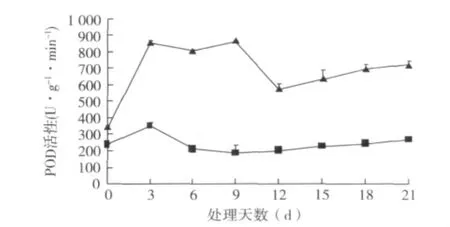
图7 硬枝扦插过程中POD活性变化
POD不仅是植物抗氧化酶系统的重要组成部分,而且在扦插生根过程中也发挥着重要的功能。Garspar等[10]将 POD作为植物插条生根的标志之一,植物POD是一类含铁卟啉辅基的酶,参与了植物体内多种生理生化过程,POD在植物体内不仅参与了生长素的代谢活动,而且对植物形态的建成、生长分化也有一定的作用。POD活性在插穗生根的不同时期呈现出规律性变化。在整个扦插阶段,插穗基部皮层的POD含量明显高于插穗上部皮层;插穗基部皮层的POD活性在扦插后3 d上升,3~9 d稳定,9~12 d下降,12 d后持续上升;插穗上部皮层的POD活性在扦插过程中变化不明显。在愈伤组织和不定根的诱导期(0~9 d),POD活性上升,消耗体内过多的内源生长素,有利于诱导根原基发育;其后9~12 d,POD活性下降,导致体内IAA含量上升,有利于不定根的表达;12~21 d生根期间,此时POD活性稳步上升(图7),促进不定根的形成和根的伸长生长。
2.5.2 PPO活性变化 在桑树硬枝扦插过程中,插穗基部皮层的PPO活性呈现先下降后上升的趋势;在愈伤组织诱导期,PPO活性相继下降,在不定根的诱导、表达和伸长期,PPO活性逐渐上升,说明愈伤组织的诱导需要低活性的PPO,而不定根的表达和伸长需要高活性的PPO,这与曹邦华等[1]的研究结论一致;而插穗上部皮层的PPO活性在12 d后呈明显下降趋势,15 d之后逐渐上升。插穗基部皮层的PPO活性总体上略高于上部皮层的PPO活性(图8)。
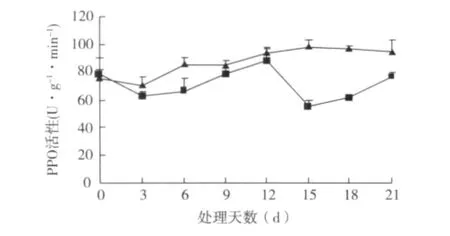
图8 硬枝扦插过程中PPO活性变化
PPO的存在对不定根的形成是十分重要的[11]。高等植物中普遍存在PPO,这是一种含铜的酶,不仅在植物的生长发育中起着重要作用,而且在植物的器官形态上也发挥着重要的功能。酚类物质对不定根的发生与发育起着极其重要的作用,PPO的一个重要生理功能就是催化酚类物质与IAA形成一种“IAA-酚酸复合物”[12],这种复合物是一种生根辅助因子,具有促进不定根形成的活性[13]。在不定根的诱导期和根的表达和伸长期,PPO活性较高,因此,形成的IAA-酚酸复合物较多,有利于不定根的发育和不定根的诱导,促进不定根的形成和根的伸长生长。
2.5.3 IAAO活性变化 在扦插生根过程中,IAAO活性在插穗基部皮层0~5 d愈伤组织诱导期升高,在第6天时达到高峰,在根的诱导期急剧下降,在根的表达和伸长期保持较低水平。而插穗上部皮层的IAAO活性呈现出先上升后下降再上升的总趋势,在12 d后持续小幅上升(图9)。
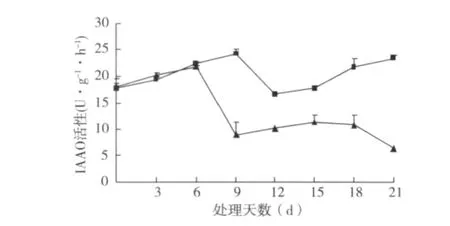
图9 硬枝扦插过程中IAAO活性变化
3 讨论
3.1 硬枝扦插生根与含水率、营养物质和渗透调节物的关系
桑树硬枝扦插过程中,插穗基部皮层的含水率先稳步升高后趋于稳定,上部皮层的含水率无明显变化;可溶性糖、脯氨酸含量在扦插生根过程中呈下降趋势,且在0~3 d表现得极为剧烈,之后趋于平稳,可溶性蛋白在插穗基部皮层表现为降—升—降的趋势,在插穗上部皮层表现出差异的变化趋势。营养物质不仅是插穗生根和生长所不可或缺的,而且也是插穗在生根之前维持其生存的重要能源。糖类物质是植物体内主要的营养储藏和运输形式,插穗生根与插穗内含糖量有关。脯氨酸是植物中广泛存在的渗透调节物质,其作用是保持细胞与环境渗透平衡,防止水分散失,在水分胁迫时它能与细胞内的一些化合物形成聚合物,具有保水作用[14]。可溶性蛋白也常作为植物抗逆性指标,主动参与水分胁迫时植物的渗透调节,是除脯氨酸、可溶性糖外,植物中重要的有机渗透调节物质[15]。这些生理活性物质在扦插生根过程中的营养供应和渗透调节中发挥着重要的功能。
3.2 硬枝扦插生根与抗氧化酶系统的关系
SOD与CAT、POD、APX协同作用,可防御活性氧或其他过氧化物自由基对细胞膜系统的伤害。在扦插过程中,SOD活性和APX活性总体上呈下降趋势,而CAT活性和POD活性总体上呈上升趋势,SOD、POD、CAT、APX的协同作用可以将植物体内的活性氧维持在较低的水平,以保证其正常的生长代谢。
3.3 硬枝扦插生根与生根关联酶的关系
POD、PPO、IAAO是目前公认的与不定根关系最密切的3种酶类,它们不仅在植物的生长发育中起重要的作用,而且在植物的形态建成中也发挥着重要的功能。POD活性的高低可作为判定桑树生根难易的指标之一。已有研究发现[16-17],POD 活性在扦插生根过程中会出现2个高峰,分别参与根的诱导及表达,POD作用的某些产物可能是不定根发生和发展所必需的辅助因子。PPO的重要作用是催化酚类物质与IAA综合形成一种生根辅助因子,即有利于生根的“IAA-酚酸复合物”。IAAO可以氧化IAA,IAA一个重要的生理功能就是促进不定根的形成,IAA含量的变化势必影响不定根的发生;因此,IAAO活性的大小与根的发生有非常重要的关系。Wiesmann等[18]认为:在根的诱导期较低的IAAO活性有利于不定根的发育,从而促进不定根的生长;宋金耀等[16]和宋丽红等[19]发现,在根的发生期IAAO活性下降有利于插穗IAA的积累以促进根的生长;在桑树硬枝扦插生根过程中,3种氧化酶活性都呈现规律性的变化,与不定根的发生和发展关系非常密切,它们在生根过程中的作用可能是既独立又联系的,通过相互作用来影响生根。
3.4 硬枝扦插生根与插穗不同部位的关系
桑树硬枝扦插时,焦糠一直埋到顶芽下,插穗基部与芽下皮部在扦插温床中所处的温度不同,插穗基部埋于加温线正上方,为恒温28℃,芽下皮部为室温2~12℃,本试验对第1芽下皮层的相关生理生化指标进行了测定,研究分析发现插穗下部皮层的可溶性糖、脯氨酸、APX活性的变化趋势与插穗基部相似,而抗氧化酶系统在桑树硬枝扦插过程中变化不大;表明扦插生根与插穗上部皮层的抗氧化酶系统关联度不高;生根关联酶中的IAAO和PPO活性在0~12 d与插穗基部皮层变化趋势大致相同,12 d之后变化趋势相反。12 d为不定根形成期,且顶芽已经萌动,插穗基部皮层和插穗上部皮层的差异变化可能与酚类物质和IAA的极性运输有关。
本研究将桑树硬枝扦插过程中插穗基部皮层和插穗上部皮层作为一个上下联动的系统,进行了相关生理生化指标的测定,研究分析了营养物质、渗透调节物质和氧化酶类,在扦插过程中的变化及生根特性和酶活性变化之间的联系,但对桑树扦插生根机理的明确解析,还有待于进一步的研究。可以考虑从插穗受伤后在特定条件下的信号传导,利用抑制消减杂交技术(SSH)和蛋白质双向电泳技术,对在扦插过程中成根基因的激活和表达进行更加深入的研究。
[1]曹帮华,扈红军,张大鹏,等.桑树硬枝扦插生根能力及其生根关联酶活性的研究[J].蚕业科学,2008,34(1):96 -100.
[2]程嘉翎,肖龙云,汪萍,等.一种苗木的立体育苗方法及产品:中国,200710132106.7[P].2010-06-02.
[3]李玲,李娘辉,蒋素梅,等.植物生理学模块实验指导[M].北京:科学出版社,2009:48-75.
[4]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002,66:120 -121.
[5]Asada K.Formation of active oxygen end its scavenging[J].Methods Enzymol,1984,105:422 -429.
[6]Park Y K,Sato H H,Almeid T D,et a1.Polyphenol oxidase of mango(Mangifera indica var.Haden) [J].Food Sci,1980,45:1619-1621.
[7]Sairam R K,Saxena D C.Oxidatives stress and antioxidants in wheat genotypes:possible mechanism of water stress tolerance[J].J Agron Crop Sci,2000,184(1):55.
[8]华宏,杜旭华,王顺财,等.楸树扦插生根过程中插条保护酶与丙二醛动态变化[J].南京林业大学学报:自然科学版,2008,32(6):128-132.
[9]Giacomelli L,Masi A,Ripoll D R,et a1.Arabidopsis thaliana deficient in two chloroplast ascorbate peroxidases shows accelerated light-induced necrosis when levels of cellular ascorbate are low[J].Plant Mol Biol,2007,(65):627 -644.
[10]Garspar T,Kevers C,Hausman J F,et al.Total Practical uses of Peroxidase activity as a predictive maker of rooting performance of micropropagation[J].Agronomic,1992,(12):757 -765.
[11]A1 B A,Schwabe W W.The possible involvement of polyphenol oxidase and the auxin-oxidase system in root formation and development in cuttings of Pistacia vera.[J].Hort Sci,1984,59(3):453-461.
[12]Haissig B E.Influence of auxins and synergists on adventitious root primordium in initiation and development[J].New Zealand J For Sci,1974,4:311 -323.
[13]Bassuk N L,Hunter L D,Howard B H.The apparent of polyphenol oxidase and phloridzin in the production of apple rooting cofactors[J].Hort Sci,1981,56(4):313 -322.
[14]Rentsch D,Hirner B,Schmelzer E.Salt stress-induced proline transporters and salt stress-repressed broad specific amino acid permeases identified by suppression of a yeast amino acid targeting mutant[J].Plant Cell,1996,8:1437 -1446.
[15]Harle P D,Cress W A,Van S J.Dissecting the roles of osmolyte accumulation during stress[J].Plant Cell & Enviroment,1998,21(6):535-553.
[16]宋金耀,何文林,李松波,等.毛白杨嵌合体扦插生根相关理化特性分析[J].林业科学,2001,37(5):64-67.
[17]Gyana R R.Effects of auxins on adventitious root development from single node cuttings of Camellia sinensis(L)Kuntze and as Sociated biochemical changes[J].Plant Growth Regul,2006,48:111-117.
[18]Wiesmann Z,Riov J,Epstein E.Companrison of movement and metabolism of indole-3-acetic and indole-3-butyric acid in mung bean cuttings[J].Physiol Piant,1988,74:556 -560.
[19]宋丽红,曹帮华.光叶褚扦插生根的吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶活性变化研究[J].武汉植物学研究,2005,23(4):347-350.
