毛乳头细胞和表皮细胞构建带附属器的组织工程皮肤
2011-07-25焦虎范金财刘立强田佳甘承冯苏云付思祺陈文霖
焦虎 范金财 刘立强 田佳 甘承 冯苏云 付思祺 陈文霖
人工皮肤替代物的研究已经有30多年的历史,早在1975年的时候,Rheinwald等[1]就培养出了与正常表皮层非常类似的复层的表皮细胞膜片。1979年,Bell等[2]第一次将成纤维细胞种植在胶原网上,构建了真皮替代物。后来有研究将组织工程表皮替代物和真皮替代物结合,构建了既含有表皮结构又含有真皮结构的复合皮肤替代物。但目前的组织工程皮肤替代物都不具有附属器结构,所以移植愈合后的创面皮肤与正常皮肤在色泽、质地、湿度和功能等方面有较大的差距。
另外,对于一些较大面积的头皮缺损,用现有的毛发移植技术进行毛发的修复重建难度较大。如果能够构建出带毛发的组织工程皮肤替代物,就可以在修复皮肤缺损的同时,一期完成毛发的修复重建。因此,构建带附属器的组织工程皮肤成了组织工程皮肤研究的难题和未来的发展方向。本研究遵循毛囊形成基本原理,将毛乳头细胞和表皮细胞充分混合后,引入皮肤替代物内,使两者相互作用,以期构建出带毛囊的组织工程皮肤替代物。
1 材料和方法
1.1 主要试剂及仪器
DMEM培养液、Ham’s F12培养液(HyClone公司,美国);表皮生长因子(Peprotech公司,美国);胰岛素、氢化可的松(北京优博奥生物科技有限公司);霍乱毒素(北京迈晨科技有限公司);转铁蛋白(Sigma公司,美国);鼠抗人α-平滑肌肌动蛋白(α-SMA)一抗(武汉博士德生物工程有限公司);荧光标记兔抗鼠二抗(北京中杉金桥生物技术公司)。倒置相差显微镜、荧光显微镜(Olympus公司,日本)。
1.2 角质形成细胞的培养
皮肤标本来自外科手术中切下的正常皮肤,角质形成细胞的培养方法同文献[3]。将皮肤用0.25%的中性蛋白酶溶液4℃消化过夜。撕下表皮层并用0.05%胰酶-0.02%EDTA溶液37℃消化15 min后,吹打使表皮细胞游离下来。将得到的表皮细胞悬液离心后,用角质形成细胞培养基在CO2培养箱中37℃培养。角质形成细胞培养基:DMEM和Ham’s F12混合液(3∶1)、10%胎牛血清、100 U/mL青链霉素、0.2 μg/mL氢化考地松、0.02 μg/mL EGF、5 μg/mL转铁蛋白、5 μg/mL胰岛素和8 μg/mL霍乱毒素。
1.3 毛乳头细胞的培养
毛乳头细胞的培养采用酶消化法。头皮用0.25%中性蛋白酶4℃消化过夜。将含有毛囊下段的皮下组织切下并剪成泥状。在泥状的皮下组织中加PBS吹打混匀后,以2 000 r/min的速度离心5 min。离心后获取沉淀,用0.2%的Ⅰ型胶原酶37℃消化2~2.5 h后,加入PBS并反复吹打使毛乳头从周围组织中分离出来。1 000 r/min离心5 min,弃去未彻底消化的纤维组织后,将液体反复吹打混匀,静止十几秒待大块组织沉淀后,吸取含有毛乳头的上清,300 r/min离心3 min。离心后将沉淀移入35 mm培养皿,计数毛乳头总数,按每35 mm培养皿10个毛乳头的密度接种。毛乳头细胞培养基为含10%胎牛血清和100 U/mL青、链霉素的DMEM培养基。
1.4 免疫荧光染色
取第3代毛乳头细胞爬片,4%多聚甲醛固定后,用0.1%Triton室温孵育5 min。用1%BSA漂洗6次,每次5 min,封闭非特异性抗原。加入鼠抗人α-SMA一抗(1∶100稀释),4℃孵育过夜。0.1%BSA漂洗6次,每次5 min,去除未结合一抗。加入兔抗鼠荧光标记二抗(1∶300稀释),室温孵育1 h。0.1%BSA漂洗6次,每次5 min,去除未结合二抗,DAPI染核。
1.5 组织工程皮肤替代物的构建
实验组:取第3代的人毛乳头细胞和第1代的人角质形成细胞各4×105个,用角质形成细胞培养基混合制成760 μL的细胞悬液,并放置于冰浴中备用。将200 μL的Ⅰ型鼠尾胶原蛋白(5 mg/mL)加到12 μL浓度为0.1 mol/L的NaOH溶液中,再加入23 μL的10×DMEM培养基混匀。加入已制备好的760 μL的细胞悬液,混匀后立即加到24孔板中。室温下放置20 min,待胶凝固。然后再在胶的表面种植2×105个角质形成细胞,加入适当体积的角质形成细胞培养基,浸没培养3 d后转为气-液界面培养5 d。
对照组:760 μL的角质形成细胞培养基中不加任何细胞,其余步骤同上,构建出的皮肤替代物的真皮层。
1.6 组织工程皮肤替代物的移植
实验采用4~6周龄雄性裸鼠,实验组和对照组各12只。以1%异戊巴比妥钠(80 mg/Kg剂量)腹腔注射麻醉后,在裸鼠背部形成直径为1 cm的全层圆形皮肤缺损。将构建的皮肤替代物移植到裸鼠背部覆盖创面。移植后观察各组创面愈合情况,比较实验组和对照组皮肤替代物收缩的情况。每组分别于术后第4、6、8周各处死裸鼠4只,从移植区域的中心部位切取皮肤替代物,行组织学观察。
1.7 HE染色
取材后以中性福尔马林固定,梯度乙醇脱水,石蜡包埋,5 μm厚度切片,HE染色观察。
2 结果
2.1 酶消化法获得毛乳头细胞
刚刚迁出的细胞多为三角形,随着细胞继续迁出,细胞形态多为长梭形,类似成纤维细胞,但两端较扁平多突起,胞质内可见羽状纹理(图1)。细胞有明显聚集生长特性,前3代细胞可形成由几层细胞构成的圆形聚集体(图2)。细胞最多可传7代。毛乳头细胞的标志物α-SMA在酶消化法培养的毛乳头细胞中表达阳性(图3),说明这些细胞是毛乳头细胞。
2.2 创面愈合情况
移植后2周,实验组创面愈合较好,无创面裸露,表面红润(图4);对照组创面愈合较差,局部创面裸露,充血严重,有渗出(图5)。移植后3周,实验组创面已完全愈合,创面干燥开始收缩,并且移植物表面出现脱屑现象;对照组仍未完全愈合,尚有较大痂皮,但已无充血(图6)。移植后4周,对照组创面完全愈合,两组都已出现较大收缩,但对照组收缩更为明显(图7)。直到移植后8周,两组创面均未见毛发长出。
2.3 实验组真皮层内形成皮肤附属器
移植后4周,实验组表皮层较厚,分层不明显,表皮和真皮的连接较为紧密;真皮层纤维排列紊乱、细胞分布不均匀,未见到毛囊等附属器(图8)。与实验组相比,对照组表皮和真皮的连接较为疏松,表皮和真皮间有间隙,其他镜下结构与实验组类似(图9)。
移植后6周,实验组真皮层内见到与皮肤表面垂直的毛囊样结构;在同一视野内还可见与正常毛囊切面类似的同心圆状结构;此外还可见皮脂腺结构,大多位于毛囊样结构周围,也有单独存在(图10)。对照组真皮层内未见毛囊样结构和皮脂腺样结构(图11)。
移植后8周,实验组真皮层内毛囊样结构和皮脂腺结构仍然存在,与第6周无明显差异。而对照组的真皮层内仍未见毛囊样结构和皮脂腺样结构。
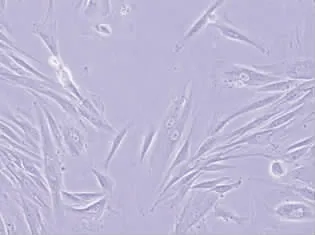
图1 类似成纤维细胞的毛乳头细胞,胞质内见羽状纹理Fig.1Fibroblasts-like dermal papillae cells and penniform texture in cytoplasm

图2 前3代的细胞可以相互聚集形成聚集体Fig.2Aggregations formed of the cells of first three passages
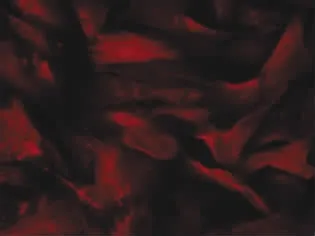
图3 毛乳头细胞的标志物α-SMA阳性Fig.3Positive expression of α-SMA,the markers of dermal papillae cells
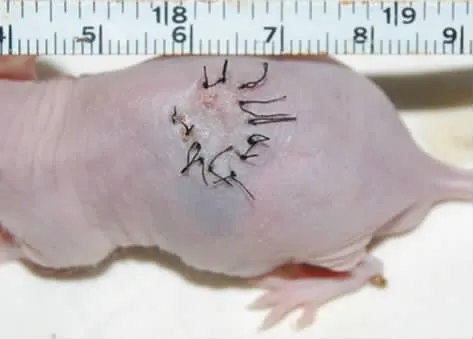
图4 移植2周后实验组创面愈合良好Fig.4Wounds had healed in the experiment group,2 weeks after transplantation
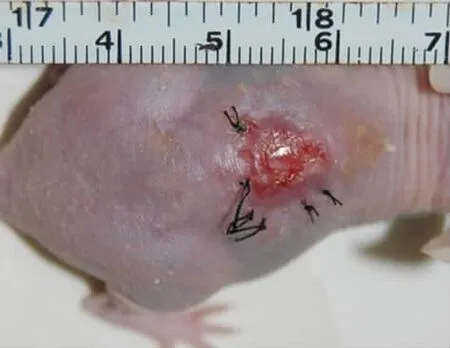
图5 移植2周后对照组创面仍有部分区域裸露Fig.5Wounds were partly expsured in the control group,2 weeks aftertransplantation

图6 移植3周后对照组仍未完全愈合Fig.6Wounds had not healed in the control group even 3 weeks after transplantation

图7 移植4周后对照组创面收缩明显Fig.7The wounds of control group shrinked more obviously than the experimental group,4 weeks after transplantation
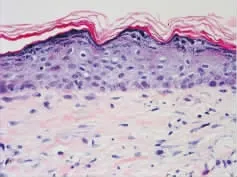
图8 移植4周后实验组表皮层和真皮层连接紧密,未见到毛囊等附属器Fig.8The epidermis and dermis connected tightly and no hair or other appendages were found in the experimental group 4 weeks after transplantation

图9 移植4周后对照组表皮层和真皮层连接疏松,未见到毛囊等附属器Fig.9The epidermis and dermis connected loosely and no hair or other appendages were found in the control group 4 weeks after transplantation
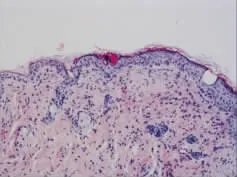
图10 移植6周后实验组真皮层内形成毛囊样结构和皮脂腺样结构Fig.10Some constructions like hair follicles or sebaceous glands were found in the control group 6 weeks after transplantation

图11 移植后6周对照组真皮层内未形成毛囊样结构和皮脂腺样结构Fig.11Constructions like hair follicles or sebaceous glands were not found in the experimental group 6 weeks after transplantation
3 讨论
皮肤是人体抵御外来侵袭的第一道防线,各种原因导致的皮肤损伤极为常见。传统治疗大面积全层皮肤损伤的金标准是自体皮肤移植,但自体皮肤移植存在皮源有限和供区遗留瘢痕等问题。异体皮也是一个较好的选择,但异体皮来源也受限、并且存在排斥反应、疾病传播、医学伦理等问题。组织工程皮肤为解决上述问题提供了可能的途径。以往的研究大多把成纤维细胞种植在真皮层,角质形成细胞种植在表皮层构建皮肤替代物,这样的皮肤替代物没有任何皮肤附属器,修复效果不是很理想[4]。
Oliver等[5]最早发现毛乳头对于毛囊的生长是必需的,毛乳头和毛囊上皮相互作用可以诱导出新的毛囊。1984年,Jahoda等[6]首次利用培养的鼠胡须毛乳头细胞和毛囊的上半部分结合后,在老鼠体内诱导出了新的毛囊-皮脂腺单位。这表明体外培养的毛乳头细胞同样具有诱导毛囊-皮脂腺形成的能力。以后的研究发现,体外培养的毛乳头细胞和其他可以向上皮转化的细胞混合移植到裸鼠体内可以形成毛囊[7-9]。很多研究都已证实,毛囊形成是毛乳头细胞诱导干细胞向毛囊上皮转化的结果[10-12]。
随着人们对毛囊形成机制的深入研究和毛乳头细胞在毛囊形成过程当中作用的认识,有研究用毛乳头细胞作为真皮来源细胞构建皮肤替代物[13-14],但是并没有得到带有毛囊结构的皮肤替代物。这可能是因为构建皮肤替代物时,将毛乳头细胞和角质形成细胞分别种植在真皮层和表皮层,由于两者不能相互作用而未能形成毛囊。本研究中,我们根据毛囊形成原理,将角质形成细胞和毛乳头细胞一起种植在皮肤替代物的真皮层。移植后2周,实验组创面即愈合良好,而对照组需要4周才能完全愈合;另外,实验组创面收缩也较对照组小。有研究报道,真皮层含有成纤维细胞或毛乳头细胞的皮肤替代物要较真皮层不含有任何细胞的皮肤替代物的创面愈合能力更强、收缩更少;构建的皮肤替代物中,真皮层内的毛乳头细胞可以通过分泌IGFBP-2促进角质形成细胞增殖和维持表皮干细胞的特性[14]。Qi等[15]将毛乳头细胞种植到去细胞真皮上,再在表面种上表皮干细胞形成复合皮肤替代物,移植后3周表皮层较无毛乳头细胞的去细胞真皮组更厚,这也提示毛乳头细胞可以促进表皮细胞的分层。但是,在我们的研究中,实验组和对照组表皮层厚度并没有明显差别。这可能是因为表皮层厚度的差异主要是体外培养阶段产生的,移植之后由于微环境接近正常,毛乳头细胞促进表皮层生长的作用变的相对不明显。而我们的研究中,体外培养时间非常短,所以表皮层厚度的差异并不突出。
本研究发现,移植后6周实验组真皮层内可见到毛囊样结构,对照组未形成类似结构,证明了毛乳头细胞和表皮细胞不仅以细胞悬液形式移植到动物体内后可以相互作用[8,16],而且在Ⅰ型胶原蛋白里也可以相互作用,和文献报道的结果一致[17]。但新形成的毛囊样结构与正常毛囊结构存在一定差异,正常毛囊结构复杂,而我们得到的毛囊结构多为较简单的细胞聚集,没有形成进一步的分化。皮脂腺形成过程和毛发的形成过程类似,都是由毛乳头细胞诱导上皮细胞转化而来。在实验组中也发现了大量皮脂腺结构,它们与正常皮脂腺结构相似,但它们与毛囊的连接并不像正常毛囊那样紧密,有的甚至单独存在。
综上所述,构建带毛囊的组织工程皮肤替代物,必须将毛乳头细胞和角质形成细胞一起种植在皮肤替代物的真皮层,从而使两种细胞相互作用而形成毛囊-皮脂腺结构。构建的带毛囊-皮脂腺结构的皮肤替代物,创面修复能力强,并且可减少创面收缩。
[1]Rheinwald JG,Green H.Formation of a keratinizing epithelium in culture by a cloned cell line derived from a teratoma[J].Cell,1975,6(3):317-330.
[2]Bell E,Ivarsson B,Merrill C.Production of a tissue-like structure by contraction of collagen lattices by human fibroblasts of different proliferative potential in vitro[J].Proc Natl Acad Sci USA,1979,76(3):1274-1278.
[3]Coolen NA,Verkerk M,Reijnen L,et al.Culture of keratinocytes for transplantation without the need of feeder layer cells[J].Cell Transplant,2007,16(6):649-661.
[4]Charruyer A,Ghadially R.Stem cells and tissue-engineered skin[J].Skin Pharmacol Physiol,2009,22(2):55-62.
[5]Oliver RF.Whisker growth after removal of the dermal papilla and lengths of follicle in the hooded rat[J].J Embryol Exp Morphol,1966,15(3):331-347.
[6]Jahoda CA,Horne KA,Oliver RF.Induction of hair growth by implantation of cultured dermal papilla cells[J].Nature,1984,311(5986):560-562.
[7]Weinberg WC,Goodman LV,George C,et al.Reconstitution of hair follicle development in vivo:determination of follicle formation,hair growth,and hair quality by dermal cells[J].J Invest Dermatol,1993,100(3):229-236.
[8]Ehama R,Ishimatsu-Tsuji Y,Iriyama S,et al.Hair follicle regeneration using grafted rodent and human cells[J].J Invest Dermatol,2007,127(9):2106-2115.
[9]Osada A,Kobayashi K,Masui S,et al.Cloned cells from the murine dermal papilla have hair-inducing ability[J].J Dermatol Sci,2009,54(2):129-131.
[10]Qiao J,Zawadzka A,Philips E,et al.Hair follicle neogenesis induced by cultured human scalp dermal papilla cells[J].Regen Med,2009,4(5):667-676.
[11]Young TH,Lee CY,Chiu HC,et al.Self-assembly of dermal papilla cells into inductive spheroidal microtissues on poly(ethylene-covinyl alcohol)membranes for hair follicle regeneration[J].Biomaterials,2008,29(26):3521-3530.
[12]Osada A,Iwabuchi T,Kishimoto J,et al.Long-term culture of mouse vibrissal dermal papilla cells and de novo hair follicle induction[J].Tissue Eng,2007,13(5):975-982.
[13]郑敏,曾越兰,吕中法.毛囊细胞移植诱导裸鼠毛囊样结构形成的研究[J].浙江大学学报,2004,33(4):287-289.
[14]Kim DS,Cho HJ,Yang SK,et al.Insulin-like growth factor-binding protein contributes to the proliferation of less proliferative cells in forming skin equivalents[J].Tissue Eng Part A,2009,15(5):1075-080.
[15]Qi SH,Liu P,Xie JL,et al.Experimental study on repairing of nude mice skin defects with composite skin consisting of xenogeneic dermis and epidermal stem cells and hair follicle dermal papilla cells[J].Burns,2008,34(3):385-392.
[16]Zheng Y,Du X,Wang W,et al.Organogenesis from dissociated cells:generation of mature cycling hair follicles from skin-derived cells[J].J Invest Dermatol,2005,124(5):867-876.
[17]Nakao K,Morita R,Saji Y,et al.The development of a bioengineered organ germ method[J].Nat Methods,2007,4(3):227-230.
