青霉素与牛血清白蛋白相互作用研究
2011-07-25魏海,魏霞
魏 海,魏 霞
(1.四平市妇婴医院,吉林 四平 136000;2.四平巨能药业有限公司,吉林 四平 136000)
研究蛋白质与药物的相互作用不仅可以优化药物分子结构、优化处方和给药途径,还可以为提高药物的生物利用率和生物效应提供有用的信息。血清白蛋白能与许多内源及外源性化合物结合,从而起到重要的存储和转运作用[1,2]。人血清白蛋白(HSA)和牛血清白蛋白(BSA)二者的氨基酸序列高度相似,所以科学家通过研究药物与BSA相互作用作为对HSA结合情况的参考。荧光光谱法因其操作简单、快捷成为众多研究方法中的热点[3,4]。通过药物对蛋白质内源荧光的猝灭现象,确定猝灭机理及猝灭常数,可以了解药物和蛋白的作用机理和作用强度。本文利用荧光光谱研究了生理条件下青霉素与牛血清白蛋白的相互作用机制,以及它们对BSA微环境的影响。
1 实验部分
1.1 实验试剂和仪器
本实验所用到的主要试剂有青霉素(AR,中诺药业(石家庄)有限公司);牛血清白蛋白(AR,天津市福晨化学试剂厂);三羟甲基氨基甲烷(Tris,AR,国药集团化学试剂有限公司);本实验所用水均为去离子水。荧光光谱通过日本岛津公司生产的RF-5301PC型荧光光谱仪获得。
1.2 溶液配制
Tris-HCl溶液的配制:精确称取0.5841g的氯化钠溶解后转移至100mL容量瓶中,再分别移取25mL浓度为0.2mol/L的Tris水溶液,以及40mL浓度为 0.1mol/L的HCl溶液至容量瓶中,最后用去离子水定容,配制成Tris-HCl盐酸缓冲液。
BSA溶液的配制:精确称取0.0750gBSA,用Tris-HCl溶液定容于1000mL容量瓶中,配制成1.67×10-5mol/L的BSA溶液。
1.3 实验方法
分别定量移取“1.2”中配制的BSA和青霉素溶液于比色管中,在波长范围为220~650nm,狭缝为0~3.0nm,激发波长为281nm条件下,记录荧光光谱。
2 结果与讨论
2.1 青霉素和BSA的紫外及荧光光谱
图1为BSA和青霉素在激发波长为281nm时的荧光光谱,可以看出BSA在328nm处有一特征峰,此峰为BSA在Trp-134和212位上色氨酸残基(Trp)的特征峰。而青霉素在同样条件下无特征吸收,为此本文以328nm作为青霉素与BSA作用的分析波长。探讨青霉素对BSA的荧光猝灭作用。

图1 青霉素(a)和BSA(b)的荧光光谱
2.2 结合常数Kq的确定
动态猝灭是荧光体与猝灭体由于热运动等发生碰撞而引起的,静态猝灭是荧光体与猝灭体形成络合物,从而使荧光体的荧光猝灭。为了确定此猝灭过程的机制,先按动态猝灭过程处理,那么服从Stern-Volmer方程[5]:

其中F0为猝灭体不存在时的荧光强度,F为加入猝灭体后的荧光强度,kq为双分子猝灭常数,c(Q)为猝灭体浓度,τ0为猝灭体不存在时荧光体的荧光寿命,τ0=1ns,kq为Stern-Volmer常数,以F0/F-1对c(Q)作图,结果如图2。

图2 BSA的荧光强度Fo/F-1与青霉素的Stern-Volmer
根据图2可得青霉素与BSA在281nm波长激发下的双分子猝灭常数kq=2.46×1012mol/L·s。此值远大于各种猝灭体对生物大分子的最大扩散碰撞猝灭常数2.0×1010mol/L.S[6],说明了此猝灭过程是由于荧光分子和猝灭剂之间形成不发光的基态配合物的结果,即发生了静态猝灭[7]。图3实验结果证明在281nm波长激发下,BSA的荧光峰位在328nm,随着青霉素浓度的增加,BSA的荧光强度有了不同程度的猝灭,而且BSA的荧光峰位没有发生改变,所以初步确定加入药物后,BSA的结构基本上没有发生变化。由此推测,此猝灭过程可能是由于青霉素与BSA形成了缔合物而引起的静态猝灭,也就是说此猝灭过程是由于药物与BSA在基态时生成了复合物,从而导致BSA的荧光强度猝灭。
自上而下青霉素的浓度分别为0,3.34×10-5,6.68×10-5,1.002×10-4,1,336×10-4,1.670×10-4,2.004×10-4,2.338×10-4,2.672×10-4,3.006×10-4,3.340×10-4mol/L。
根据方程[8]:

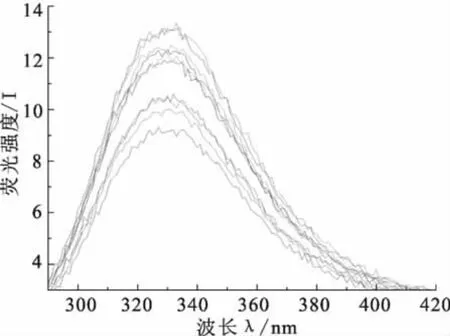
图3 青霉素对BSA的荧光猝灭
以(F0/F0-F)-1对1/c(Q)作 Lineweaver-Burk双倒数图(如图4),直线斜率即为青霉素与BSA在281nm激发下的结合常数k=3.347×10-3(K/mol)。

图4 BSA的荧光强度与青霉素的双倒数
3 结论
利用荧光光谱分析技术研究了青霉素和牛血清白蛋白相互作用机制,根据Lineweave-Burk双倒数图,求出了在281nm波长激发下青霉素与BSA作用的结合常数k=3.347X10-3K/mol;依据Stern-Volmer方程,以F0/F-1对c(Q)作图,求出了在281nm波长激发下青霉素与BSA作用的双分子猝灭常数kq,kq=2.46×1012mol/L·s。
[1]闵青民.几种药物小分子与生物大分子相互作用的研究[D].南昌:南昌大学,2007.
[2]谢余寰.酚酸类及生物碱类药物小分子和牛血清蛋白相互作用研究[D].南宁:广西师范大学,2008.
[3]王志龙,颜承农,梅平,等.甲氧化物的同步增敏荧光光谱分析法研究[J].分析测试学报,2005,24(6):59-61.
[4]张霞.几种药物小分子与牛血清白蛋白相互作用的光谱法研究[D].南昌:南昌大学,2007.
[5]陈鸿琪,夏闽.荧光染料哑啶红作测定蛋白质的生物探针[J].理化检验:化学分册,2001,37(2):53.
[6]范成平.喹诺酮药物与牛乳铁蛋白、人血清蛋白的相互作用机制研究[D].杭州:浙江大学,2005.
[7]许金钩,王尊本.荧光分析法(第三版)[M].北京:科学出版社,2006:4-69.
[8]王亚俐,王海芳.光谱法研究苯甲酸钠与牛血清白蛋白的作用[J].北京大学学报,2002,38(2):159-163.
