乳腺癌新辅助化疗前后动态增强MRI半定量
2011-07-24邹丽萍耿道颖
尹 波 刘 莉 邹丽萍 耿道颖
合理地使用新辅助化疗 (neoadjuvant chemotherapy,NAC)可以降低乳腺癌的级别,不仅可以使部分患者达到实施保乳手术的目的,还可以提高部分患者的预后[1]。通过对化疗疗效的评价可以观察患者对治疗的反应,决定化疗和手术的方案。动态增强(dynamic contrast enhanced,DCE)MRI与肿瘤中血管分布、血管渗透性、间质内压力和血管外间隙几个因素有关,反映的是肿瘤内的血管情况。本研究通过动态增强MRI血流动力学半定量参数的变化,研究新辅助化疗前后乳腺癌的血流变化特点。
方 法
1.临床资料
华山医院2008年7月~2010年1月收治并经评价适宜新辅助化疗的女性乳腺癌患者26例,年龄34~70岁,平均55.2岁。排除标准:妊娠期或哺乳期妇女、不能接受MRI检查者、不能按方案进行治疗、依从性差者、化疗后没有手术治疗者、没有完成化疗前后MRI扫描者。
2.方法
2.1 化疗方案:所有患者的新辅助化疗都从穿刺活检病理确诊后1~2d后开始。26例患者中,14例选择CET(环磷酰胺800mg/m2、表阿霉素110mg/m2、紫杉醇270mg/m2)方案4个周期,12例患者使用选择CET方案三个周期。其中3例增加右丙亚胺1000mg/m2。化疗结束后,26例均成功施行乳腺癌改良根治术。
2.2 影像学检查及图像处理方法:
(1)MRI检查方案:患者在化疗及穿刺前进行基线扫描,在化疗结束后,进行第二次MRI扫描,手术时间与化疗后乳腺MRI检查间隔1~7d,平均3.4d。
(2)扫描参数:采用GE Signa1.5T双梯度MRI扫描,患者呈俯卧位,为防止患者移动使用机器自带绑带将患者固定,双侧乳腺自然垂放置于4通道相控阵乳腺表面线圈。扫描包括:常规横断位FSE T1WI(T R/TE:675ms/11.5ms;FOV:34cm;NEX:2;层厚4mm;间隔1mm),矢状位压脂T2WI(T R/TE:3800ms/85ms;FOV:23cm;NEX:2;层厚 4mm;间隔1mm),横断位STIR(T R/TE:5000ms/42ms;FOV:34cm;NEX:2;层厚4mm;间隔1mm),最后动态增强3D FSE序列扫描,(T R/TE:5.4ms/2.8msFOV:34cm;NEX:0.8;层厚:3mm;间隔:0mm),每个动态时相采集52s,共采集9个时相。动态增强前先扫描蒙片,然后用高压注射器通过肘静脉团注钆喷葡胺(商品名:马根维显,Magnevist),0.2mmol/kg,随后团注20ml生理盐水,速度3ml/s,注射结束后立即动态增强扫描。
(3)图像处理与分析:影像图像由2名有经验的放射科医生分析,医生不知道病理结果。图像的后处理通过AW4.3工作站,将动态增强的图像及蒙片放入FunctoolSER软件处理。
时间-信号强度曲线 (time-signal intensity curve,TIC)采用感兴趣区法,选择强化最显著区域,感兴趣区要大于三个像素,同时避开血管和病灶坏死区。对于化疗后强化不明显的病灶,参照化疗前的图像,选择原发病灶的区域进行测量。
半定量血流参数计算参照王丽等[2]提供的方法如下。
1)早期强化参数,包括:①首过强化率(Efirst)=(Ifirst-Ipre)×100%/Ipre;②首过强化速率(Vfirst)=(Ifirst-Ipre)/T 1;③早期强化率(Ee)=(Ie-Ipre)×100%/Ipre;④早期强化速率(Ve)=(Ie-Ipre)/Te。
2)峰值参数,包括:①最大强化率 (Emax)=(Imax-Ipre)×100%/Ipre;②最大强化速率(Vmax)=(Imax-Ipre)/(T max-Tpre);③最大强化斜率(Slopmax)=(S2-S1)/t;④达峰时间 ( Tmax)=Tmax-Tpre,取TIC最高点的时间。
3)流出参数,包括:①最大排泄率(Ewash)=(Imax-Ilast)×100%/Imax;②最大排泄速率(Vwash)=(Imax-Ilast)/(Twash-Tmax)。
Ifirst:增强后第一个序列,即52s时的信号值,Ipre:增强前的信号值;Ie:增强后第二个序列即104s的信号值,Te:增强后 104s。Imax:增强后时间-信号曲线达最高峰值的信号值,Ipre:增强前的信号值,Tmax:增强后时间-信号曲线达最高峰值的时间;Tpre:增强前时间。Ilast:第9个序列的信号值,Imax:增强后时间-信号曲线达最高峰值的信号值,Tmax:增强后时间-信号曲线达最高峰值的时间;Twash:第 9个序列的扫描时间。S2、S1分别为信号上升最快的两点信号强度。
3.统计学方法
动态增强各种参数化疗前后的变化使用配对t检验。所有统计学分析采用SPSS 11.5版本,P<0.05认为是有明显差异。
结 果
1.化疗前后的半定量血流参数变化
观察26例新辅助化疗患者化疗前后的血流参数发现,化疗前早期强化参数Efirst、Vfirst、Ee、Ve的均值大于化疗后残留病灶的均值 (两者之间的差异有统计学意义,P<0.05)(表1)。
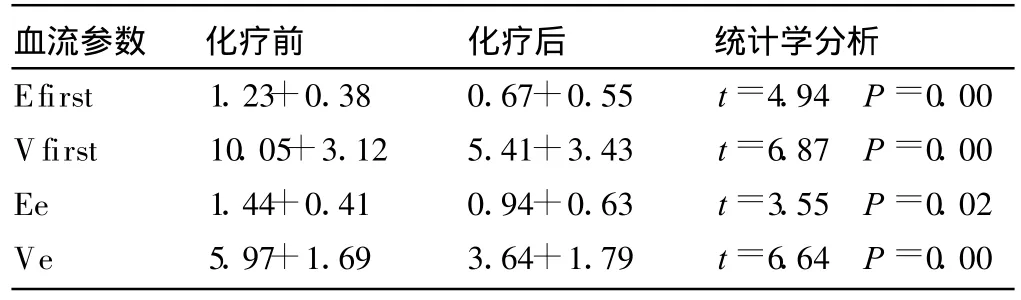
表1 新辅助化疗前后DCE-MRI早期强化参数对比
新辅助化疗前后DCE-MRI峰值强化参数对比发现,化疗前Emax、Vmax、Slopemax等参数的均值大于化疗后残留病灶的均值,化疗前T max的均值小于化疗后的均值 (两者之间的差异有统计学意义,P<0.05)(表2)。
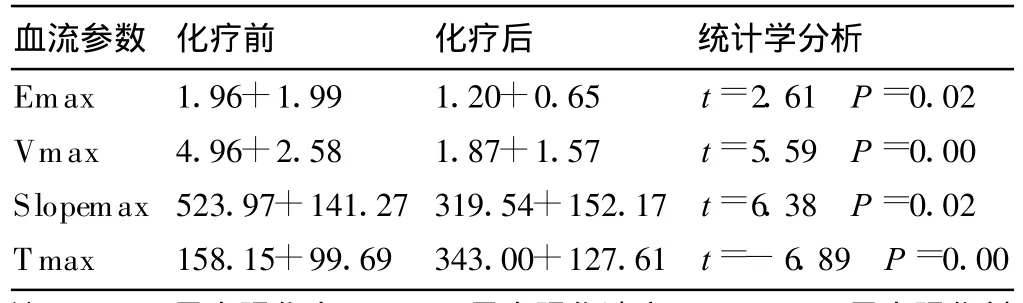
表2 新辅助化疗前后DCE-MRI峰值强化参数对比
新辅助化疗前后DCE-MRI流出参数对比发现,Ewash、Vwash的均值高于化疗后的残留病灶的均值(两者之间的差异有统计学意义,P<0.05)(表3)。
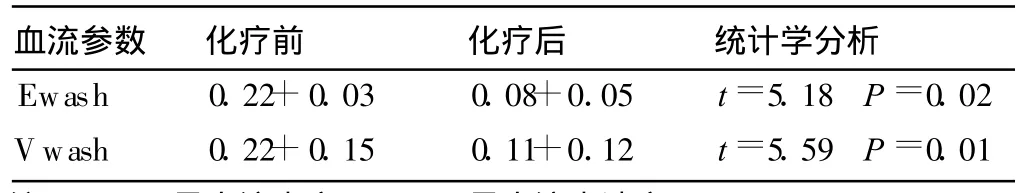
表3 新辅助化疗前后DCE-MRI流出参数对比
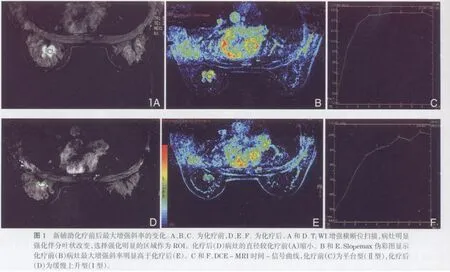
讨 论
新辅助化疗开始于1970年代,目前已经成为局部进展期乳腺癌的标准治疗方法。新辅助化疗可以使部分患者降低乳腺癌的级别,使不可以手术的患者得到手术的机会甚至是可以实施保乳手术。不能手术的患者经新辅助化疗后可以明显延长复发期,对新辅助化疗反应好,尤其是达病理完全缓解者,经新辅助化疗后生存率明显提高[3]。
在肿瘤化疗的评价体系中,主要包括了临床评价、影像学评价和病理学评价。虽然病理学评价可直接观察到化疗后瘤细胞数量的变化,肿瘤细胞变性、坏死及是否消失,但是因为评价要在术后或通过活检,并且存在滞后性和创伤性。近年来随着影像学的发展,特别是MRI和PET的发展,对传统的影像学评价体系注入了新鲜的血液。MRI具有软组织分辨率及诊断敏感度高的优势,目前血流动力学在新辅助化疗前后的变化特点日益成为研究的热点。
由于乳腺癌释放血管生成因子,如血管内皮生长因子(VEGF),诱导新生血管的生成及现存血管的增生,这种病理毛细血管的平均血管直径增大,毛细血管壁薄,缺乏外膜细胞,基底膜的生化成分增加其通透性;导致病灶局部血流量增加的同时血管的渗透速度加快,最终导致对比剂在病灶局部的迅速浓集和渗出。乳腺癌毛细血管结构的异常,特别是动静脉短路也是导致局部血流加快的因素[4]。乳腺MRI动态增强通过静脉注入对比剂在乳腺产生对比增强来发现病变和对病变的特征进行描述。TIC是反映组织微血管密度和血管通透性的指标,对病变的良恶性判断有重要价值。Kuhl等[5]研究表明,MRI动态增强曲线中,流入型曲线中约6%为恶性病灶,平台型曲线中约64%为恶性病灶,流出型中约87%为恶性病灶。
动态增强曲线包括上升段、峰值点和下降段。动态增强曲线的上升段代表了病灶对顺磁性对比剂的摄取期,峰值点代表摄取与排泄的平衡点,下降段代表排泄期,本研究的血流动力学半定量参数分别量化此三段的强化过程[2]。研究表明良、恶性病灶的早期强化率与MVD具有较好的相关性,而且越到峰值点其相关性越高,即TIC峰值点的参数最能反映病灶内微血管的多少[2]。
本组病例中,化疗前早期强化参数Efirst、Vfirst、Ee、Ve等的均值大于化疗后的残留病灶(两者之间的差异有统计学意义,P<0.05),主要是因为化疗前病灶的微血管密度高于化疗后,因此化疗前病灶的早期强化参数高于化疗后。
新辅助化疗前后峰值强化参数对比发现,化疗前E-max、Vmax、Slopemax等参数的均值大于化疗后残留病灶的均值,化疗前Tmax的均值小于化疗后的均值(两者之间的差异有统计学意义,P<0.05)。国内研究表明,乳腺恶性病变的早期强化参数、峰值参数及流出参数均与MVD有相关性,其中Efir st、Ee、Emax、Vmax、Ewash、Vwash与MVD呈显著性正相关(P<0.01),而 Tmax呈显著性负相关(P<0.01)[2]。化疗后微血管密度的降低可能是导致该变化的主要原因,同时新辅助化疗前的达峰时间(Tmax)比化疗后明显缩短,这进一步说明化疗前肿瘤丰富的毛细血管网造成对比剂迅速地渗漏与吸收,较化疗后病灶更早地到达灌注与渗漏的饱和点,形成动静脉短路[2]。
新辅助化疗前后DCE-MRI流出参数对比发现,Ewash、Vwash的值高于化疗后的残留病灶(两者之间的比较有统计学意义,P<0.05)。本研究的E-wash和Vwash分别量化了TIC下降段的强化程度及斜率。除了化疗前微血管密度高以外,化疗前的微血管不成熟,导致对比剂渗透性增加,回吸收对比剂的量及速度快,导致其快速排泄,这可能是化疗前流出参数高于化疗后的原因。
血管生成是实体肿瘤生长和转移的必要条件,肿瘤组织内新生血管数量越多,则肿瘤细胞增殖越快,转移潜力越大,而微血管密度正是反映肿瘤组织新生血管形成的最为直观的指标[4]。张国淳等[6]研究表明,新辅助化疗后乳腺癌的微血管密度较化疗前明显降低。Rieber等[7]在新辅助化疗前后对乳腺癌患者进行MRI动态增强扫描,化疗无效组对比剂的吸收率增加或轻度降低,而部分有效组和完全有效组病灶的吸收率有明显的降低,两者之间的差别有明显统计学意义,考虑到肿瘤的血管生成和肿瘤对新辅助化疗反应的直接相关性,因此,Rieber等[7]认为乳腺癌动态增强对比剂吸收率的变化不仅可以评价疗效,同时可能和患者的预后有相关性。同时Yu等[8]研究表明,化疗一个疗程后,最终有效组MRI血流动力学参数Ktrans(流入指数)和Kep(流出指数)的值较无疗效组有明显减少,特别是Kep变化明显,认为血流动力学参数的减少和乳腺癌新辅助化疗疗效之间有非常好的相关性。Wasser等[9]发现动态增强参数在化疗药物作用后有不同程度的降低,在肿瘤消退明显的病例降低更显著。
总之,新辅助化疗前后DCE-MRI的血流动力学出现变化,半定量参数显示血流流入及流出的速率明显减小,为进一步研究与疗效的相关性打下基础。
1.Von MG,Costa SD,Eiermonn W,et al.Maximized reduction of primarybreast tumor size using preoperative chemotherapywith doxorubicin and Docetaxel.J Clin Oncol,1999,17:1999-2005
2.王 丽,翟仁友,蒋 涛,等 . 乳腺疾病动态增强MRI半定量参数与微血管密度的相关性.中国医学影像技术,2007,23:388-392
3.Bonadonna G,Valagussa P,Brambilla C,et al.Primarychemother-apy in operable breast cancer:eight-year experience at the Milan Cancer Institute.J Clin Oncol,1998,16:93-100
4.Toj M.Tumor angiogenesis in breast cancer.its importance as a prognostic indicator and the association with vascular endothelial growth factor expression.Breast Cancer Res Treat,1995,36:193-204
5.Kuhl CK,Mideareck P,Klaschik S,et al.Dynamic breast MR imaging:Aresignal intensitytime course data useful for differential diagnosis of enhancinglesions.Radiology,1999,211:101-110
6.张国淳,王深明,吴惠茜 . 新辅助化疗对乳腺癌细胞增殖微血管密度和组织学分级的影响.中国实用外科杂志,2003,23:617-619
7.Rieber A,Brambs HJ,Gabelmann A,et al.Breast MRI for monitoringresponse ofprimarybreast cancer to neo-adjuvant chemotherapy.Eur Radiol,2002,12:1711-1719
8.Yu HJ,Chen JH,Mehta RS,et al.MRI Measurements of tumor size and pharmacokinetic parameters as early predictors of response in breast cancerpatients undergoingneoadjuvant anthracycline chemotherapy.J Magn Reson Imaging,2007,26:615-623
9.Wasser K,Klein SK,Fink C,et al.Evaluation of neoadjuvant chemothe-rapeutic response of breast cancer using dynamic MRI with high temporal resolution.Eur Radiol,2003,13:80-87
