斜纹夜蛾核多角体病毒感染甜菜夜蛾细胞的研究*
2011-07-24余倩
余 倩
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225 2.中山大学有害生物控制与资源利用国家重点实验室,广东 广州 510275)
杆状病毒是一类节肢动物专一性的病毒,它们带有杆状的核衣壳,基因组是由大小约为80~180 kb双链环状DNA所构成[1]。杆状病毒的宿主范围窄,大部分杆状病毒只能感染几种昆虫甚至是专一性的一种。
杆状病毒生活周期主要分为以下几步:进入细胞、早期基因表达、DNA的复制、晚期基因表达、极晚期基因表达、芽生型病毒(budded virus, BV)的组装和释放、核多角体蛋白包含体(occlusion-derived virus, ODV)的形成。
斜纹夜蛾核多角体病毒(Spodopteralituranucleopolyhedrovirus,SpltNPV)和甜菜夜蛾核多角体病毒(Spodopteraexiguamultiple nucleopolyhedrovirus,SeMNPV)的全基因组已完成测序[2-3],两者的基因组相似性程度高,经研究发现两者不能交叉感染各自宿主,SeMNPV感染SpLi-221细胞会引起细胞凋亡[4],而SpltNPV感染Se301细胞的研究还未见报导。为了了解SpltNPV感染Se301细胞的进程并寻找病毒感染失败的原因,本研究对SpltNPV感染后的Se301细胞进行了生化分析,发现病毒蛋白表达受阻是SpltNPV感染Se301细胞失败的主要原因。
1 材料与方法
1.1 材料
1.1.1 昆虫细胞与病毒 野生型SpltNPV中山大学分离株(ZSU strain)由本实验室保存。SeMNPV-SeUS1引自美国加州大学Riverside分校B.A.Federici教授实验室。甜菜夜蛾细胞Se301由荷兰Wageningen大学J.M.Vlak教授惠赠,用w=10 %胎牛血清的Grace′s培养基 (Invitrogen) 27 ℃培养。
1.1.2 供试昆虫 斜纹夜蛾、甜菜夜蛾幼虫由本实验室养虫室提供,为人工饲料饲养的健康幼虫。人工饲料配方见参考资料[5],饲养温度 27~28 ℃。
1.2 方法
1.2.1 病毒多角体扩增 将病毒多角体涂布于人工饲料表面喂饲感染4龄初的昆虫幼虫,感染4~5 d后收集呈现典型病毒感染症状的幼虫(虫体倒挂,身体肿胀,呈灰白色),置室温下静置2至3天让其自然发酵(病毒进一步成熟和虫体进一步液化)。用10倍的PBS悬浮发酵的虫尸,经四层纱布过滤,滤液经3 000 r/min离心10 min,沉淀物重悬于适量PBS中,600 r/min离心5 min,收集上清。如此重复3~4次,直至多角体悬浮液呈乳白色,光学显微镜检查在多角体悬液中杂质很少,即为较纯的病毒多角体。
1.2.2 病虫血淋巴制备 用多角体喂饲感染四龄初昆虫幼虫,感染3 d后经镜检有极少量多角体出现即取血淋巴。用φ=70 %乙醇将病虫表面消毒,剪开腹足,血淋巴滴入含w=0.1 %苯基硫脲的Grace′s 培养基中,3 000 r/min离心10 min,除去血淋巴细胞,取上清经过滤灭菌保存,供细胞感染用。
1.2.3 在离体培养细胞中增殖病毒 吸尽单层培养细胞中培养液,按感染复数(MOI)大约为1的接种量接种病毒血淋巴,室温吸附1 h,吸弃病毒液,以无抗生素无血清Grace′s培养基洗2次,然后加入新鲜Grace′s培养基,27 ℃培养72 h~96 h左右,收集细胞上清,4 ℃保存备用。
1.2.4SpltNPV 病毒感染细胞 在35 mm培养皿中以0.5×106个细胞/孔密度接种对数生长期的Se301细胞;贴壁1 h后,移出培养基,SpltNPV病毒以MOI为1感染细胞,27 ℃培养1 h并间隔摇动培养板;1 h后弃感染液,以无抗生素无血清Grace′s培养基洗2次,然后加入Grace′s培养基继续培养,加入病毒即开始计时,于感染后不同时间收集取样,3 000 r/min离心10 min,弃上清,细胞沉淀先放入液氮速冻30 min,再放入-70 ℃保存备用。
1.2.5 Dot Blotting 收取感染后细胞样品提取总DNA融于8 mmol/L NaOH,调整至终浓度100 μg/mL,测定吸光度。每个样品取10 μL,100 ℃煮5 min,冰上迅速冷却。于Dot Blotting装置上点样转膜。方法参照Bio-Dot SF Microfiltration Apparatus(Bio-Rad, Inc)操作手册。主要步骤包括:DNA固定,探针制备和标记,地高辛杂交,杂交后洗膜,检测和颜色反应。
1.2.6 RT-PCR RT-PCR反应按TaKaRa RNA PCR Kit(AMV)Ver.3.0操作手册进行。 取反应液5 μL进行凝胶电泳,确认反应产物。以RNA为模板进行PCR扩增,以检测模板是否存在DNA污染。所用引物序列见表1,引物由上海英骏生物工程公司合成。
1.2.7 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE) 收集细胞上清,加等量的2×蛋白上样缓冲液,于沸水中煮5~10 min,按常规方法在Bio-Rad小型蛋白电泳仪上进行恒流电泳。电泳结束后,用考马斯亮蓝染色后用脱色液进行脱色,观察蛋白带型。
1.2.8 Western blotting 收集病毒感染后细胞,PBS缓冲液洗2次,细胞裂解后进行蛋白电泳,转膜,蛋白封闭,以制备的POLYHEDRIN多克隆抗体为一抗1∶500稀释后进行western blotting检测,观察蛋白表达情况。

表1 PCR扩增所用引物
2 结 果
2.1 SpltNPV感染Se301细胞后DNA复制情况
本实验室研究发现SpltNPV不能成功感染Se301细胞,而是诱导Se301细胞产生凋亡(资料未显示)。为研究SpltNPV在Se301凋亡细胞中的感染进程以及病毒感染失败的原因,首先进行dot blotting分析检测病毒复制,正常Se301样品为阴性对照,SpltNPV感染SpLi-221细胞为阳性对照,杂交探针为DIG标记的病毒polyhedrin基因(polyhedrin-dig), 标准样品(Marker)为polyhedrin的PCR产物。检测结果显示:阳性对照样品在感染后12 h能检测到有病毒复制,且随着时间的延长病毒量越来越多;SpltNPV感染Se301细胞样品中从12 ~72 h也能检测到病毒复制,但病毒复制的速度明显低于SpltNPV感染SpLi-221细胞的复制速度,此结果说明SpltNPV感染Se301细胞后完成了病毒的复制但复制速度受到一定影响。

图1 SpltNPV感染SpLi-221或Se301细胞的Dot blotting分析
2.2 SpltNPV在Se301细胞中的转录时相
病毒基因的转录分为极早期、早期、晚期和极晚期。极早期基因在感染后1h就能检测到转录,感染后6 h之前转录的基因为早期基因,而感染后6h之后转录的基因为晚期基因,且感染后12 h之后转录的基因为极晚期基因。SpltNPV病毒在Se301细胞中进行了病毒的复制,可以推测病毒的早期基因应该进行了转录表达,下一步需了解病毒的晚期基因是否得到了转录及表达,从而可进一步验证早期基因是否得到了转录和表达,现采取RT-PCR分析病毒在Se301细胞中的基因转录情况。设计3对引物以SpltNPV基因组为模板进行PCR反应,首先需鉴定引物是否正确(图2),结果显示3对引物都能扩增出相应大小的条带,说明设计引物无误。

图2 ieo、DNA polymerase、chitnase基因的PCR扩增产物
为确定SpltNPV病毒在Se301细胞中是否完成了转录,以及各基因的转录时间与SpltNPV病毒在受纳细胞SpLi-221细胞中的转录时间是否一致,进行病毒基因的转录时相分析。结果如图3显示:SpltNPV感染Se301细胞1 h后能检测到很微弱的ieo转录本,从4 h至48 h均能检测到ie0的强转录本;DNApolymerase基因从6~48 h能检测到强转录本;从8~48 h能检测到chitnase的强转录本。总的来讲,SpltNPV感染Se301细胞的基因转录时相与SpltNPV感染SpLi-221细胞的基因转录时相基本一致,只是极早期基因ie0至晚期也有转录。
2.3 SpltNPV在Se301细胞中的蛋白表达
SpltNPV感染Se301细胞后病毒的所有基因都得到了转录,病毒蛋白的表达情况又如何?采取SDS-PAGE和Western blotting分析检测病毒感染Se301细胞后其蛋白的表达情况。由于光镜观察SpltNPV感染Se301细胞48 h时有明显病理症状(资料未显示),所以收取Se301细胞样品和SpltNPV感染Se301细胞48 h样品进行SDS-PAGE分析比较;Se301细胞为SpltNPV的非受纳细胞,感染进程可能与SpltNPV感染受纳细胞SpLi-221不同,所以收取SpltNPV感染SpLi-221细胞24、48和72 h (图4所示)样品与SpltNPV感染Se301细胞48 h样品进行SDS-PAGE分析比较。结果显示:SpltNPV感染SpLi-221细胞无论在24、48和72 h样品中很明显都有一条29 700的POLYHEDRIN条带,且总蛋白表达条带在24、48和72 h没有明显区别;而正常的Se301细胞和SpltNPV感染Se301细胞48 h样品中没有此条带;对正常Se301细胞和SpltNPV感染Se301细胞48 h样品的总蛋白带型进行比较,观察不到蛋白带型明显的区别。所以SpltNPV感染Se301细胞后蛋白表达受到了一定程度的限制,极晚期基因polyhedrin的表达受阻。

图3 RT-PCR分析ieo、DNA polymerase、 chitnase基因的转录
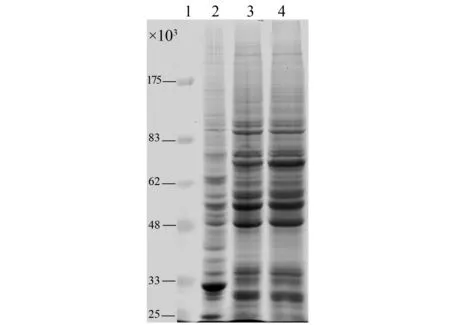
图4 SpltNPV感染Se301细胞SDS-PAGE分析
用极晚期基因polyhedrin的多克隆抗体对SpltNPV感染Se301细胞24、48、72 h样品进行Western blotting分析,结果如图5表明细胞被感染24,48,72 h极晚期基因polyhedrin没有表达。总的来讲SpltNPV感染Se301细胞后其蛋白表达受阻,以至于不能完成整个的病毒复制。

图5 SpltNPV感染Se301细胞polyhedrin基因Western blotting分析
3 讨 论
SpltNPV和SeMNPV基因组相似性很高,但这两种病毒不能交叉感染各自宿主。先前研究表明细胞凋亡是限制杆状病毒感染昆虫的主要原因之一,早有关于杆状病毒诱导细胞凋亡从而导致病毒感染失败的报导,如HycuNPV诱导的Ld652Y细胞凋亡[6];HaSNPV诱导的Hi5和s1-zsu-1细胞凋亡[7-8];SeMNPV感染SpLi-221细胞会引起细胞凋亡;SpltNPV感染Se昆虫也可诱导昆虫体液细胞凋亡[9],且本实验室研究发现SpltNPV感染Se301细胞也诱导了细胞凋亡。
杆状病毒生活周期主要分为以下几步:进入细胞、早期基因表达、DNA的复制、晚期基因表达、极晚期基因表达、BV的组装和释放、核多角体蛋白包含体的形成。SpltNPV不能成功感染Se301细胞产生子代病毒,即Se301细胞为SpltNPV的非受纳细胞。
研究显示SpltNPV感染Se301细胞后病毒完成了整个DNA复制过程,但DNA复制量明显低于SpltNPV感染其原宿主细胞SpLi-221细胞的DNA复制量,分析其原因可能是由于病毒感染其非受纳宿主细胞感染进程受阻。DNA复制之前是病毒早期基因的表达,研究证实杆状病毒诱导的凋亡可由感染早期的事件所引起[10],先前研究表明病毒的极早期基因ie1能引起由AcMNPV诱导的Sf21细胞凋亡[11]。 本研究中ie0基因的表达也可能会引起细胞凋亡,使得大部分病毒感染失败,只有少量病毒能完成DNA复制,所以观察到病毒感染受纳和非受纳细胞DNA复制速度不同。
病毒转录时相分析结果表明病毒的所有基因都完成了转录,且早期基因和晚期基因的转录时相与SpltNPV感染其原宿主的转录时相一致,符合杆状病毒感染其原宿主的一般转录时相规律,但实验中发现极早期基因ie0的转录在1 h时较正常原宿主感染量弱,且基因转录延迟到了感染后期即24 h以后。一般的极早期基因转录只在感染的早期出现,到感染后期没有极早期基因的转录,可能由于病毒感染进程不一致,导致一部分病毒进入感染晚期而一部分病毒还处于其它感染阶段。
经检测Se301细胞与SpltNPV感染Se301细胞的总蛋白表达情况没有明显不同,且与SpltNPV感染SpLi-221细胞总蛋白表达进行比较,发现SpltNPV感染Se301细胞中无极晚期POLYHEDRIN蛋白的表达,Western blotting检测结果与上述结果一致,说明病毒的蛋白表达受到了一定程度的限制,极晚期基因的表达受阻。
综合以上分析结果,病毒进入细胞首先进行早期基因表达,可能因为早期基因的表达诱导了细胞凋亡,所以大部分病毒感染失败,只有少量病毒进行DNA复制和转录,DNA复制后病毒随即进行晚期或极晚期基因表达[12],由于某种未知原因,也可能是其它因素诱导了细胞发生凋亡,病毒晚期基因的表达受到抑制以至不能完成BV的装配和产生子代病毒。总的来说,病毒蛋白表达受阻是SpltNPV在Se301细胞中无法形成子代病毒,完成整个病毒复制的主要原因,本研究为深入研究其感染失败机理奠定了坚实基础。
致谢本研究在中山大学庞义教授和杨凯教授的指导和帮助下完成,谨以感谢。
参考文献:
[1]HERNIOU E A, OLSZEWSKI J A, CORY J S, et al.The genome sequence and evolution of baculoviruses [J].Annu Rev Entomol,2003,48:211-234.
[2]PANG Y, YU J, WANG L, et al.Sequence analysis of theSpodopteralituramulticapsid nucleopolyhedrovirus genome [J].Virology, 2001, 287: 391-404.
[3]IJKEL W F, VAN STRIEN E A, HELDENS J G, et al.Sequence and organization of theSpodopteraexiguamulticapsid nucleopolyhedrovirus genome [J].J Gen Virol, 1999, 80(12): 3289-3304.
[4]YANASE T, YASUNAGA C, KAWARABATA T.Replication ofSpodopteraexiguanucleopolyhedrovirus in permissive and non-permissive lepidopteran cell lines [J].Acta Virol, 1998, 42: 293-298.
[5]O'REILLY D R, MILLER L K, LUCKOW V A.Baculovirus Expression Vectors: a Laboratory Manual [M].New York: W H Freeman, 1992: 256-258.
[6]ISHIKAWA H, IKEDA M, YANAGIMOTO K, et al.Induction of apoptosis in an insect cell line, IPLB-Ld652Y, infected with nucleopolyhedroviruses [J].J Gen Virol, 2003, 84: 705-714.
[7]DAI X, SHI X, PANG Y,et al.Prevention of baculovirus-induced apoptosis of BTI-Tn-5B1-4 (Hi5) cells by thep35 gene ofTrichoplusianimulticapsid nucleopolyhedrovirus [J].J Gen Virol, 1999, 80(7): 1841-1845.
[8]庞义,代小江,施先宗,等.两种昆虫杆状病毒诱导的细胞凋亡[J].中山大学学报:自然科学版,1998,37(3):1-6.
[9]FENG G, YU Q, HU C, et al.Apoptosis is induced in the haemolymph and fat body ofSpodopteraexigualarvae upon oral inoculation withSpodopteralituranucleopolyhedrovirus[J].J Gen Virol, 2007, 88: 2185-2193.
[10]LACOUNT D J, FRIESEN P D.Role of early and late replication events in induction of apoptosis by baculoviruses [J].J Virol, 1997, 71: 1530-1537.
[11]PRIKHOD'KO E A, MILLER L K.Induction of apoptosis by baculovirus transactivator IE1 [J].J Virol, 1996, 70: 7116-7124.
[12]THIEM S M, MILLER L K.Identification, sequence, and transcriptional mapping of the major capsid protein gene of the baculovirusAutographacalifornicanuclear polyhedrosis virus [J].J Virol, 1989,63: 2008-2018.
