整合素素αⅤβ3受体显像剂18F标记RGD肽的研究进展
2011-07-18王立振
王立振,杨 敏
(江苏省原子医学研究所 卫生部核医学重点实验室 江苏省分子核医学重点实验室,江苏 无锡 214063)
癌症是全球第二大死因。虽然癌症的确切原因尚不清楚,但若能早期诊断,多数患者可以通过手术治疗、化疗、放疗或联合治疗而改善生存质量甚至延长生命。因此,准确的早期检测可以使原发灶在转移前得到适当的治疗[1]。
肿瘤的持续生长、侵袭转移与血管新生密切相关。血管新生是指毛细血管从已存在的血管周围生成的过程,它对肿瘤的生长和转移至关重要。无血管生长期肿瘤细胞的增殖速度与有血管肿瘤细胞的增殖速度并无差异,其细胞生存率与死亡率都会达到一个动态平衡,故肿瘤的体积保持在微小状态。研究表明,抑制血管新生可以使肿瘤停止生长甚至萎缩。与传统非靶向性化疗相比,抗血管新生治疗可选择性地作用于活化的内皮细胞和肿瘤细胞,因而更有优势。临床Ⅰ期和Ⅱ期试验表明,血管新生抑制剂可以有效减缓或阻止肿瘤的生长或转移[2-4]。
血管新生是一个复杂的过程,包括细胞、可溶性因子和细胞外基质(ECM)物质间的广泛作用。血管网络的生成需要经历不同步骤,首先活化血管内皮细胞释放出蛋白酶逐步降解周围已存在血管的基底膜,而后内皮细胞迁移入空隙,增殖并分化为成熟的血管。该过程受多种血管新生诱导因子调控。例如生长因子、趋化因子、血管新生酶、内皮细胞的特定受体以及粘附分子等。每一个过程都可能为诊断和治疗提供靶点[5]。
毛细血管细胞中的粘附分子——整合素αⅤβ3的表达及其与特异性基质配体如含精氨酸-甘氨酸-天冬氨酸 (Arg-Gly-Asp,RGD)的三肽等的相互作用在肿瘤血管新生和转移中起着关键作用。在血管新生过程中,内皮细胞表达的整合素调节细胞的迁移和生存。肿瘤细胞表达的整合素促进细胞侵袭和穿越血管壁,便于肿瘤转移。αⅤβ3整合素受体在活化的内皮细胞和肿瘤细胞中高度表达,但在正常的内皮细胞和多数正常组织中不表达,这为抗血管新生策略提供了潜在的靶点[6]。采用mAbs、环形RGD肽拮抗剂和模拟肽等抑制αⅤβ3整合素受体活性可以诱导内皮细胞凋亡、抑制血管新生并增加内皮单层的渗透性。多数动物实验表明,整合素αⅤβ3活性的抑制与肿瘤体积的缩小密切相关[7]。
由于所有实体瘤细胞(乳腺癌,前列腺癌、肺癌等)成瘤过程必然伴随着肿瘤新生血管生成,整合素αⅤβ3作为肿瘤发生、发展过程中的共有物质,具有一定的特异性,因此整合素αⅤβ3不仅是肿瘤治疗潜在的分子靶点,而且也是分子成像的特异靶点。无创、可视化且定量分析整合素αⅤβ3表达为确证肿瘤(肿瘤细胞和新生肿瘤血管)整合素水平,更恰当地选择适于抗血管新生治疗的病人以及监测疗效提供了新的契机[8]。Ellgela等利用靶向整合素αⅤβ3的微泡结合对比增强超声技术对肿瘤新生血管进行评价,观察到靶向性微泡更多地聚集在肿瘤微血管内,而在血管外几乎没有,非靶向性微泡则没有在微血管内聚集。Sipkin等在动物实验中证实使用MRI和抗体修饰的顺磁性脂质体可方便地对整合素αⅤβ3表达进行显像。近红外荧光染料共轭的环状RGD肽能显示模型鼠皮下接种的整合素阳性肿瘤。上述方法可对肿瘤周围及内部的新生血管进行非侵入性检测,从而间接诊断肿瘤,但这些方法均存在着灵敏度低的缺陷[9]。
目前,放 射 性 核 素 (18F、64Cu、68Ga、86Y、125I、99Tcm和111In等)标记的靶向整合素αⅤβ3的RGD肽类核素显像(SPECT或PET)探针是研究的热点。与SPECT相比,PET的灵敏度和分辨率更高。18F具有接近100%的正电子效率,低正电子能量(0.64MeV)和相对较短的物理半衰期(t1/2=109.7min)等特点,是理想的多肽标记和 PET 显像核素[10]。本文拟对18F标记的RGD肽类分子探针在肿瘤整合素αⅤβ3受体PET显像中的研究进展作简要综述。
1 18F-Galacto-RGD
Haubner等[11]最初对环状RGD五肽单体(-Arg-Gly-Asp-dTyr-Val-,c(RGDyV))进 行了125I标记。在检测裸鼠体内M21黑色素瘤、MaCaF乳腺癌和骨肉瘤的实验中发现,静脉注射探针10min后,虽然探针能聚集于肿瘤组织中,但其在肿瘤中快速清除,且在肝组织中滞留时间过长,不适用于临床。
RGD肽的乳糖化降低了RGD肽的亲脂性并相应地减小了肝的摄取。采用辅基18F-氟丙酸对相应肽进行18F标记,可得到探针18F-Galacto-RGD[12],其化学结构示于图1。M21黑色素瘤移植瘤模型表明,整合素αⅤβ3阳性肿瘤对18F-Galacto-RGD特异性摄取[13],注射120min后,肿瘤与血的放射性摄取比(T/NT)为27.5;肿瘤与肌肉的 T/NT为10.2。18F-Galacto-RGD成为第1个非侵入的整合素αⅤβ3靶向示踪剂用于PET成像。对癌症患者进行的临床试验[14,15]表明,该示踪剂安全且能够特异性识别整合素αⅤβ3阳性肿瘤组织,并有很好的肿瘤与正常组织的靶本比。动态模型评估分布容积值发现,在肿瘤组织中整合素受体浓度是正常组织的4倍[16]。Beer等[17-19]对16名乳腺癌患者(12个原 发 灶 和 4 个 转 移 灶 )行18F-Galacto-RGD PET显像,结果表明,该示踪剂能确定所有侵袭性病灶。11名头颈部肿瘤患者行18F-Galacto-RGDPET显像,12个病灶中有10个显示放射性浓聚,2个无明显摄取。病理学分析证实,无放射性摄取的疑似肿瘤病灶为浅表性病变。19例实体瘤患者(骨骼肌肉系统肿瘤10例、黑色素瘤4例、头颈部肿瘤2例、胶质瘤2例、乳腺癌1例)术前行PET扫描,17个18F-Galacto-RGD 摄取显著的病灶为恶性,另2个良性病灶无显著放射性摄取。
除了对肿瘤进行诊断和鉴别外,18F-Galacto-RGD在选择适宜抗血管新生治疗的病人和评价相应的疗效上也具有潜力。Schnell等[20]对12名疑似或治疗后复发的恶性脑胶质瘤患者行18F-Galacto-RGD PET 显 像,结 合 活 检 发现,18F-Galacto-RGD在肿瘤高度增殖和浸润的部位浓聚,但在坏死部位摄取不显著。Beer等[21]对化 疗的肺癌患者同 期行18F-FDG 和18FGalacto-RGD PET显像。治疗开始两个星期后,肿瘤糖代谢无显著变化,但肿瘤对18F-Galacto-RGD的摄取减少了20%。

图1 18F-Galacto-RGD的化学结构
2 18F-Fluciclatide
鉴于多数肽在体内快速降解且在血浆中半衰期较短的特点,GE Health公司[22]对源于噬菌体肽库的RGD类肽(ACDCRGDCFCG)进行了结构修饰,引入多个二硫键并进行环化,所得产 物18F-Fluciclatide(18F-AH111585,其 化 学 结构示于图2)在体内稳定。反相 HPLC测定[23]表明,静脉注射60min后,人血浆中18F-Fluciclatide原型药的比例为74.48%±3.18%。健康志愿者显像表明,18F-Fluciclatide安全性好,适于临床使用。18F-Fluciclatide在血液和正常组织中快速清除,且主要通过肾脏排泄。18F-Fluciclatide的有效辐照剂量为26μSv/MBq,与常用的18F标记PET示踪剂如18F-FDG相当[24]。
Kenny等[23]对7名乳腺癌患者共18个转移病灶行18F-flucilatde PET 显像,结果表明,所有病灶均可检出。原发灶和转移灶与正常组织和血液的摄取比值显著。肺、骨、淋巴结等处的转移瘤均表现为高信号。
模型 鼠 实 验 表 明,18F-Fluciclatide PET 显像较传统疗效评价模式如肿瘤体积检测等可以更早期地监测抗血管新生药物的疗效。Battle等[25]对荷人胶质瘤 U87-MG裸鼠行Sunitinib治疗,测量肿瘤体积并定期行18F-Flucilatde小动物PET显像。治疗2天后,肿瘤对示踪剂的摄取显著下降,提示血管新生受到抑制。而肿瘤体积在治疗7天后才呈下降趋势。Morrison等[26]采用18F-Flucilatde监测了 VEGF-2抑制剂ZD4190在人肺癌Calu-6移植瘤上的疗效,同期行14C-FDG比较。结果显示:3种剂量ZD4190治疗下,肿瘤对18F-Flucilatde的摄取较空白对照组显著减小,且与肿瘤微血管密度(MVD)变化显著相关,而同期14C-FDG摄取无明显改变,提示肿瘤18F-Fluciclatide摄取值对 ZD4190治疗敏感。
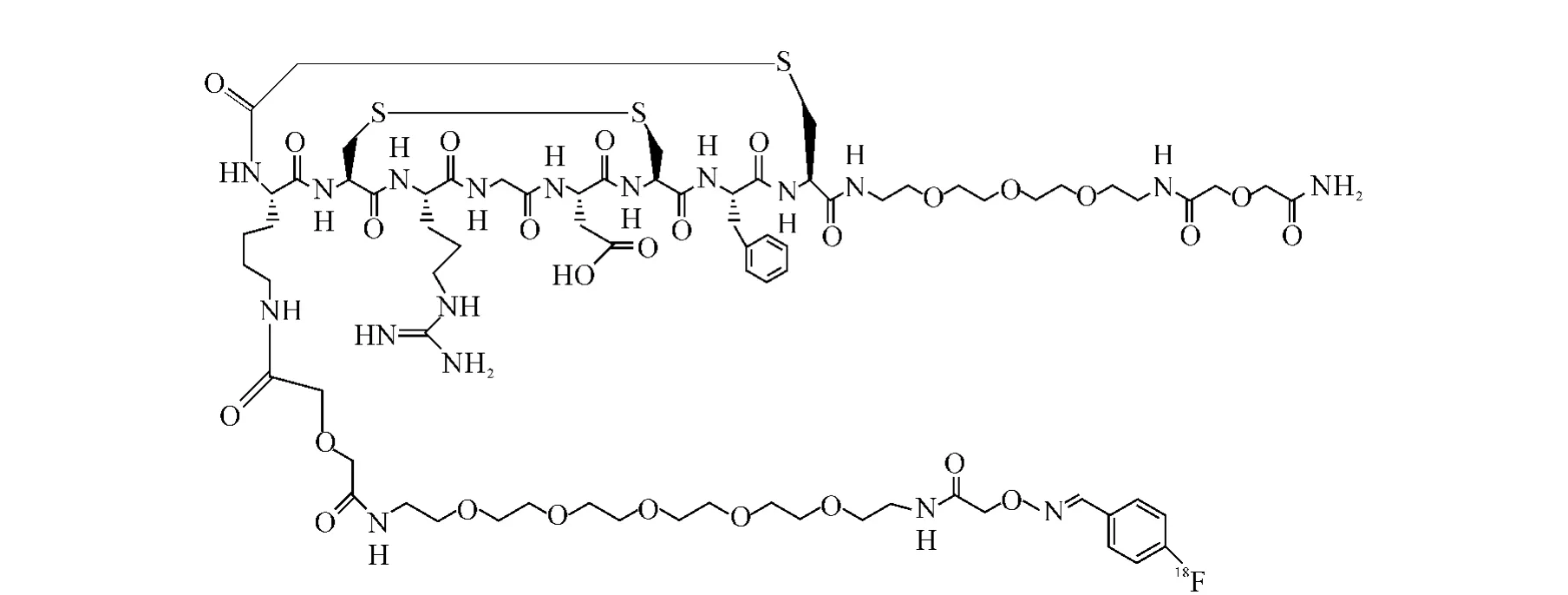
图2 18F-Fluciclatide(18F-AH111585)的化学结构
3 18F-FP-PRGD2
18F标 记 RGD 肽 单 体 示 踪 剂 (18F-galacto-RGD,18F-AH111585等)虽可与某些肿瘤细胞表面的整合素αⅤβ3受体结合,但有时也存在着亲和力和肿瘤摄取值偏低等缺陷[27]。为了增强肿瘤靶向性,同时获得更好的体内显像特性,Chen等利用谷氨酸将环RGD五肽单元进行连接,研发RGD肽二聚体和多聚体。与相应的单体相比,RGD肽二聚体和受体的亲和力几乎增加了一个数量级。研究[28]证实,多聚化如RGD肽八聚体和四聚体虽较二聚体增加受体亲和力,但在体内的本底值也相应升高。因此,RGD肽二聚体引起了人们更多的关注。Wu等[29]通过体外细胞结合实验和体内定量microPET成像研究发现,二聚体18F-FRGD2(18F-FB-E[c(RGDyK)]2)比单体18F-FRGD(18F-FB-c(RGDyK))具有更高的肿瘤摄取值和良好的药代动力学性质,是一个有前途的靶向肿瘤整合素αⅤβ3和其他相关疾病的血管生成的PET示踪剂。Ingrid Dijkgraaf等[30]证实,68Ga标记的 DOTA 聚合物在小鼠SK-RC-52移植瘤中对整合素αⅤβ3的靶向性遵循DOTA四聚体>DOTA二聚体>DOTA单体,即四聚RGD比二聚RGD的肿瘤靶向性好。
通过对RGD肽二聚体进行聚乙二醇化修饰,Liu等[31]制备了18F-FP-PRGD2,其化学结构示于图3。临床前实验表明,18F-FP-PRGD2的肿瘤与非靶摄取比值和体内药代动力学性能显著 优 于18F-galacto-RGD。18F-FP-SRGD2 和18FFP-PRGD2二聚体 RGD 比18F-galacto-RGD 具有 更 高 的 肿 瘤 摄 取。18F-FP-P-PRGD2 是 由PEG4链连接的环状二聚体,可以提供整合素表达在肿瘤血管的重要信息。比RGD2有更好的整合素亲和力和特异性,优良的药代动力学性质和代谢稳定性,比18F-FP-P-RGD2有更好的肿瘤摄取率[32]。荷人胶质瘤U87-MG裸鼠尾静脉分 别 注 射18F-FP-PRGD2 和18F-galacto-RGD,60min后行小动物PET显像,两种示踪剂在肿瘤中的摄取值分别为2.80±0.46和(1.16±0.06)%ID/g。Chin等[33]采用GE TRACERlab FXFN 模 块 制 备 了 适 用 于 临 床 的18F-FPPRGD2,并对健康志愿者进行PET显像。结果显示,18F-FP-PRGD2主要通过肾脏和膀胱排出体外,在肠、甲状腺和脑室中可见少量放射性摄取,而在头、颈、胸部和四肢未见明显的放射性摄取。由于18F-FP-PRGD2在肺和乳腺处的本底非常低,因此,该示踪剂在这些部位显示肿瘤的成功性较高。临床试验表明,18F-FP-PRGD2安全耐受,其在体内的有效辐照剂量与18F-FDG相近,且无毒副作用发生。
Yang等[34]对酪氨酸激酶抑制剂ZD4190、融合蛋白血管抑制剂VEGF121/rGel、紫杉醇类纳米制剂Abraxane的早期疗效进行监测,以荷人乳腺癌MDA-MB435裸鼠为实验对象,给药后监测肿瘤体积并定期行18F-FP-PRGD2和18FFDG小动物PET显像。给药3d后,肿瘤对18F-FP-PRGD2的摄取即显著降低,并和免疫组化结果一致。而肿瘤体积在治疗5d始见显著减小。同期18F-FDG摄取值无显著变化。这表明18F-FP-PRGD2PET 较肿瘤体积检测和18FFDG PET更适宜早期监测抗肿瘤药物的疗效。

图3 18F-FP-PRGD2的化学结构
4 18F-FAl-NOTA-PRGD2
目前,RGD 肽的18F标记主要使用辅基18FSFB或18F-NFP。由于制备工艺耗时且繁琐,使18F标记RGD肽示踪剂在临床上的推广应用受到限制。以18F-FP-PRGD2为例,其制备过程包括:QMA 柱纯化18F、辅基 (18F-NFP)的制备及纯化,耦联肽,两次HPLC纯化产品等。整个工艺耗时约2~3h,且操作繁琐,总体标记率低[35]。
Li等[36,37]使用点击化学对标记过程进行了简化。但该方法需要对肽进行叠氮或炔基官能团修饰,且需进行两步放射化学反应,有时还需挥发性18F-叠氮合成子。
18F-易与金属(如铝)结合,生成的18F-铝配合物(18F-Al)可与螯和基团(如 NOTA)连接。Liu等[38]通过18F-Al和连接 NOTA 的 RGD 肽进行直接反应,制得18F-FAl-NOTA-RGD2。该过程无须QMA柱纯化、辅基的制备和HPLC纯化等,制备简便。
Lang等制备了与18F-FPPRGD2类似结构的示踪剂18F-FAl-NOTA-PRGD2(其化学结构示于图4),工艺大为简化,小动物PET显像表明,18F-FAl-NOTA-PRGD2的药代动力学和显像性能与18F-FPPRGD2相似甚至更好。Yang等[39,40]制 备 了18F-FAl-NOTA-PRGD2 的 配 套药盒,并申报了中国发明专利。鉴于合成便捷且显像性能良好,18F-FAl-NOTA-PRGD2有望替代18F-FPPRGD2用于肿瘤整合素αⅤβ3受体表达PET显像。
5 其 它
Dumont[41]等比较了三种螯合剂 DOTA、NODAGA 和 CB-TE2A,认 为68Ga 标 记 的NODAGA-c(RGDfk)放射合成方法简便,仅室温反应10min,放化纯度大于97%,比活度为15~20GBq/μmol;64Cu 标 记 的 CB-TE2A-c(RGDfk)则可对U87MG胶质母细胞瘤裸鼠进行延迟显像,注射18h后仍有较高的肿瘤与本底比。
Naeun Choi[42]等 用 共 轭 HSA-TIMP2-RGD肽,与123I和68Ga标记,用SPECT和PET评估荷人胶质母细胞瘤U87MG小鼠的体内肿瘤显像及生物分布研究。研究结果显示:其不仅是一个潜在的新的融合蛋白抗癌药物,也可作为肿瘤的放射诊断药物。
西门子公司后续开发了18F-RGD-K5,已用于临床评估Avastin(贝伐单抗)标准化治疗前后肿瘤摄取值的变化和血管生成的检测,其结果有助于确定Avastin早期治疗方案。
基于肿瘤常同时表达多个受体,异源双受体表达成像成为一种新策略。异源二聚体肽较容易准备,特别是有市售的单体肽。Yan[43]等利用对称连接设计并合成了靶向GRPR和整合素受体的二聚体肽 AEADP-BBN-RGD,Liu等[44]设计 并 合 成 了 异 二 聚 体 肽 PEG3-GLU-RGDBBN,动物实验表明,双受体显像剂在肿瘤部位摄取明显高于单体肽。因为连接剂AEADP和PEG3的加入,提高了标记产率,改善了体内药代动力学性质,是较有前途的靶向整合素和GRPR阳性成像的PET示踪剂。此异二聚体策略为体内外肿瘤诊治分子探针的设计提供了新思路。

图4 18F-FAl-NOTA-PRGD2的化学结构
6 展 望
含RGD序列的小分子肽是肿瘤αⅤβ3受体强有力的拮抗剂,向多肽中引入不同的功能基团修饰,并用放射性核素标记,由于未改变这类多肽的空间结构,因此并不影响标记配体在体内外与αⅤβ3受体结合的亲和力与选择性。这类多肽不仅是具有潜在临床应用价值的肿瘤受体靶向显像剂,而且为进一步开展实体肿瘤受体靶向核素治疗研究奠定了坚实的基础。综上所述,18F标记的RGD肽类示踪剂靶向整合素αⅤβ3受体,在肿瘤早期诊断、病灶检测及疗效评价等方面具有广阔的前景。开发配套药盒、提供简单的制备工艺,将有助于18F标记的RGD肽类示踪剂在临床的推广应用,为临床诊疗提供丰富完善的信息。
[1] Liu S.Radiolabeled cyclic RGD peptides as integrinαⅤβ3-targeted radiotracers:maximizing binding affinity via bivalency[J].Bioconjug Chem,2009,20(12):2 199-2 213.
[2] Carmeliet P.Mechanisms of angiogenesis and arteriogenesis[J].Nat Med,2000,6(4):389-395.
[3] Yang M,Gao H,Sun X,et al.Multiplexed PET probes for imaging breast cancer early response to VEGF121/rGel treatment[J].Mol Pharm,2011,8(2):621-628.
[4] Yang M,Gao HK,Yan YJ,et al.PET imaging of early response to the tyrosine kinase inhibitor ZD4190[J].Eur J Nucl Med Mol Imaging,2011,38(7):1 237-1 247.
[5] Gupta MK,Qin RY.Mechanism and its regulation of tumor-induced angiogenesis[J].World J Gastroenterol,2003,9(6):1 144-1 155.
[6] 李林法,张敏鸣.肿瘤靶向分子影像[M].北京:科学出版社,2006:82-86.
[7] Burke PA,DeNardo SJ,Miers LA,et al.Cilengitide targeting ofαⅤβ3integrin receptor synergizes with radioimmunotherapy to increase efficacy and apoptosis in breast cancer xenografts[J].Cancer Res,2002,62(15):4 263-4 272.
[8] Cai W,Sam Gambhir S,Chen X.Multimodality tumor imaging targeting integrinαⅤβ3[J].Biotechniques,2005,39(6Suppl):S14-S25.
[9] 沈瑛,糜军.靶向整合素αⅤβ3的分子影像探针[J].中国癌症杂志,2010,20(4):303-307.
[10]Lee S,Xie J,Chen X.Peptides and peptide hormones for molecular imaging and disease diagnosis[J].Chem Rev,2010,110(5):3 087-3 111.
[11]Haubner R,Wester HJ,Reuning U,et al.RadiolabeledαⅤβ3integrin antagonists:a new class of tracers for tumor targeting[J].J Nucl Med,1999,40(6):1 061-1 071.
[12]Haubner R,Wester HJ,Weber WA,et al.Noninvasive imaging ofαⅤβ3integrin expression using18F-labeled RGD-containing glycopeptide and positron emission tomography[J].Cancer Res,2001,6(1):1 781-1 785.
[13]Haubner R,Kuhnast B,Mang C,et al.[18F]Galacto-RGD:synthesis,radiolabeling, metabolic stability,and radiation dose estimates[J].Bioconjug Chem,2004,15(1):61-69.
[14]Beer AJ,Haubner R,Goebel M,et al.Biodistribution and pharmacokinetics of theαⅤβ3-selective tracer18F-galacto-RGD in cancer patients[J].J Nucl Med,2005,(8):1 333-1 341.
[15]Haubner R,Weber WA,Beer AJ,et al,Noninvasive visualization of the activatedαⅤβ3integrin in cancer patients by positron emission tomography and[18F]Galacto-RGD[J].PLoS Medicine,2005,2(3):e70.
[16]Beer AJ,Lorenzen S,Metz S,et al.Comparison of integrinαⅤβ3expression and glucose metabolism in primary and metastatic lesions in cancer patients:a PET study using18F-galacto-RGD and18F-FDG.J Nucl Med,2008,49(1):22-29.
[17]Beer AJ,Niemeyer M,Carlsen J,et al.Patterns ofαⅤβ3expression in primary and metastatic human breast cancer as shown by18F-Galacto-RGD PET[J].J Nucl Med,2008,49(2):255-259.
[18]Beer AJ,Grosu AL,Carlsen J,et al.[18F]galacto-RGD positron emission tomography for imaging ofαⅤβ3expression on the neovasculature in patients with squamous cell carcinoma of the head and neck[J].Clin Cancer Res,2007,13(22Pt 1):6 610-6 616.
[19]Beer AJ,Haubner R,Sarbia M,et al.Positron emission tomography using[18F]Galacto-RGD identifies the level of integrinαⅤβ3expression in man[J].Clin Cancer Res,2006,2(13):3 942-3 949.
[20]Schnell O,Krebs B,Carlsen J,et al.Imaging of integrinαⅤβ3expression in patients with malignant glioma by [18F]Galacto-RGD positron emission tomography[J].Neuro Oncol,2009,11(6):861-870.
[21]Hauber R,Beer AJ,Wang H,et al.Positron emission tomography tracers for imaging angiogenesis[J].Eur J Nucl Med Mol Imaging,2010,37(Suppl1):S86-S103.
[22]Indrevoll B,Kindberg GM,Solbakken M,et al.NC-100717:a versatile RGD peptide scaffold for angiogenesis imaging[J].Bioorg Med Chem Lett,2006,16(6):6 190-6 193.
[23]Kenny LM,Coombes RC,Oulie I,et al.Phase I trial of the positron-emitting Arg-Gly-Asp (RGD)peptide radioligand18F-AH111585in breast cancer patients[J].J Nucl Med,2008,49(6):879-886.
[24]Battle MR,Goggi JL,Allen L,et al.Monitoring tumor response to antiangiogenic sunitinib therapy with18F-fluciclatide,an18F-labeledαⅤβ3-integrin andαⅤβ5-integrin imaging agent[J].J Nucl Med,2011,52(3):424-430.
[25]McParland BJ,Miller MP,Spinks TJ,et al.The biodistribution and radiation dosimetry of the Arg-Gly-Asp peptide18F-AH111585in healthy volunteers[J].J Nucl Med,2008,49(10):1 664-1 667.
[26]Morrison MS,Ricketts SA,Barnett J,et al.Use of a novel Arg-Gly-Asp radioligand,18FAH111585,to determine changes in tumor vascularity after antitumor therapy[J].J Nucl Med,2009,50(1):116-122.
[27]Liu Zhaofei,Yan Yongjun.18F,64Cu,and68Ga Labeled RGD-bombesin heterodimeric peptides for PET imaging of breast cancer [J].Bioconjugate Chem,2009,20:1 016-1 025.
[28]Liu Z,Liu S,Wang F,et al.Noninvasive imaging of tumor integrin expression using18F-labeled RGD dimer peptide with PEG4linkers[J].Eur J Nucl Med Mol Imaging,2009,36(8):1 296-1 307.
[29]Wu Zhanhong,Li Zibo.MicroPET of tumor integrinαⅤβ3expression using18F-labeled PEGylated tetrameric RGD peptide,18F-FPRGD4[J].Nucl Med,2007,48(9):1 536-1 544.
[30]Ingrid Dijkgraaf,Cheng-Bin Yim.PET imaging of αⅤβ3integrin expression in tumours with68Ga-labelled mono-,di-and tetrameric RGD peptides[J].Eur J Nucl Med Mol Imaging,2011,38:128-137.
[31]Liu S,Liu Z,Chen K,et al,18F-labeled galacto and PEGylated RGD dimers for PET imaging of αⅤβ3integrin expression[J].Mol Imaging Biol,2010,12(5):530-538.
[32]Li ZB,Chen K,Chen X,et al.68Ga-labeled multimeric RGD peptides for microPET imaging of integrinαⅤβ3expression[J].Eur J Nucl Med Mol Imaging,2008,35(6):1 100-1 108.
[33]Chin FT,Shen B,Liu S,et al.First experience with clinical-grade[18F]FPP(RGD)(2):an automated multi-step radiosynthesis for clinical PET studies[J].Mol Imaging Biol,2011.
[34]Sun X,Yan Y,Liu S,et al.18F-FPPRGD2and18F-FDG PET of response to Abraxane therapy[J].J Nucl Med,2011,52(1):140-146.
[35]Liu Zhaofei,Liu Shuanglong.Noninvasive imaging of tumor integrin expression using18F-labeled RGD dimer peptide with PEG4linkers[J].Eur J Nucl Med Mol Imaging,2009,36:1 296-1 307.
[36]Li ZB,Wu Z,Chen K,et al.Click chemistry for18F-labeling of RGD peptides and microPET imaging of tumor integrin alphaⅤbeta3expression[J].Bioconjugate Chem,2007,18(6):1 987-1 994.
[37]Hausner SH,Marik J,Gagnon MK,et al,In vivo positron emission tomography (PET)imaging with anαⅤβ6specific peptide radiolabeled using18F-“click”chemistry:evaluation and comparison with the corresponding 4-[18F]fluorobenzoyl-and 2-[18F]fluoropropionyl-peptides[J].J Med Chem,2008,51(19):5 901-5 904.
[38]Liu S,Liu H,Jiang H,et al.One-step radiosynthesis of18F-AlF-NOTA-RGD2for tumor angiogenesis PET imaging[J].Eur J Nucl Med Mol Imaging,2011,(9):1 732-1 741.
[39]杨敏,陈小元,郞立新,等.一种18F标记的PRGD2化合物、其药盒、药盒制备方法及应用:中国,201110184202.2[P].2011-07-04.
[40]杨敏,陈小元,徐宇平,等.一种用于自动化生产18F-E[c(RGDyk)2]的药盒及其制备和使用方法:中国,201110185085.1[P].2011-07-04.
[41]Dumont Rebecca A,Friederike Deininger.Novel64Cu-and68Ga-labeled RGD conjugates show improved PET imaging ofαⅤβ3integrin expression and facile radiosynthesis[J].J Nucl Med,2011,52(8):1 276-1 284.
[42]Naeun Choi,Sung-Min Kim.The use of the fusion protein RGD-HSA-TIMP2as a tumor targeting imaging probe for SPECT and PET[J].Biomaterials,2011,32:7 151-7 158.
[43]Yan Yongjun,Chen Kai.A new18F-labeled BBNRGD peptide heterodimer with a symmetric linker for prostate cancer imaging[J].Amino Acids,2011,41:439-447.
[44]Liu Zhaofei,Yan Yongjun.Dual integrin and gastrin-releasing peptide receptor targeted tumor imaging using18F-labeled PEGylated RGD-bombesin heterodimer18F-FB-PEG3-Glu-RGD-BBN [J].J Med Chem,2009,52:425-432.
