辩证思维在苏教版《化学反应原理》教材中的体现
2011-07-17黄宜美
黄宜美
(莆田一中 福建 莆田 351100)
学会学习是现代学习新观念,其必要条件之一是学会思维,尤其是辩证思维方法在现代学习中的应用。辩证思维就是从事物的运动、变化、联系和发展中把握事物的科学思维方法。苏教版《化学反应原理》在多处地方体现了这种学习方法,其中有两处尤为突出。
一、中和滴定曲线绘制
中和滴定是一种重要的滴定分析方法,是中学阶段唯一的滴定分析方法,也是中学化学中重要的定量实验,是一个培养学生面对实际问题的好题材。[1]
1.中和滴定曲线的绘制在教材中的呈现
教材是以活动与探究的形式来呈现中和滴定曲线的绘制,该活动是以酚酞作指示剂,用0.100 0mol/L NaOH溶液滴定20.00mL 0.100 0mol/L盐酸,在滴定过程中,用pH计测定溶液的pH值,并记录在如下的表格中。

V(NaOH)/mL pH
反应开始时,测定和记录的pH间隔可稍大些,反应终点附近测定和记录的pH间隔要小,每加一滴溶液测定并记录一次数据,根据所记录的数据,以NaOH溶液的体积为横坐标,pH为纵坐标,绘制滴定曲线。所绘的曲线如下:
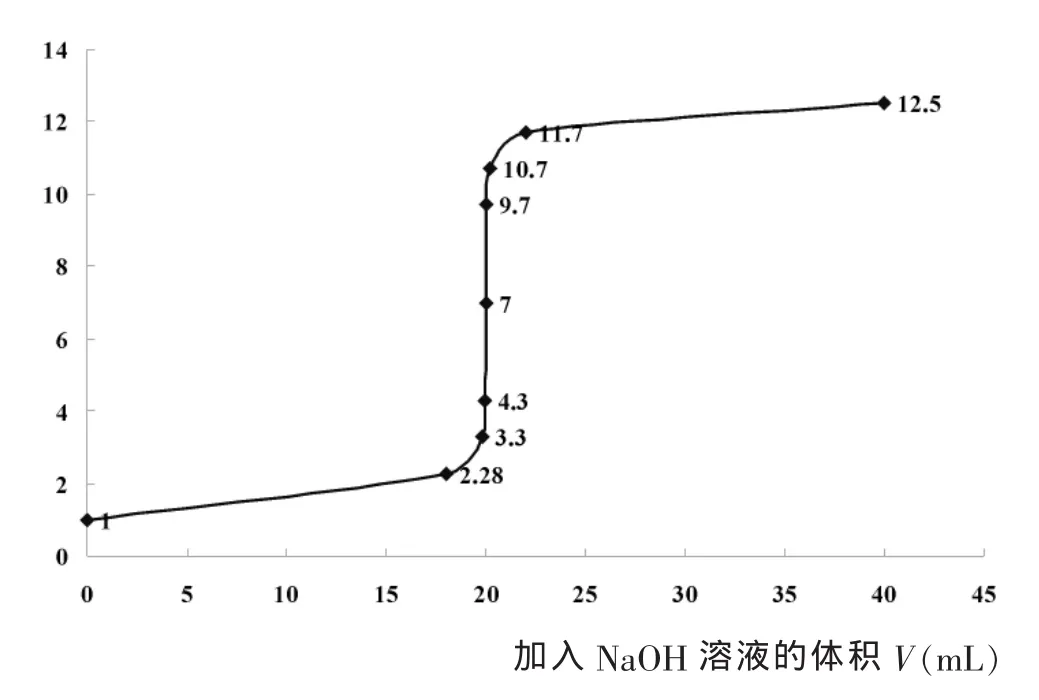
通过曲线可以看出,当NaOH溶液的体积从19.98ml变为20.02ml时,pH从4.3突跃至9.7。因此,只要选择变色范围在这一范围内的指示剂就不会造成太大的误差。[2]那么在该活动中选择酚酞作指示剂误差有多大呢?当滴到pH为8时,酚酞变色,此时消耗NaOH溶液的体积是多少呢?我们可计算如下:常温下,当pH=8 时,c(H+)=1×10ˉ8mol/L,c(OH-)= 1×10ˉ6mol/L,设消耗的NaOH溶液的体积为VmL,
则 c(OH-)

得:V=20.0002
可以看出:误差很小,对测量结果影响很小,符合中学实验测量要求。因此,用“指示剂酚酞确定滴定终点”是有效的。
2.呈现中和滴定曲线的绘制所解决的问题
在以往的教材中,一般是直接介绍中和反应的原理和实际操作,缺乏“中和滴定”这一定量测量方法的引入过程,缺少解决问题的方法和过程的思考与训练,没有给学生思维的空间、有悖于现代的学习方法。
学习中和滴定时,学生总会提出问题:恰好中和时,溶液的pH值为7,而用酚酞作指示剂,酚酞的变色点在8~10,pH小于8为无色,大于8为红色,滴定中溶液pH=8时,溶液颜色发生突变,指示达到终点。显然并不是在pH=7时颜色突变,那为什么可用酚酞作终点指示剂呢?在以往的教材中都没有对这一问题进行交代,教师也只能含糊其辞地说:pH值在4~10之间会发生突跃,误差很小,叫学生硬记。而什么是突跃,学生很难理解。这一环节,学生发现了问题,但教材没有提供平台给学生解决问题,而苏教版《化学反应原理》给学生提供了一个很好的平台即中和滴定曲线的绘制。通过该活动与探究,学生解决了发现的问题,知道了什么是突跃,知道了为什么用酚酞滴定终点是有效的。同时学生在解决问题的过程中掌握了知识与技能。教师通过该活动教学生如何思维,如何把理论(中和原理)与实际(指示剂的选择)联系起来,实现了过程与方法的教学目标。完成该活动的同时,学生也学会了辩证思维。
二、BaSO4沉淀转化为BaCO3沉淀
在学习沉淀的转化时,教材通过活动与探究将AgCl沉淀逐步转化为AgI和Ag2S,进而得出结论:沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解能力相对较强的物质易转化为溶解能力相对较弱的物质。[2]但一定是这样吗?紧跟着教材介绍了BaSO4转化为BaCO3的方法。虽然BaCO3的溶解能力比BaSO4的溶解能力相对较强,但我们可以通过控制一定的条件使BaSO4转化为BaCO3。从而使学生认识到一般和特殊之间的关系。一般与特殊是一对矛盾统一体,在学习中正确处理特殊性和一般性的辩证关系,有利于全面、深刻地认识事物。
那么为什么BaSO4可以转化为BaCO3呢?教师可利用溶度积常数简单地解释,既使学生能辩证地思维,又使学生明白:不能简单地用溶度积的大小来判断沉淀反应是否发生,还要考虑其他条件的影响,从而更好地为生产和科研服务。
虽然 Ksp(BaSO4)<Ksp(BaCO3),从表面上看,似乎反应不能进行,但只要改变条件,沉淀溶解平衡就会发生移动。
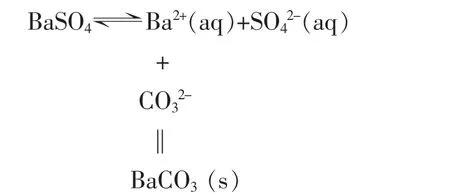
当 c(Ba2+)c(CO32-)>Ksp(BaCO3)时,BaSO4就能转化为BaCO3,加入的CO32-离子浓度越大,则转化越完全。因而教材采用了:用Na2CO3饱和溶液处理BaSO4沉淀,转化达到平衡后,移走上层溶液,再加入饱和Na2CO3溶液,重复处理多次,使绝大部分BaSO4转化为BaCO3。[2]
那么具体 c(CO32-)达到多大时,可以使 c(Ba2+)c(CO32-)>Ksp(BaCO3)呢?作为教师可以再进一步了解一下。
已知 25℃时,Ksp(BaCO3)=5.1×10-9,Ksp(BaSO4)=1.1×10-10
要使 c(Ba2+)c(CO32-)>5.1×10-9
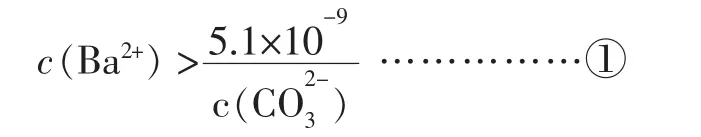
BaCO3沉淀就可以析出,而在体系中c(Ba2+)决定于BaSO4溶度积。

从理论上讲,只要当溶液中的 c(CO32-)比 c(SO42-)大46 倍,Na2CO3就可以使 BaSO4沉淀转化为沉淀 BaCO3。[3]
学习高中化学时,许多内容都体现了辩证思维的方法。如:“雷雨发庄稼”的过程,N2和O2反应生成NO,NO又和O2反应生成 NO2,NO2溶于雨水形成 HNO3,HNO3与土壤中的矿物质作用生成硝酸盐,其中的硝酸根离子被植物的根系吸收,转化为植物生长所需的养料。在这里少量的HNO3是有利的。但是,却不能用HNO3来作为化肥,因为作为化肥的量是比较多的,此时对植物就只有危害了。同样NO在空气中达到一定浓度时,是有毒的。但近年来发现一氧化氮广泛的分布于生物体内的各组织中,起着重要的生理作用。尤其是人们惊讶的发现血管内皮松弛因子(EDRF)的化学本质极有可能就是仅仅由一个氮原子和一个氧原子组成的一氧化氮时,一氧化氮的重要生物学作用得到了人们的普遍关注。 这些同样都涉及到辩证思维方法。对同一种物质,在不同的环境里所起的作用不同、量的不同所引起的结果也不同,需要我们正确地、辩证地认识事物。辩证思维可以提高学生的自主探究能力和创新能力。运用辩证思维优化学生的学习方法是在新课程理念下提高自主探究能力和学科素养的有效途径。
[1] 吴名胜,李献军.“中和滴定”的教学设计[J].化学教育,2008,29(6):19
[2] 王祖浩主编.化学反应原理(选修)[M].南京:江苏教育出版社,2010
[3] 刘亚芬.利用溶度积常数判断沉淀转化反应的方向[J].化学教育,2006,27(8):60
