FHL2蛋白在人牙周膜细胞体外矿化过程中的表达
2011-07-17王璐葛少华王效英杨丕山
王璐 葛少华 王效英 杨丕山
(山东大学口腔医学院·山东省口腔生物医学重点实验室,济南 250012)
FHL家族蛋白是指由4个半LIM结构域组成的一类蛋白质,它们只含LIM结构域,是LIM-only家族的一部分。近年来研究发现,该家族中FHL2蛋白在成骨细胞分化中起着重要作用。在胞核内,FHL2可作为辅助催化剂与转录因子相互作用;在细胞质内,FHL2可与许多整合素结合传递和放大细胞信号。FHL2蛋白过表达可提高成骨分化标志物产生和基质矿化;反之,FHL2减少会抑制成骨细胞分化,降低骨形成量[1]。但FHL2在牙周膜细胞矿化过程中的作用尚未见相关报道。与成骨细胞一样,牙周膜细胞由间充质组织发育而来,且在一定条件下均有合成及分泌胞外胶原基质发生矿化的能力。由于牙周膜细胞与成骨细胞在功能和特征上有很多相似之处,故推测FHL2在牙周膜细胞可能有表达,且在分化、矿化中发挥一定作用。目前已知可以先体外培养牙周膜细胞,然后加入地塞米松、抗坏血酸、β-甘油磷酸钠等之后则建立了牙周膜细胞体外矿化模型[2-3]。本研究以人牙周膜细胞(human periodontal ligament cells,hPDLCs)为研究对象,建立体外矿化模型,利用免疫细胞化学技术、半定量RT-PCR技术研究FHL2在牙周膜细胞体外分化、矿化过程中的表达。
1 材料和方法
1.1 主要试剂
高糖DMEM(Gibco公司,美国),β-甘油磷酸钠、抗坏血酸、地塞米松(Sigma公司,美国),TRIzol(大连宝生物有限公司),RT-PCR试剂盒(TaKaRa公司,日本),FHL2多克隆抗体(Santa Cruz公司,美国),SP、DAB显色试剂盒(北京中杉金桥有限公司)。
1.2 方法
1.2.1 细胞培养 标本取自临床上10~18岁青少年因正畸治疗而拔除的健康前磨牙,无菌条件下刮取根中1/3的牙周膜,组织块法培养,每隔3 d换液1次。培养液为含15%胎牛血清、青霉素100U·mL-1、链霉素100μg·mL-1的DMEM培养液。取3~5代牙周膜细胞进行研究。实验组培养液中加入10mmol·L-1β-甘油磷酸钠,50 μg·mL-1维生素C,5mol·L-1地塞米松液进行牙周膜细胞体外矿化诱导;对照组不加上述矿化诱导剂。
1.2.2 茜素红染色检测矿化结节形成 取第4代牙周膜细胞以每毫升5×104个细胞密度接种于24孔板中的小盖玻片上,分别矿化培养0、14、28 d,将细胞爬片取出,40 g·L-1多聚甲醛固定液固定30min,蒸馏水冲洗,加入茜素红染料,染色20min,冲洗。封片。显微镜下观察。
1.2.3 免疫细胞化学法检测FHL2蛋白表达 分别于矿化培养0、14 d,将预先置入孔板的细胞爬片取出,40 g·L-1多聚甲醛固定15min,按照SP试剂盒说明书行免疫细胞化学染色。一抗比例1∶100,DAB显色,冲洗,苏木素复染,封片。镜下观察。
1.2.4 RT-PCR检测FHL2 mRNA表达 分别于培养的0、14、28 d提取细胞总RNA。细胞瓶中加入TRIzol试剂,移液器反复吹打后移入Eppendorf管。室温放置5min,加三氯甲烷振荡后静置。4℃,12 000 g离心15min,吸取上层水相至新Eppendorf管。依次加异丙醇、75%乙醇沉淀、洗涤RNA。沉淀中加入RNasefree水,70℃水浴10min。用逆转录酶、引物Oligo(dT)将所得RNA在50℃水浴60min,70℃水浴15min的反应条件下逆转录为cDNA。FHL2的上游引物为3’-ACTGCTTCTGTGACTTGTATGC-5’,下游引物为3’-GTTATGCCACTGCCGTTCC-5’。PCR反应条件为94℃预变性5min,94℃变性40 s,55℃退火40 s,72℃延伸40 s,32个循环;72℃末次延伸7min。PCR产物通过1.5%凝胶电泳与DL2000 DNA Marker对照鉴定大小,凝胶成像系统拍照。以内参甘油醛-3-磷酸脱氢(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为标准,分别对hPDLCs诱导后各期PCR产物条带做吸光度值分析,分析FHL2 mRNA表达。
1.2.5 统计分析 每组实验重复4次。所有数据均使用SPSS11.0软件包进行统计学单因素方差分析。
2 结果
2.1 细胞生长和形态
原代培养获得体外生长的比例为10%~20%,一般3~7 d组织块边细胞开始游出,呈成纤维细胞状(图1),以组织块为中心呈放射状、漩涡状生长。传代后4~7 d可长满瓶底。
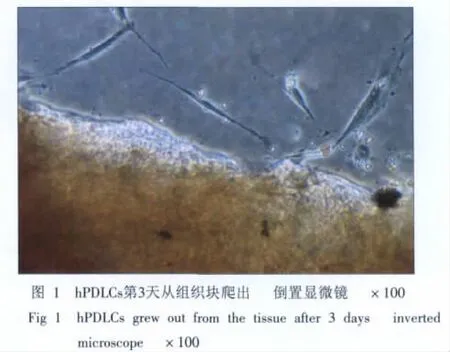
2.2 矿化结节形成
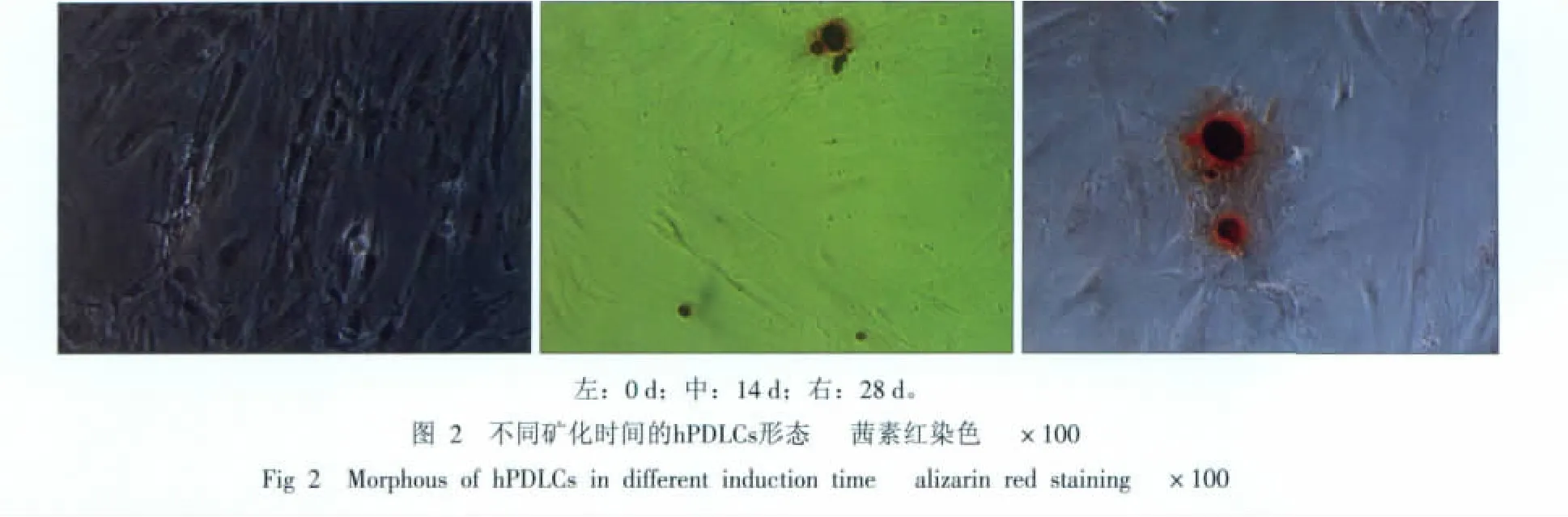
0 d时基本无矿化结节形成,14 d时茜素红染色显示有散在的矿化点或小的矿化结节形成,28 d时显示有明显的红色矿化结节形成(图2),散在分布,周围为紧密排列的hPDLCs,生长中心处结节较多。对照组则矿化结节形成较少且相对滞后。
2.3 FHL2蛋白表达
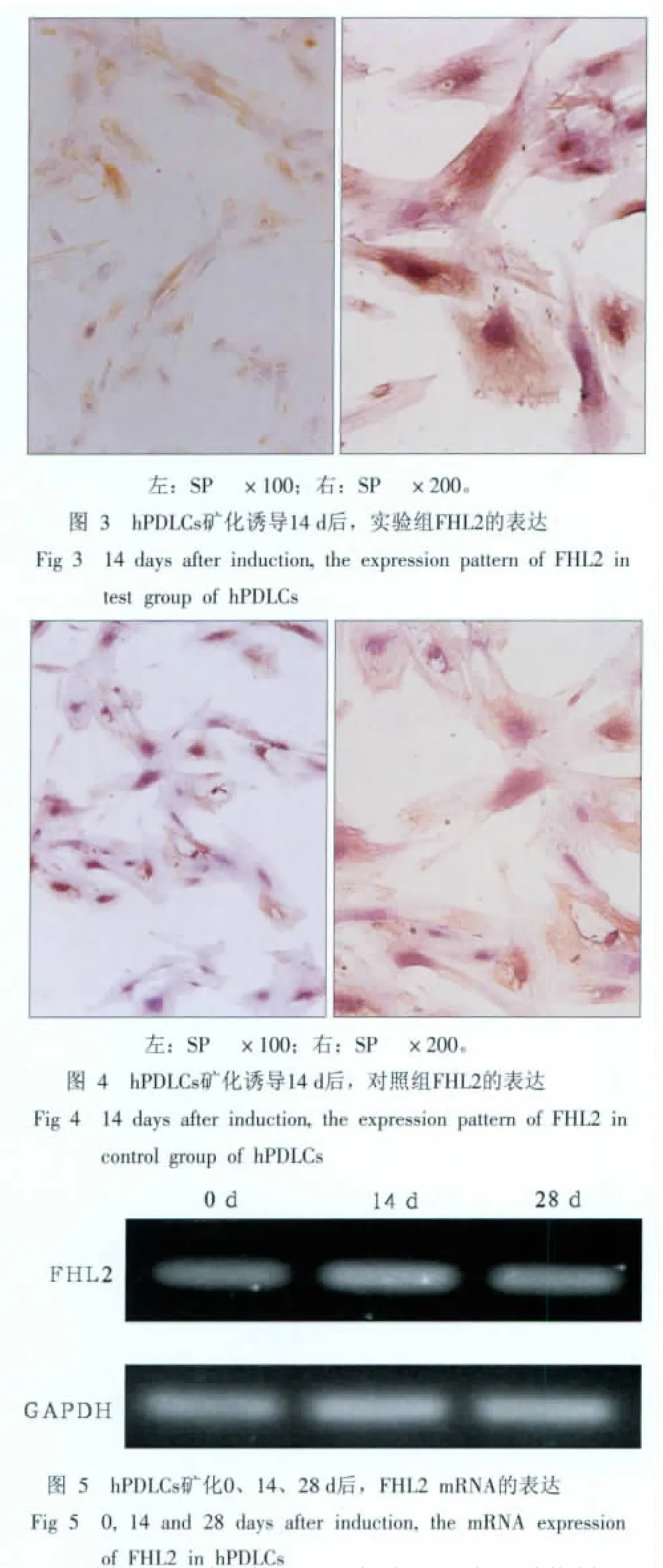
免疫细胞化学结果显示:培养14 d,实验组FHL2蛋白在牙周膜胞核与细胞质均呈强阳性表达(图3),而对照组也为阳性表达,但与实验组相比较弱(图4)。
2.4 FHL2 mRNA表达
RT-PCR检测在hPDLCs体外矿化过程中,FHL2 mRNA表达的电泳结果见图5。FHL2 mRNA表达量用其与管家基因GAPDH的比值表示。在进行矿化诱导之前,hPDLCs中FHL2 mRNA的表达量为0.810 9,经矿化诱导14 d,FHL2 mRNA的表达量显著升高,达到1.1266,约为0d时的1.4倍(P<0.01);而经矿化诱导28 d后,FHL2 mRNA的表达量与14 d时相比有显著降低(P<0.05),为1.015 4,但仍然显著高于0 d时的水平(P<0.01)。
3 讨论
牙周膜细胞具有多向分化能力,是牙周组织工程中最重要的种子细胞之一。组织工程学研究显示,由牙周膜细胞形成的牙周膜-牙骨质复合体在组织形态和空间排列上更类似于天然牙周组织[4],表明其在牙周组织再生方面具有其他种子细胞不具备的优势。牙周再生的关键过程是牙周膜细胞通过向成骨细胞及成牙骨质细胞方向分化,形成矿化组织(骨和牙骨质),因此,研究牙周膜细胞分化和矿化机制及其中涉及的信号分子对牙周组织工程具有极其重要的作用。
研究[2-3]证明:在培养液中加入矿化剂β-甘油磷酸钠、维生素C、地塞米松,可诱导体外培养的牙周膜细胞形成矿化结节。在本研究中,将hPDLCs进行体外矿化诱导培养,14 d后矿化结节形成,茜素红染色呈阳性。因体外矿化结节的形成是成骨细胞分化成熟的标志,故该结果表明经矿化诱导后,牙周膜细胞已向成骨方向分化。在这一体外分化过程中,细胞内信号转导分子FHL2在牙周膜细胞中的表达也发生了相应的改变。
FHL2蛋白是隶属于FHL家族的信号转导分子。近年来发现,FHL2在成骨细胞中大量表达[5-6]。研究[7]表明:在骨髓细胞向成骨细胞分化时,FHL2表达量可增加3倍,且FHL2蛋白表达量的改变可对成骨细胞的生物学特性产生明显影响,FHL2高表达的成骨细胞分化标志物如碱性磷酸酶(alkaline phosphatase,ALP)、骨涎蛋白(bone sialoprotein,BSP)和骨桥蛋白(osteopontin,OPN)等均呈上调趋势,且骨基质矿化也同时升高;相反,FHL2缺乏的成骨细胞呈现减低的分化趋势[5]。其机制目前认为主要包括FHL2在蛋白水平能与多种蛋白相互作用,如与胰岛素样生长因子结合蛋白-5(insulin-like growth factor binding protein-5,IGFBP-5)相互作用,并且FHL2可能作为IGFBP-5的辅助激活剂来刺激成骨细胞增殖[6];同时在分子水平,FHL2作为转录因子共激活剂与Runx2相互作用,通过成骨细胞内FHL2活性改变使骨量发生相应改变[1]。此外,FHL2还可调节细胞周期。Lai等[5]提出,FHL2过表达的成骨细胞7 d后增殖率明显高于普通细胞,使得细胞层汇合加快。因此,通过介导多种蛋白间相互作用,FHL2对成骨细胞分化和活性均具有着明确的促进作用。
本研究免疫细胞化学结果显示:牙周膜细胞矿化诱导14 d后FHL2蛋白表达量明显增高,提示其表达量与矿化相关。为了深入探讨hPDLCs矿化诱导时间与FHL2表达量间的关联,本实验通过RT-PCR实验来检测FHL2基因水平的改变。结果表明FHL2 mRNA的表达量在矿化14 d时升高至0 d时的1.4倍,而到28 d时有所降低。该结果说明从分子水平上FHL2在牙周膜细胞与成骨细胞表达情况相似,即早期矿化成骨过程中FHL2表达量增高明显。Hamidouche等[8]的实验结果也表明:骨髓基质干细胞在经地塞米松矿化诱导3 d后,即有FHL2的表达增加,同时相应的伴有Runx2、ALP及Ⅰ型胶原表达的增加。从以往的研究已知,Runx2在细胞矿化分化早期中的作用比在晚期更为明显,因此,本实验中FHL2表达变化趋势与该研究的结果相一致。
研究表明:FHL2分子可能以一种Rho/GTP酶依赖的方式自细胞质转移进胞核内[9-10],且FHL2蛋白的相对分子质量为3.2×104,而主动运输方式通过核孔的相对分子质量上限为5.0×104,因此,FHL2可以在缺乏核定位信号和核输出信号的情况下出入细胞核。虽然已知FHL2的编码蛋白为核浆分布,但其亚细胞结构定位仍具有细胞特异性。如HeLa细胞、原成肌细胞等主要位于细胞核内,而在HepG2、H9C2、成纤维细胞等其他类型细胞中则胞核及细胞质均有分布[11-12]。FHL2蛋白这种在细胞质及胞核均有分布的特性在本研究中也得以体现。免疫细胞化学结果显示:牙周膜细胞矿化前后FHL2均为胞核及细胞质阳性表达,这种表达符合FHL2蛋白在成纤维类细胞的定位特点。
牙周组织的修复与再生过程涉及大量信号分子,其中既包括增强牙周膜细胞增殖活性的信号分子,也包括促进牙周膜细胞迁移分化等功能活动的细胞分子,因此选择合适的信号分子对于牙周组织工程来说至关重要。进一步的实验将在深入探讨FHL2在牙周膜细胞矿化过程中作用机制的基础上,研究FHL2应用于牙周硬组织再生的可行性。
[1]Günther T,Poli C,Müller JM,et al.Fhl2 deficiency results in osteopenia due to decreased activity of osteoblasts[J].EMBO J,2005,24(17):3049-3056.
[2]Arceo N,Sauk JJ,Moehring J,et al.Human periodontal cells initiate mineral-like nodules in vitro[J].J Periodontol,1991,62(8):499-503.
[3]Cho MI,Matsuda N,Lin WL,et al.In vitro formation ofmineralized nodules by periodontal ligament cells from the rat[J].Calcif Tissue Int,1992,50(5):459-467.
[4]Ivanovski S,Gronthos S,Shi S,et al.Stem cells in the periodontal ligament[J].Oral Dis,2006,12(4):358-363.
[5]Lai CF,Bai S,Uthgenannt BA,et al.Four and half limprotein 2(FHL2) stimulates osteoblast differentiation[J].JBone Miner Res,2006,21(1):17-28.
[6]Amaar YG,Thompson GR,Linkhart TA,et al.Insulin-like growth factor-binding protein 5(IGFBP-5) interacts with a four and a half LIM protein 2(FHL2)[J].JBiol Chem,2002,277(14):12053-12060.
[7]Genini M,Schwalbe P,Scholl FA,et al.Subtractive cloning and characterization of DRAL,a novel LIM-domain protein down-regulated in rhabdomyosarcoma[J].DNA Cell Biol,1997,16(4):433-442.
[8]Hamidouche Z,HaÿE,Vaudin P,et al.FHL2 mediates dexamethasone-induced mesenchymal cell differentiation into osteoblasts by activating Wnt/beta-catenin signaling-dependent Runx2 expression[J].FASEB J,2008,22(11):3813-3822.
[9]Morlon A,Sassone-Corsi P.The LIM-only protein FHL2 is a serum-inducible transcriptional coactivator of AP-1[J].Proc Natl A-cad Sci U S A,2003,100(7):3977-3982.
[10]Müller JM,Metzger E,Greschik H,et al.The transcriptional coactivator FHL2 transmits Rho signals from the cell membrane into the nucleus[J].EMBO J,2002,21(4):736-748.
[11]Ng EK,Chan KK,Wong CH,et al.Interaction of the heart-specific LIM domain protein,FHL2,with DNA-binding nuclear protein,hNP220[J].J Cell Biochem,2002,84(3):556-566.
[12]Labalette C,Renard CA,Neuveut C,et al.Interaction and functional cooperation between the LIM protein FHL2,CBP/p300,and beta-catenin[J].Mol Cell Biol,2004,24(24):10689-10702.
