肌肉来源干细胞表面抗原-1阳性与阴性细胞体外培养成肌特性的比较
2011-07-17车晓霞赵彤朱玲玲郭杰
车晓霞 赵彤 朱玲玲 郭杰
(1.首都医科大学附属北京口腔医院 正畸科,北京 100050;2.军事医学科学院基础医学研究所 脑保护与可塑性研究室,北京 100850;3.山东大学口腔医院 正畸科;山东省口腔生物医学重点实验室,济南 250012)
干细胞表面抗原-1(stem cell antigen-1,Sca-1)作为一种细胞表面标记常用于富集干细胞和前体细胞,最早发现于小鼠激活的淋巴细胞[1],是一种由鼠Ly6基因家族编码,以糖基磷脂酰肌醇锚定的细胞表面蛋白,相对分子质量为18 000,定位于浆膜的脂质载体[2]。
骨骼肌受到损伤后,在骨骼肌局部存留的干细胞和肌肉形成前体细胞激活、增殖、分化并融合形成多核肌细胞,修复或替代受损的组织[3-4]。这对于维持骨骼肌在运动和老化过程中的动态平衡非常重要。实验证实表达Sca-1的细胞在体内和体外都可以分化为骨骼肌,也可以生成造血细胞和间充质细胞[5-6]。在细胞移植治疗中,Sca-1+细胞存活率高[7],靶基因治疗效果好,但目前对这种细胞表面蛋白的功能尚不明了。
成肌调节因子(muscle regulatory factor,MRF)在肌肉细胞种系决定和分化中起重要作用。其中MyoD和成肌素(Myogenin)都属于MRF,MyoD作为原发的转录因子,在成肌种系决定中起作用[8],见于激活的卫星细胞;Myogenin作为继发的转录因子,在肌肉终末分化时表达[9]。本研究对比观察了Sca-1+与Sca-1-细胞在体外培养过程中的生长特性及MRF表达的特点,希望获得实验线索以说明Sca-1在细胞增殖分化过程中所发挥的功能作用。
1 材料和方法
1.1 小鼠原代成肌细胞的分离和培养
将4周龄C57BL/6小鼠脱颈处死,75%乙醇消毒小鼠后肢皮肤,剪开皮肤,剔去脂肪和筋膜,剪取后肢肌肉组织,立即放入预冷的DMEM中漂洗3次。将肌肉小块转移至无菌的小烧杯中,用眼科剪充分剪碎成浆状,加入组织混合酶(2.4 U·mL-1分散酶、0.2%Ⅱ型胶原酶、2.5mmol·L-1CaCl2),37℃消化45min,每间隔15min用吸管反复吹吸若干次。用含20%胎牛血清(fetal bovine serum,FBS)的生长液终止消化,200目细胞筛选过滤,1 400 r·min-1离心10min,弃去上清,按照密度为每毫升1×106个细胞悬于200μL的PBS中,等待流式细胞仪检测和分选。
1.2 流式细胞仪检测原代成肌细胞中Sca-1的表达
将从小鼠骨骼肌中获得的新鲜成肌细胞以密度为每毫升1×106个悬于200μL的PBS中,加入藻红蛋白标记的Sca-1单克隆抗体(Santa Cruz Biotechnologies公司,美国),37℃孵育30min,用含体积分数0.1%牛血清蛋白(bovine serum albumin,BSA)的PBS洗涤、重悬细胞,移入专用测试管,应用流式细胞仪检测Sca-1的表达,采用联机专用软件Cell Quest进行分析。此外按照流式细胞仪仪器手册设置各项参数,安装分选器,将上述细胞进行分选,分别收集Sca-1+与Sca-1-细胞。
1.3 生长曲线的测定
生长曲线是判定细胞活力的重要指标,本实验采取CCK-8试剂盒测定光密度值(A值),间接测量活细胞数量。将流式细胞仪分选获得的Sca-1+与Sca-1-细胞分别以密度为每孔3×104个细胞接种于96孔板,每组20孔。培养1、3、5 d后向各孔中加入10μL的CCK-8溶液,37℃孵育4 h,直接测定450 nm处的A值,绘制曲线。
1.4 Western blot检测成肌蛋白的表达
为了对比小鼠骨骼肌来源Sca-1+与Sca-1-细胞在体外培养过程中从增殖到分化的变化,采用Western blot检测Sca-1、MyoD、Myogenin的蛋白表达。将Sca-1+与Sca-1-细胞分别以密度为每毫升5×104个细胞接种到涂布过鼠尾胶原的60mm培养皿中,培养液为高糖DMEM(含有20%FBS、1%青链霉素、2.5 ng·mL-1碱性成纤维细胞生长因子),细胞培养4 d后用细胞刮刮下细胞,PBS清洗,离心,加入细胞蛋白裂解液,冰上裂解30min,提取蛋白,-80℃保存备用。
常规制备10%SDS-PAGE分离胶,混匀后,将其灌入预先制备好的制胶板内(Bio-Rad公司的Mini-Cell制胶系统),用水覆盖,室温凝固30min。制备5%SDS-PAGE浓缩胶,混匀后,灌胶并置室温凝固30min。电泳首先以8 V·cm-1进行,待上样缓冲液进入分离胶后调整为15V·cm-1,电泳时间约2 h;随后以60 V的恒压进行硝酸纤维素膜电转,电转时间视被转移蛋白的大小而定。电转结束后,将膜置于TBS中漂洗,5%脱脂奶粉(北京普利莱公司)封闭,经TBS充分振荡清洗后,分别滴加一、二抗(辣根过氧化物酶标记的相应抗体),DAB显色,观察结果。
2 结果
2.1 Sca-1+与Sca-1-细胞体外培养增殖能力的测定结果
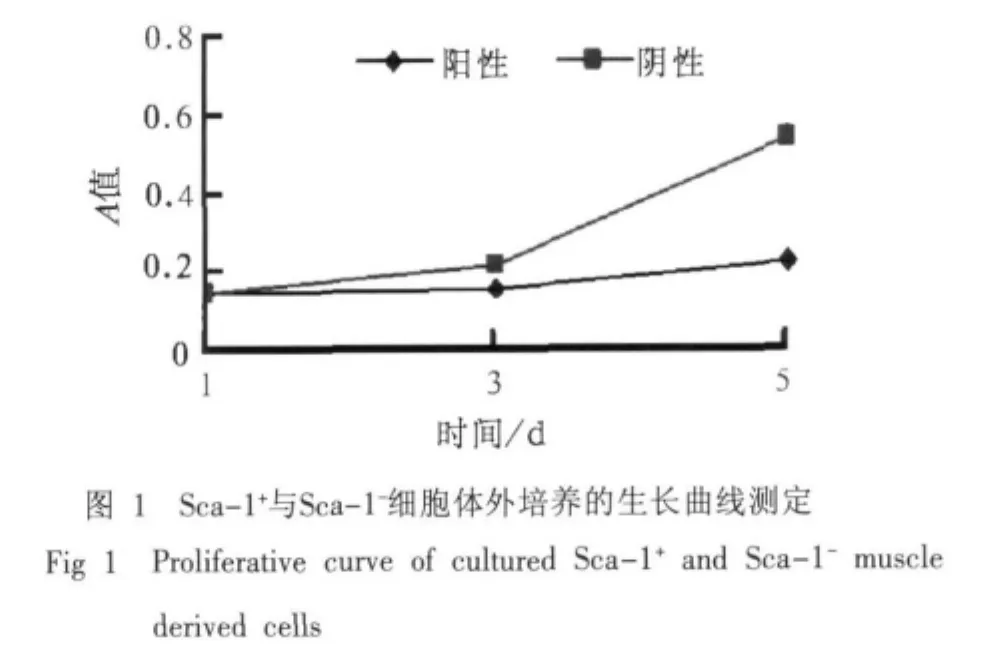
流式细胞仪检测原代细胞中Sca-1的阳性表达率为64.86%,分选后分别进行Sca-1+与Sca-1-细胞的体外培养,经CCK-8试剂盒测定2种细胞的生长曲线见图1。在培养过程中,前3 d Sca-1+与Sca-1-细胞增殖速率没有明显差别,第3天后Sca-1-细胞开始加速增殖。
2.2 Sca-1+与Sca-1-细胞体外培养过程中Sca-1、Myo-D、Myogenin的蛋白表达
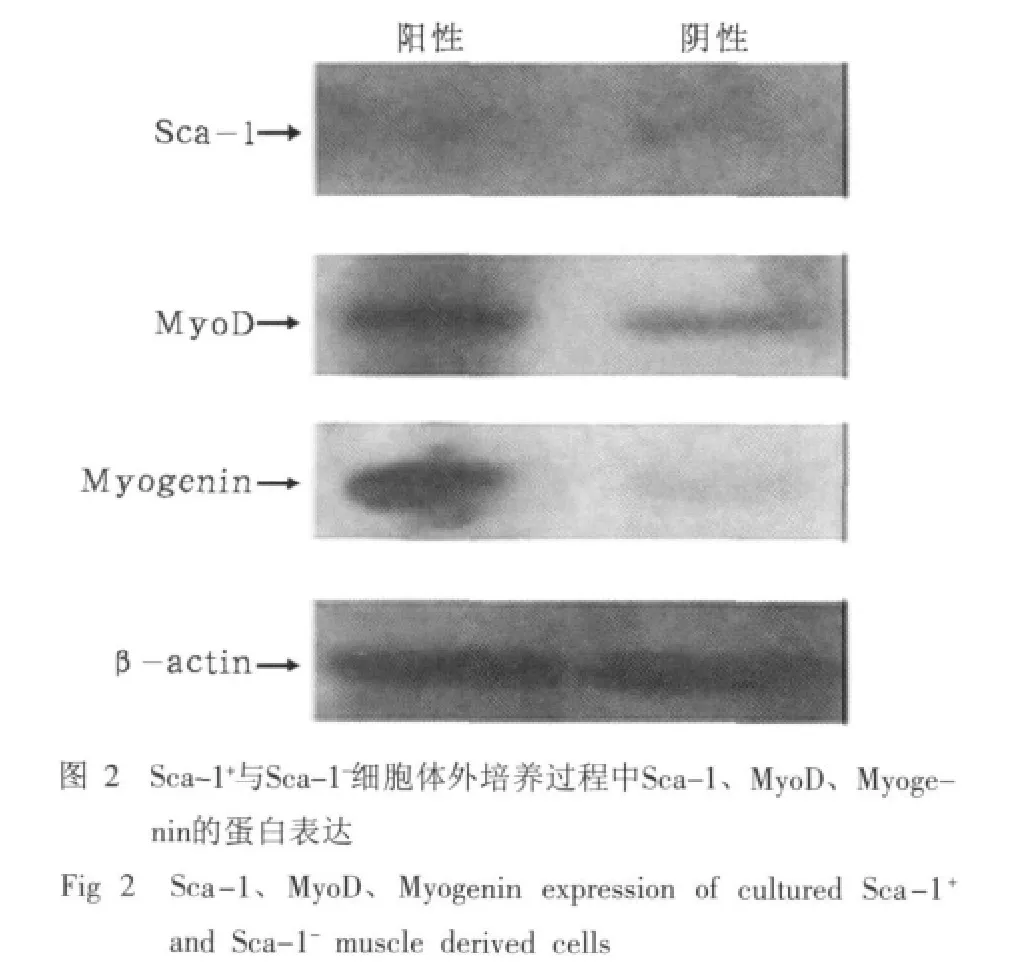
Sca-1+与Sca-1-细胞体外培养过程中Sca-1、Myo-D、Myogenin的蛋白表达结果见图2。由图2可见,Sca-1+与Sca-1-细胞在体外培养过程中Sca-1表达均不明显,Sca-1+细胞比Sca-1-细胞MyoD、Myogenin表达强,说明Sca-1+比Sca-1-细胞在体外培养过程中具有更好的成肌特性。
3 讨论
从不同的组织中都可以分离出具有干细胞特征的Sca-1+细胞[10]。在体外培养骨骼肌来源成肌细胞的过程中发现,Sca-1+与Sca-1-细胞在体外培养5 d的过程中Sca-1均未见明显表达。Jankowski等[11]研究也显示细胞表面蛋白的表达在体外培养过程中会发生变化。随着培养时间的延长,Sca-1表达下降。以Sca-1表达为标记纯化出来的成肌细胞体外培养5 d,Sca-1表达消失。这些结果说明,Sca-1的出现是细胞生长发育过程中一个时段的表达特征,以此作为标记进行干细胞筛选可能会产生一定的局限性。
尽管对于Sca-1在细胞生命活动的作用尚不了解,但是很多实验结果却支持Sca-1的细胞信号功能[12-13]。Sca-1基因沉默小鼠和骨骼肌成肌细胞的实验显示Sca-1在成肌细胞增殖、分化、融合中发挥作用。对于体外培养的C2C12成肌细胞,给予Sca-1抗体阻断,其功能会促进细胞增殖和抑制成肌细胞融合。从体内实验角度来看,分别在Sca-1+和Sca-1-鼠骨骼肌中形成坏死性损伤,Sca-1-成肌细胞出现持续和加速的细胞分裂,表现为高度的增殖反应[14]。本实验体外培养增殖能力的检测结果也说明Sca-1-比Sca-1+细胞具有更强的增殖能力。
Sca-1对于成肌细胞增殖分化的作用可能与对细胞进出细胞周期的影响有关。通过基因芯片实验,学者们发现在成肌细胞早期分化进行过程中,细胞离开细胞循环时,包括DDAH2和Sca-1等几个基因表达特异性上调[12];当细胞开始分化时Sca-1表达出现暂时性升高[14]。有学者认为,成肌调节因子的表达与细胞分裂相排斥[13],MyoD的功能是通过诱导细胞周期蛋白依赖性激酶抑制剂p21[15-16],同时伴随其他Cip1/Kip1家族成员p57和p27,广泛抑制细胞周期蛋白依赖性激酶的活性,从而使细胞停止分裂[17]。Myogenin则在肌肉终末分化时表达[9]。本实验结果显示:Sca-1+比Sca-1-细胞表达更多的MyoD和Myogenin。从以往的研究结果可以推测得出解释:虽然从骨骼肌中分离出来的成肌细胞表达Sca-1,但其中一部分可能是已经走出细胞周期,开始了早期分化细胞,因而直接表达成肌分化蛋白;而Sca-1-成肌细胞表现出的高度增殖反应导致成肌细胞分化延迟。这个结果进一步提示,如果以Sca-1为标记分离出来的细胞可能是还没有进入细胞循环的干细胞,或者是已经进入早期分化阶段的成肌细胞。
[1]Yutoku M,Grossberg AL,Pressman D.A cell surface antigenic determinant present on mouse plasmacytes and only about half of mouse thymocytes[J].J Immunol,1974,112(5):1774-1781.
[2]Stefanová I,HorejsíV,Ansotegui IJ,et al.GPI-anchored cellsurface molecules complexed to protein tyrosine kinases[J].Science,1991,254(5034):1016-1019.
[3]ChargéSB,Rudnicki MA.Cellular and molecular regulation of muscle regeneration[J].Physiol Rev,2004,84(1):209-238.
[4]Dhawan J,Rando TA.Stem cells in postnatal myogenesis:Molecular mechanisms of satellite cell quiescence,activation and replenishment[J].Trends Cell Biol,2005,15(12):666-673.
[5]Lee JY,Qu-Petersen Z,Cao B,et al.Clonal isolation of musclederived cells capable of enhancing muscle regeneration and bone healing[J].J Cell Biol,2000,150(5):1085-1100.
[6]Royer CL,Howell JC,Morrison PR,et al.Muscle-derived CD45-SCA-1+c-kit-progenitor cells give rise to skeletal muscle myotubes in vitro[J].In Vitro Cell Dev Biol Anim,2002,38(9):512-517.
[7]Gussoni E,Soneoka Y,Strickland CD,et al.Dystrophin expression in the mdx mouse restored by stem cell transplantation[J].Nature,1999,401(6751):390-394.
[8]Zhang W,Behringer RR,Olson EN.Inactivation of the myogenic bHLH gene MRF4 results in up-regulation of myogenin and rib anomalies[J].Genes Dev,1995,9(11):1388-1399.
[9]Cornelison DD,Wold BJ.Single-cell analysis of regulatory gene expression in quiescent and activated mouse skeletalmuscle satellite cells[J].Dev Biol,1997,191(2):270-283.
[10]Holmes C,Stanford WL.Concise review:Stem cell antigen-1,Expression,function,and enigma[J].Stem Cells,2007,25(6):1339-1347.
[11]Jankowski RJ,Haluszczak C,Trucco M,et al.Flow cytometric characterization ofmyogenic cell populations obtained via the preplate technique:Potential for rapid isolation of muscle-derived stem cells[J].Hum Gene Ther,2001,12(6):619-628.
[12]Shen X,Collier JM,Hlaing M,et al.Genome-wide examination ofmyoblast cell cycle withdrawal during differentiation[J].Dev Dyn,2003,226(1):128-138.
[13]Smith TH,Block NE,Rhodes SJ,et al.A unique pattern of expression of the four muscle regulatory factor proteins distinguishes somitic from embryonic,fetal and newborn mouse myogenic cells[J].Development,1993,117(3):1125-1133.
[14]Epting CL,López JE,Pedersen A,et al.Stem cell antigen-1 regulates the tempo of muscle repair through effects on proliferation of alpha7 integrin-expressing myoblasts[J].Exp Cell Res,2008,314(5):1125-1135.
[15]Guo K,Wang J,Andrés V,et al.MyoD-induced expression of p21 inhibits cyclin-dependent kinase activity upon myocyte terminal differentiation[J].Mol Cell Biol,1995,15(7):3823-3829.
[16]Halevy O,Novitch BG,Spicer DB,et al.Correlation of terminal cell cycle arrest of skeletalmuscle with induction of p21 by MyoD[J].Science,1995,267(5200):1018-1021.
[17]Sherr CJ,Roberts JM.CDK inhibitors:Positive and negative regulators of G1-phase progression[J].Genes Dev,1999,13(12):1501-1512.
