肾神经在缺血再灌注性肾损伤室旁核电活动变化中的作用
2011-07-16刘希秀冉兵冯志强李达兵余广黄贻泽
刘希秀 冉兵 冯志强 李达兵 余广 黄贻泽
(1.乐清市第三人民医院心血管内科,浙江 乐清325604;2.四川泸州医学院生理教研室,四川 泸州646000)
肾缺血再灌注(Ischemia/reperfusion,I/R)不仅导致肾功能衰竭,也可以引起心、肝、肺、脑等损伤[1],且损伤主要发生在再灌注阶段[2]。室旁核(Paraventricular nucleus,PVN)是肾交感神经的中枢核团[3],刺激肾神经传入纤维能够调节PVN的电活动[4]。肾缺血和I/R时肾神经兴奋性的增强及再灌注损伤产物的增加可引起PVN放电活动呈现快速性的抑制和持续性的增强两种变化。本实验通过保留与去除肾神经,观察肾缺血再灌注过程中室旁核电活动的变化,从而初步探明肾神经在缺血再灌注性肾损伤时室旁核电活动变化中的作用。
1 材料与方法
1.1 动物
SD大鼠(250±30g),雌雄不拘,由泸州医学院动物科提供,动物合格证号:SYXK(川)2008-065。
1.2 方法
SD大鼠随机分为神经组和去神经组,每组10只。以2%的戊巴比妥钠(1mg·kg-1)腹腔注射麻醉,固定于脑立体定位仪上,参照大鼠脑立体定位图谱(George Paxinos,Charles Watson),按 AP:0.50mm~1.80mm,ML:0.40mm~0.60mm,DV:7.60mm~8.00mm,以1mm·min-1的速度将微电极插入PVN,稳定5~10min后开始一段记录正常PVN电活动。神经组:分离好肾神经、肾动脉后,缺血30min后,松开动脉夹实现再灌注30min,观察和记录PVN的放电变化。去肾神经组:手术方法和步骤同上,只是在夹闭肾动脉缺血开始前,先剪断肾神经,然后同步记录观察PVN的放电变化。实验结束后,取出微电极。用1μl的微量注射器抽取0.5μl的甲胺天蓝染色剂沿微电极进入的路线和深度标记电极尖端的位置。根据蓝点位置确定记录部位,记录部位位于PVN内的动物计入资料分析。
1.3 观测指标
实验观测缺血立即、5min、10min、20min及再灌注立即、5min、10min、20min后30s的室旁核放电次数、放电周期、放电频率、放电积分等的变化。
1.4 统计学处理
2 结果
2.1 保留肾神经组
夹闭肾动脉缺血瞬间PVN放电减少甚至消失,约1-2min后放电逐渐增加,5min左右放电次数、放电频率、放电积分等接近于正常PVN的放电水平,随着缺血时间的延长PVN放电逐渐增强,约20min~25min后PVN放电增加达到最强,与缺血前、缺血瞬间、缺血5min、缺血10min相比,差异均具有显著性(P<0.01)。
缺血30min后,松开夹闭肾动脉实现再灌注。再灌注瞬间PVN放电明显减少甚至消失,约1min左右放电开始逐渐增加,5min左右放电次数、放电频率、放电积分等接近于正常PVN的放电水平。随着再灌注时间的延长,PVN放电逐渐增强,约20 min后放电达到最强,与缺血5min、10min、20min及再灌注5 min、10min相比,差异均具显著性(P<0.01)。缺血及缺血再灌注各时间之间放电变化比较见表1、表2、图1和图2。
2.2 去肾神经组
去肾神经组,缺血和再灌注瞬间时室旁核放电频率、振幅、核团放电次数等均未出现保留肾神经时立即减弱或减少的快速性变化。在缺血和再灌注过程中,室旁核放电进行性增加,但变化趋势较缓,缺血再灌注不同时间之间放电变化差异不具有显著性(P>0.05),但5min与20min之间差异具有显著性(P<0.05);且再灌注时室旁核的变化较缺血时变化更明显,差异均具有显著性(P<0.05);与保留神经组比较,去神经组缺血和再灌注时各观察时间点室旁核放电均增强,差异均具有显著性(P<0.05)。见表1、表2、图3和图4。

图1 保留肾神经组缺血前后PVN放电情况的变化

图2 保留肾神经组再灌注前后PVN放电情况的变化

图3 去肾神经组缺血前后PVN放电情况的变化
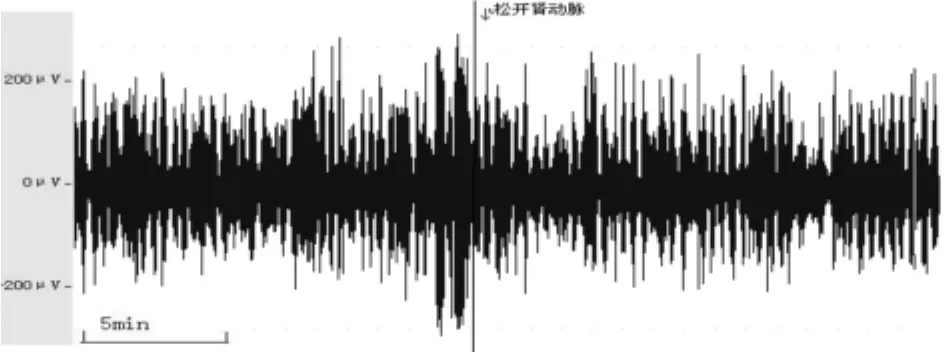
图4 去肾神经组再灌注前后PVN放电情况的变
表1 保留肾神经组和去肾神经组缺血时PVN放电次数、放电周期、放电频率和放电积分的比较(±s,n=10)
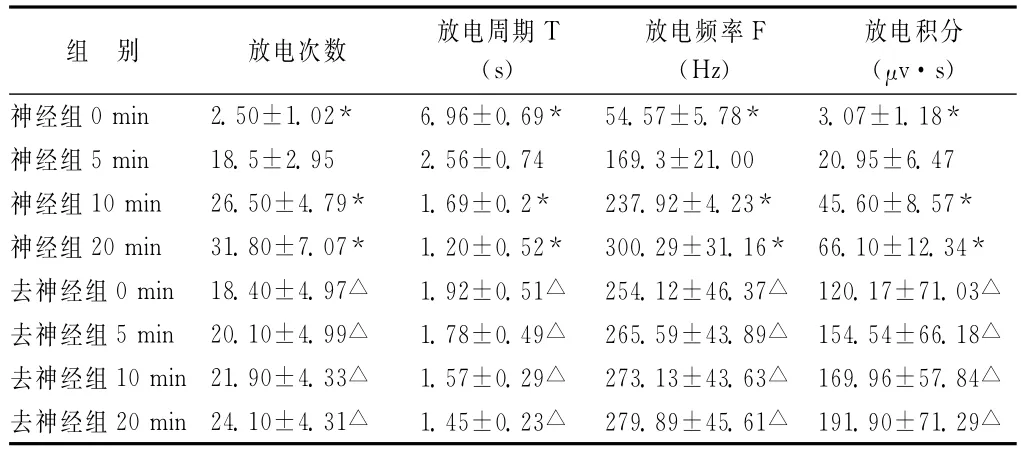
表1 保留肾神经组和去肾神经组缺血时PVN放电次数、放电周期、放电频率和放电积分的比较(±s,n=10)
注:与保留神经组比较,△P<0.05;神经组内不同时间比较,*P<0.05。
组 别 放电次数 放电周期T(s)放电频率F(Hz)放电积分(μv·s)神经组0min 2.50±1.02* 6.96±0.69* 54.57±5.78* 3.07±1.18*神经组5min 18.5±2.95 2.56±0.74 169.3±21.00 20.95±6.47神经组10min 26.50±4.79* 1.69±0.2* 237.92±4.23* 45.60±8.57*神经组20min 31.80±7.07* 1.20±0.52* 300.29±31.16* 66.10±12.34*去神经组0min 18.40±4.97△ 1.92±0.51△ 254.12±46.37△ 120.17±71.03△去神经组5min 20.10±4.99△ 1.78±0.49△ 265.59±43.89△ 154.54±66.18△去神经组10min 21.90±4.33△ 1.57±0.29△ 273.13±43.63△ 169.96±57.84△去神经组20min 24.10±4.31△ 1.45±0.23△ 279.89±45.61△ 191.90±71.29△
3 讨论
肾I/R时肾交感神经兴奋性增加,肾功能在再灌注24h后出现明显降低[5]。肾交感神经兴奋性的增强与缺血、缺氧和血中儿茶酚胺类物质增多、肾组织内腺苷的聚积及尿素氮、肌酐、肌酸、腺苷等代谢产物的增加等因素刺激有关,通过神经通路和血液循环到达PVN,引起PVN电活动的变化。
表2 保留肾神经组和去肾神经组再灌注时PVN放电次数、放电周期、放电频率和放电积分的比较(±s,n=10)

表2 保留肾神经组和去肾神经组再灌注时PVN放电次数、放电周期、放电频率和放电积分的比较(±s,n=10)
注:与保留肾神经组比较,△P<0.05;神经组内不同时间点间比较,*P<0.05。
组 别 放电次数 放电周期T(s)放电频率F(Hz)放电积分(μv·s)神经组0min 2.00±1.10* 4.07±0.72* 57.94±6.65* 2.59±0.80*神经组5min 18.10±2.95 2.24±0.52 177.96±27.39 26.93±5.54神经组10min 29.40±7.01* 1.41±0.26* 269.60±29.38* 55.13±7.33*神经组20min 36.30±11.81* 0.99±0.46* 319.20±31.27* 72.71±7.34*去神经组0min 22.50±3.37△ 1.55±0.28△ 272.21±48.97△ 165.59±63.45△去神经组5min 22.70±4.03△ 1.53±0.21△ 280.94±49.97△ 192.83±63.58△去神经组10min 25.00±3.80△ 1.43±0.21△ 288.8±46.11△ 192.54±65.08△去神经组20min 27.60±3.17△ 1.31±0.16△ 296.66±47.53△ 209.65±65.78△
实验结果表明,肾I/R时,保留肾神经组动物在肾动脉夹闭和松夹再灌时PVN放电活动立即减弱甚至消失,随后放电逐渐增强。而去肾神经组在夹闭肾动脉和再灌注时,均未出现PVN放电立即减弱甚至消失的快速性变化。和保留肾神经组比较,去神经后室旁核放电在缺血和再灌注过程中均更强。这可能与肾缺血和再灌注瞬间,肾内压力突然变化、肾缺血、缺氧等急性应激刺激经肾交感神经传入纤维将信号沿脊髓上传至PVN,抑制PVN兴奋性,出现PVN放电的减少甚至消失。随着缺血再灌注时间的延长,缺血再灌注代谢产物及损伤物质的不断产生和堆积,以及血中儿茶酚胺类物质的大量释放等,刺激PVN引起其电活动逐渐增强,而室旁核-肾交感神经传出系统的抑制机制[6-7]不足以抵抗体液因素对PVN的兴奋作用,最终表现为PVN随缺血再灌注时间的延长兴奋性逐渐增强;去除肾神经后,PVN失去室旁核-肾交感神经传出系统的抑制调节作用,负反馈调节受到影响,因此,缺血和再灌注瞬间未出现保留肾神经时PVN放电立即减弱甚至消失的快速性变化的现象;由于在缺血再灌注的整个过程中只有体液因素及代谢产物和损伤物质对PVN兴奋作用,没有肾交感神经的抑制作用,故去肾神经组PVN电紧张性较保留肾神经组更高。据此推断,肾缺血再灌注过程中室旁核放电活动的快速性变化与肾神经有关,肾神经具有抑制肾缺血再灌注时室旁核紧张性的作用。
1 Lenkei Z,Corvol P,Llorens-Cortes C.The angiotensin receptor subtype AT1Apredominates in rat forebrain areas involved in blood pressure,body fluid homeostasis and neuroendocrine control[J].Brain Res Mol Brain Res,1995,30(1):53-60.
2 Li DP,Chen SR,Pan HL.Angiotensin II stimulates spinally projecting paraventricular neurons through presynaptic disinhibition[J].J Neurosci,2003,23(4):5041-5049.
3 Rahmouni K,Morgan DA.Hypothalamic arcuate nucleus mediates the sympathetic and arterial pressure responses to leptin[J].Hypertension,2007,49(3):647-652.
4 Caverson MM,Cirtello J.Contribution of paraventricular nucleus to afferent renal nerve pressor response[J].Am J Physiol,1998,254(6):R532-543.
5 Kurata H,Fujii T,Tsutsui H,et al.Renopro-tective Effects of l-Carnosine on Ischemia/Reperfusion-Induced renal Injury in Rats[J].J Pharmacol Exp Ther,2006,319(2):640-647.
6 Gilbey MP,Coote JH,Fleetwood-Walker S,et al.The influence of the paraventriculo-spinal pathway,and oxytocin and vasopressin on sympathetic preganglionic neurons[J].Brain Res,1982,251(2):283-290.
7 富维骏,陈建国,侯刚星,等.兔下丘脑室旁核刺激引起的肾交感神经传出活动的抑制[J].生理学报,1989,4(21):111-119.
