紫杉醇对乳腺癌大鼠围手术期血儿茶酚胺及其他指标的影响
2011-07-16李家峰
李家峰 李 越
新辅助化疗的广泛应用提高了肿瘤综合治疗的效果,尤其以乳腺癌最为显著。但新辅助化疗对肿瘤患者围手术期及预后的影响尚无明确定论。笔者以前的研究结果表明,静脉输注环磷酰胺可导致正常大鼠围手术期血浆儿茶酚胺浓度明显升高,这种影响随时间的延长而减弱[1]。为进一步了解新辅助化疗对乳腺癌大鼠模型应激反应的影响,本研究通过对术前接受静脉输注紫杉醇的乳腺癌大鼠的血浆儿茶酚胺(包括肾上腺素和去甲肾上腺素)浓度及部分免疫指标进行测量,以期为新辅助化疗后择期手术时机的选择提供证据。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年健康二级SD大鼠70只,购自北京大学医学部实验动物科学部,雌雄各半,体质量200 g左右,平衡饲养1周。
1.1.2 试剂与仪器 肾上腺素及去甲肾上腺素标准品(美国SIGMA公司),内标物(B):98%的氢溴酸3,4-二羟基苄胺(DHBA)对照品(ALDRICH公司);紫杉醇规格5 mL:30 mg(北京协和药厂)。日本岛津LC-10A高效液相色谱仪,L-ECD-10A电化学检测器,分析之星色谱工作站。
1.2 方法
1.2.1 实验设计 将walker-256肿瘤细胞接种于大鼠左侧腋下,20只大鼠因死亡或未形成满意肿瘤结节而淘汰,采用随机数字表的方法将剩余的50只大鼠随机分为4个实验组(分别为第1、2、3、4组)和1个对照组,每组10只。实验组大鼠通过尾静脉注射紫杉醇(25 μg/g)[2],对照组大鼠输注等量生理盐水。4个实验组分别于注药后第1、2、3及4周末给予水合氯醛(300 μg/g)腹腔注射麻醉,通过内眦静脉取血2 mL备用,手术切除肿物造成外科应激刺激,术后通过股动脉取血5 mL备用,对照组于注药后第1周末实施相同的处理。
1.2.2 指标测定 血浆儿茶酚胺浓度测定采用高压液相色谱法;采用流式细胞仪(Coulter EPICSXL,美国)测定自然杀伤(NK)细胞计数和CD4+/CD8+细胞比值。血肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6测定采用放射免疫法。
1.3 统计学处理 实验数据采用SPSS 13.0软件进行统计学处理,计量资料均以±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1 手术前后各组乳腺癌大鼠血肾上腺素和去甲肾上腺素浓度比较 各组术前和术后肾上腺素浓度差异无统计学意义(P>0.05),第1、2组术前术后去甲肾上腺素浓度均高于对照组,差异有统计学意义(P<0.01),第3、4组术前术后去甲肾上腺素浓度与对照组比较差异无统计学意义(P>0.05),见表1。
2.2 手术前后各组大鼠免疫指标比较 各实验组术前和术后NK值与对照组差异无统计学意义(P>0.05);第1、2组术前和术后CD4+/CD8+均低于对照组,差异有统计学意义,第3组术前CD4+/CD8+低于对照组,差异有统计学意义(P=0.011),见表2。
表1 各组手术前后大鼠肾上腺素和去甲肾上腺素浓度比较 (n=10,μg/L±s)

表1 各组手术前后大鼠肾上腺素和去甲肾上腺素浓度比较 (n=10,μg/L±s)
P值为各组与对照组相比所得;**P<0.01,表2、3同
对照组第1组第2组第3组第4组F术前55.78±14.69 47.03±23.49 65.01±21.85 56.25±9.18 64.80±12.46 1.881术后93.54±12.62 105.50±32.35 95.35±14.67 107.23±24.04 92.96±9.42 1.135术前14.69±2.22 34.21±5.02 58.51±13.14 16.51±6.81 15.51±4.45 66.672**P-<0.001<0.001 0.582 0.803术后30.11±4.12 54.63±16.82 67.84±11.26 24.08±9.05 31.92±4.59 32.832**P-<0.001 0.002 0.197 0.696肾上腺素 去甲肾上腺素组别
表2 各组手术前后大鼠免疫指标比较 (n=10 ±s)
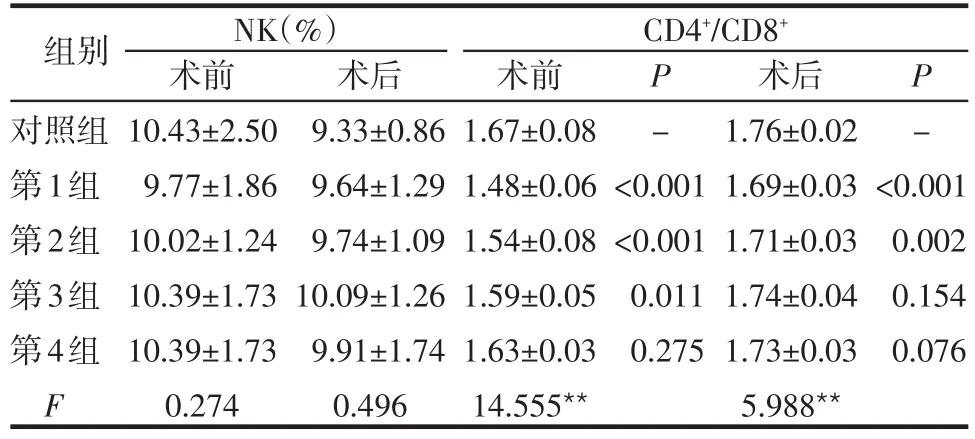
表2 各组手术前后大鼠免疫指标比较 (n=10 ±s)
对照组第1组第2组第3组第4组F术前10.43±2.50 9.77±1.86 10.02±1.24 10.39±1.73 10.39±1.73 0.274术后9.33±0.86 9.64±1.29 9.74±1.09 10.09±1.26 9.91±1.74 0.496术前1.67±0.08 1.48±0.06 1.54±0.08 1.59±0.05 1.63±0.03 14.555**P-<0.001<0.001 0.011 0.275术后1.76±0.02 1.69±0.03 1.71±0.03 1.74±0.04 1.73±0.03 5.988**P-<0.001 0.002 0.154 0.076 NK(%) CD4+/CD8+组别
2.3 手术前后各组大鼠细胞因子水平比较 各实验组术前和术后TNF-α值与对照组差异无统计学意义(P>0.05),第1~3组术前和术后IL-6值均低于对照组,差异有统计学意义(P<0.01),第4组与对照组差异无统计学意义(P>0.05),见表3。
表3 各组手术前后大鼠细胞因子水平比较(n=10,μg/L ±s)

表3 各组手术前后大鼠细胞因子水平比较(n=10,μg/L ±s)
对照组第1组第2组第3组第4组F术前0.806±0.016 0.797±0.015 0.804±0.008 0.804±0.012 0.806±0.010 0.896术后0.815±0.018 0.805±0.009 0.812±0.029 0.808±0.005 0.807±0.009 0.565术前20.57±2.85 13.15±3.37 15.26±2.88 15.67±2.17 19.32±2.09 12.746**P-<0.001<0.001<0.001 0.313术后27.77±2.47 18.86±2.76 19.60±2.97 24.27±2.78 27.68±2.27 25.709**P-<0.001<0.001 0.005 0.935 TNF-α IL-6组别
3 讨论
静脉注射紫杉醇同静脉注射环磷酰胺一样对大鼠是一个强烈而持久的应激性刺激,紫杉醇使血浆去甲肾上腺素浓度升高的时限为2周;由于大鼠受到伤害性刺激时肾上腺素浓度升高的时限较短,在测定时已经恢复至正常水平,因此各组肾上腺素浓度和NK细胞计数没有差异。有研究证实,在创伤性刺激和大量失血导致休克时,内源性儿茶酚胺分泌明显增加;或同时给予外源性肾上腺素或去甲肾上腺素时,血浆儿茶酚胺水平明显升高,全系淋巴细胞下降,其中CD8+下降明显,因此CD4+/CD8+比值加大;脾淋巴细胞的凋亡加速、细胞因子的分泌及脾淋巴细胞的增殖受到抑制,致使NK细胞计数明显增加[3-4]。本研究术前CD4+/CD8+在输注紫杉醇后的3周内均低于对照组,术后第1、2周也低于对照组,且NK细胞计数无明显变化,提示紫杉醇对大鼠免疫系统的抑制依然存在。各组间TNF-α无差异,而各组间IL-6的变化趋势与CD4+/CD8+相近,可能与T细胞受化疗抑制有关。
近年来,免疫系统在应激反应中的作用逐渐被重视。研究表明,免疫系统主要通过IL-1、IL-6及TNF-α等细胞因子和促肾上腺皮质激素等调节神经内分泌系统的活动[5]。外科损伤以及伤害性刺激均可导致机体应激反应,其中交感-肾上腺髓质系统尤为活跃,是创伤首先发生的反应。血浆儿茶酚胺水平的变化是机体应激反应的重要指标之一。研究证实儿茶酚胺是重要的机体免疫调节机制,减少儿茶酚胺的分泌能够减少血管外科术后血栓形成、改善胸外科手术后肺功能、增强围手术期患者的抗感染能力[6]。同时有报道认为组织儿茶酚胺含量长期升高可以促进肿瘤细胞的生长[7]。因此,新辅助化疗后选择合适的手术时机,使机体处于较佳的免疫状态,避免过度的应激反应,对于保证围手术期安全及改善肿瘤预后有重要意义。本研究结果提示紫杉醇作用2周后机体的免疫状态未完全恢复正常,但与外科应激密切相关的儿茶酚胺系统基本恢复正常,因此,此时期为择期手术的较佳时机。
[1]李越,李家峰,查振起,等.静脉输注环磷酰胺对大鼠围手术期血浆儿茶酚胺浓度的影响[J].中华外科杂志,2007,45(16):1136-1138.
[2]黄继汉,黄晓晖,陈志扬,等.药理实验中动物间和动物与人间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[3]Estévez LG,Gradishar WJ.Evidence-based use of neoadjuvant tax⁃ane in operable and inoperable breast cancer[J].Clin Cancer Res,2004,10(10):3249-3261.
[4]Straub RH.Complexity of the bi-directional neuroimmune junction in the spleen[J].Trends Pharmacol Sci,2004,25(12):640-646.
[5]Solomon GF.Psychoneroimmunology:Interactions between central nervous system and immune system[J].J Neurosci Res,1987,18(1):1-9.
[6]Yang EV,Sood AK,Chen M,et al.Norepinephrine up-regulates the expression of vascular endothelial growth factor,matrix metallopro⁃teinase(MMP)-2,and MMP-9 in nasopharyngeal carcinoma tumor cells[J].Cancer Res,2006,66(21):10357-10364.
[7]Thaker PH,Han LY,Kamat AA,et al.Chronic stress promotes tu⁃mor growth and angiogenesis in a mouse model of ovarian carcinoma[J].Nat Med,2006,12(8):939-944.
