猪细小病毒感染Marc-145细胞后对其分泌白细胞介素18转录时相的影响
2011-07-11党玉丽哈斯通拉嘎耿静微王瑞宁郭东辉胡清林魏战勇
党玉丽,哈斯通拉嘎,耿静微,王瑞宁,郭东辉,胡清林,魏战勇
(1.河南农业大学理学院,河南 郑州 450002;2.郑州牧业工程高等专科学校,河南 郑州 450011;3.河南农业大学牧医工程学院,河南 郑州 450002)
猪细小病毒(Porcine parvovirus,PPV)是引起妊娠母猪繁殖障碍的主要病原体之一.初产妊娠母猪感染后,经胎盘侵袭胚胎或胎儿,引起母猪流产、胚胎死亡、胎儿畸形及木乃伊化,致使母猪不孕或反复发情,同时还可引起仔猪的皮炎和腹泻[1].猪细小病毒在猪群中检出率甚高,在猪群中的血清抗体阳性率达50% ~80%[2].炎性细胞因子特别是白细胞介素具有介导天然免疫、调节淋巴细胞活化、生长和分化等免疫调节作用,是目前临床医学、免疫学和肿瘤学等领域的研究热点之一[3].体内白细胞介素的表达发生异常,与机体免疫功能低下或发生病理损伤有关[4].对炎性细胞因子特别是白细胞介素表达量的准确测定、反应机体的免疫状态、揭示疾病的发病机理、探索感染后机体的免疫应答规律均具有重要意义.常用的检测白细胞介素(Interleukin,IL)等细胞因子的方法(放射免疫法,ELISA,MTT法)不同程度上存在灵敏度不高、污染环境、费时、操作复杂和难以准确定量等缺点.实时荧光定量PCR技术以其准确、快速、定量的优点,迅速被应用于功能基因组、分子医学、病毒学、微生物学及生物工艺学等领域[5],也是测定在细胞因子的表达研究方面主要手段之一.本试验利用SYBR Green I实时定量PCR检测方法,分不同时间点定量检测PPV感染Marc-145后IL-18 mRNA的表达水平.为研究IL-18的抗细小病毒机制提供理论参考和试验依据,并为预防控制PPV提供理论支持.
1 材料与方法
1.1 材料
1.1.1 病毒 猪细小病毒7909标准毒株(PPV-7909)购自中国兽药监察所,病毒滴度为 106.1TCID50·mL-1.
1.1.2 细胞Marc-145 细胞为河南省动物性食品安全重点实验室保存,细胞生长于含10%新生犊牛血清的 DMEM培养基中,于体积分数为5%CO2,37℃培养箱中培养.
1.1.3 试剂 Protein K(Promega公司);DMEM培养基(GIBCOBR公司);Trypsin(Invitrogen);胎牛血清(Hyclone公司);E.Z.N.A Total RNA KitⅠ(OMEGA);SYBR®Premix Ex TaqTMⅡ(TaKaRa);RevertAidTMFirst Strand cDNA Synthesis Kit(MBI Fermentas);其它常规试剂均为分析纯.
1.1.4 仪器 Mastercycle ep realplex Real-Time PCR仪(Eppendorf公司);台式高速低温离心机(德国 Sigma公司);PTC-200型 PCR仪(M J Research公司);紫外凝胶成像系统(美国SIM公司);小型台式离心机(德国Sigma公司).
1.2 病毒感染
将Marc-145细胞用胰酶溶液分散后,培养于6孔培养板(2×105个·孔-1),培养细胞丰度达80%后,用PBS洗2次,将PPV接种于Marc-145细胞,吸附60 min,每隔15 min轻轻晃动1次,洗去未吸附的病毒,添加含有体积分数为2%胎牛血清的DMEM维持液.
1.3 细胞的收集
将病毒感染后 1,3,24,48 h的细胞分别用PBS洗2次,添加0.25%胰酶消化细胞,1 000×g离心10 min收集Marc-145细胞,保存于-80℃备用.
1.4 DNA及RNA的提取和反转录
按蛋白酶K法提取病毒DNA,参照E.Z.N.A Total RNA KitⅠ说明书提取细胞总RNA,具体方法和步骤参照文献[6]进行,以提取的总RNA为模板进行反转录,反转录合成的cDNA及提取的DNA作为荧光定量PCR模板.
1.5 引物和相对定量PCR
引物的设计使用Primer Premier 5.0软件,参照GenBank公布序列进行(表1).荧光定量PCR反应体系为 20 μL.其中,SYBR Premix Ex Taq 10 μL,上、下游引物各 0.4 μL,cDNA 600 ng.反应条件为:95℃,1 min;95℃,10 s;57℃,15 s;72℃,15 s,共进行40个循环,循环结束后升温至95℃,15 s,再降至60℃,15 s,开始从60℃递增至95℃,20 min,采集荧光信号得出扩增产物的溶解曲线,于95℃,15 s结束反应.
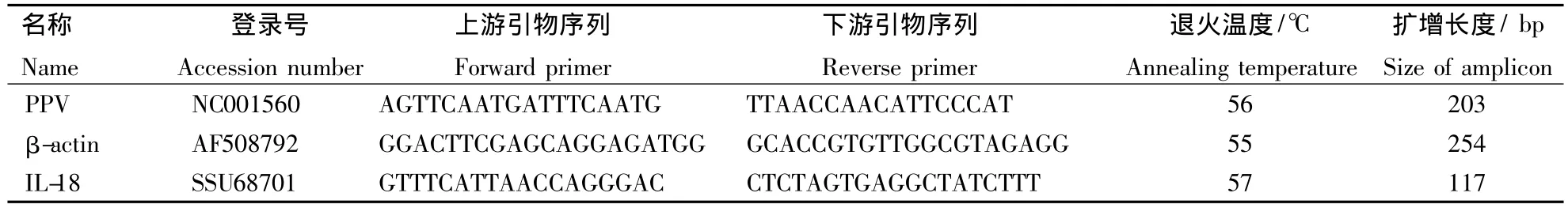
表1 Real-time PCR引物及其反应条件Table 1 Primers and conditions used for Real-time PCR assays
1.6 数据处理
在实时定量PCR中,Ct值是反映模板中目标基因含量的重要指标,通过样品和标准曲线Ct值比较,可以准确计算出RNA含量.另外,将目标基因与持家基因β-actin比较,消除由于收集细胞、反转录和加样中操作误差.将0 h未接种病毒的细胞因子的表达量设为1倍,使用Mastercycle ep realplex Real-Time PCR软件分析各基因相对于0 h的表达量变化水平.
2 结果与分析
2.1 PPV DNA水平测定
Marc-145 单层细胞感染 PPV 后,在1,3,24,48 h分别收集细胞,提取DNA,做荧光定量PCR,与β-actin进行比较分析,并将病毒感染1 h时病毒DNA含量定义为1倍,得出不同时间病毒DNA在细胞的增殖倍数(图1).

图1 PPV在Marc-145细胞中增殖规律Fig.1 The replication of PPV in Marc-145 cell
由图1可知,病毒感染后1 h就可以检测到病毒DNA,但病毒量相对较低;随后开始逐步上升,在感染后24 h病毒开始大量迅速增殖,48 h达到最高峰,从感染后24 h的13倍增殖到170倍.
2.2 细胞因子的测定
Marc-145单层细胞在感染 PPV 后 1,3,24,48 h分别收集细胞,提取RNA,反转录获得cDNA,做荧光定量PCR,并与β-actin进行比较分析,并以病毒感染0 h时mRNA含量定义为1倍,得出不同时间细胞因子RNA在细胞的增殖倍数(图2).
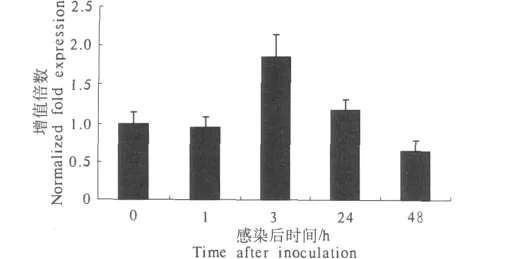
图2 白细胞介素18的转录时相Fig.2 The transcriptional profiles of interleukin-18
由图2可知,IL-18的表达量在1 h无明显变化,3,24 h增加,48 h轻微下降低于细胞对照水平.
3 讨论
1)实时荧光定量PCR技术不仅实现了PCR从定性到定量检测的飞跃,而且所有反应均在同一溶液中进行,不需任何后处理过程,具有特异性更强、有效解决PCR污染问题、自动化程度高、能实现多重反应、定量结果具实时性和准确性等特点[7].目前在不同的研究领域得到广泛的应用.PPV可以在ST,PK-15,Marc-45等多种细胞中增殖并引起细胞病变.本研究发现在PPV感染Marc-145细胞后1 h能检测到病毒,24 h后开始大量增殖,在感染后48 h达最高峰,达到170倍,这可能是由于病毒大量增殖,释放所致.
2)IL-18是一种高活性、多功能的生物活性糖蛋白,不仅可刺激Thl细胞高水平诱生IFN-γ,GMCSF,IL-2等细胞因子,而且可以直接激活IFN-γ的启动子,其诱导IFN-γ产生的能力比IL-12还强很多,促进免疫细胞表达FasL,增强FasL介导的细胞毒作用,促进T细胞的增殖,显著增强Thl细胞和NK细胞的细胞毒作用等免疫调节功能[8].此外,IL-18具有抗病毒、抗结核分支杆菌、抗真菌、抗肿瘤免疫、抗变态反应性疾病作用及前炎因子活性,提高机体的细胞免疫水平,达到预防和控制微生物感染、抑制肿瘤发生的目的[9].本研究发现,PPV感染Marc-145细胞后IL-18的表达量在3,24 h增加,48 h轻微下调.LIU等[10]发现 IL-18在宿主防御系统对抗流感病毒感染试验中,IL-18参与抑制流感病毒复制,尤其是在感染早期阶段激活NK活性,并增强NK细胞的细胞毒作用.表明IL-18可能在Marc-145细胞防御和抵抗PPV感染过程中起重要作用,PPV感染Marc-14初期能够引起细胞炎性反应,而当病毒大量增殖后又能够抑制细胞炎性反应、抑制NK等免疫细胞活性.
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:1148-1182.
[2]LETCHWORTH G J,RODRIGUEZ L L,DELCBARRERA J.Vesicular stomatitis[J].Veterinary Journal,1999,157(3):239-260.
[3]SKJOLAAS K A,GRIEGER D M,HILL C M,et al.Glucocorticoid regulation of type 1 and type 2 cytokines in cultured porcine splenocytes[J].Vet Immunol Immunopathol,2002,87:79 -87.
[4]RIFFO-VASQUEZ Y,SPINA D.Role of cytokines and chemokines in bronchial hyperresponsiveness and airway inflammation[J].Pharmacology & Therapeutics,2002,94(3):185-211.
[5]KLEIN D.Quantification using real-time PCR technology:applications and limitations[J].Trends Mol Med,2002,8(6):257-260.
[6]李厚伟,魏战勇,尹海燕,等.猪细小病毒感染PK-15细胞抗病毒相关因子转录变化的分析[J].畜牧兽医学报,2011,42(1):48-55.
[7]KE L D,CHEN Z,YUNG W K.A reliability test of standard-based quantitative PCR:exogenous vs endogenous standards[J].Mol Cell Probes,2000,14(2):127 -135.
[8]孙文长.自细胞介素18研究进展[J].国外医学:临床生物化学与检验学分册,2000,21(2):57-59.
[9]郑兰兰,贾云飞,崔保安,等.猪白细胞介素18基因的克隆、表达及生物学活性检测[J].生物工程学报,2008,24(2):214-219.
[10]LIU B,MORI I,HOSSAIN M J,et al.Interleukin-18 improves the early defence system against influenza virus infection by augmenting natural killer cell-mediated cytotoxicity[J].J Gen Virol,2004,85(2):423 -428.
