致敏肾移植受者同种异体抗体产生的机制
2011-07-09何群鹏综述季曙明审校
何群鹏 综述 季曙明 审校
肾移植是终末期肾脏病患者最佳的治疗方法之一,然而肾移植术后,尤其早期移植肾存活率一直是人们关注的重点。通常认为 T 细胞介导的损伤是移植物排斥反应的主要原因,因此大多移数免疫抑制治疗都是针对T 细胞的,这种治疗的确降低了急性细胞性排斥反应的发生率,但体液免疫反应即同种异体抗体介导的排斥反应却日益凸显[1]。尤其体内存在高水平的供者特异性抗体(DSA)的致敏受者接受肾移植后早期体液性排斥反应发生率高、移植物长期存活率低。因此,探讨同种异体抗体在移植前后各时期的产生机制,对改进免疫抑制治疗方案、提高移植肾长期存活率至关重要。本文就同种异体抗体在致敏肾移植受者中的产生机制作一简要综述。
特异性B细胞活化路径
骨髓的多能造血干细胞能持续产生各种B细胞。B细胞在外周淋巴细胞器官的非胸腺依赖区栖居和增生,获得抗原刺激后分化成浆细胞和记忆性B细胞。浆细胞产生DSA,发挥体液免疫作用,记忆性B细胞寿命很长,可存活100d以上,且保持特异性,当它们再次接触同样特异性的抗原时,便能迅速被激活,成为特异性B淋巴母细胞(图1、2)[2, 3]。
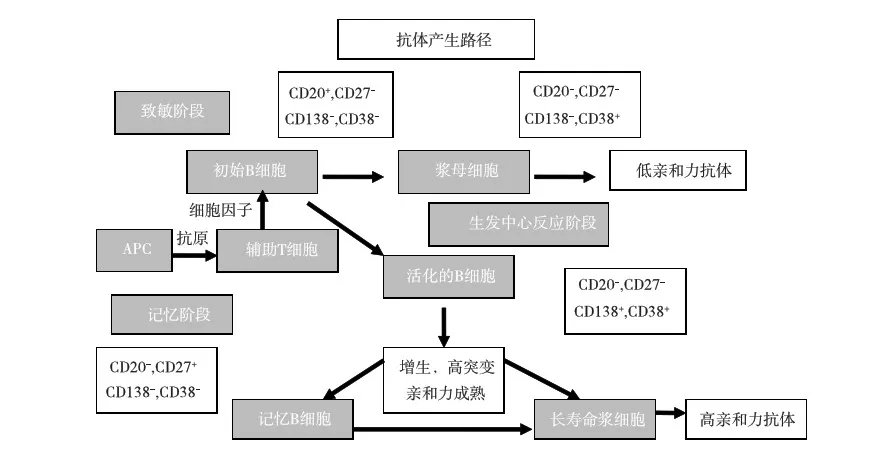
图1 B2淋巴细胞成熟过程
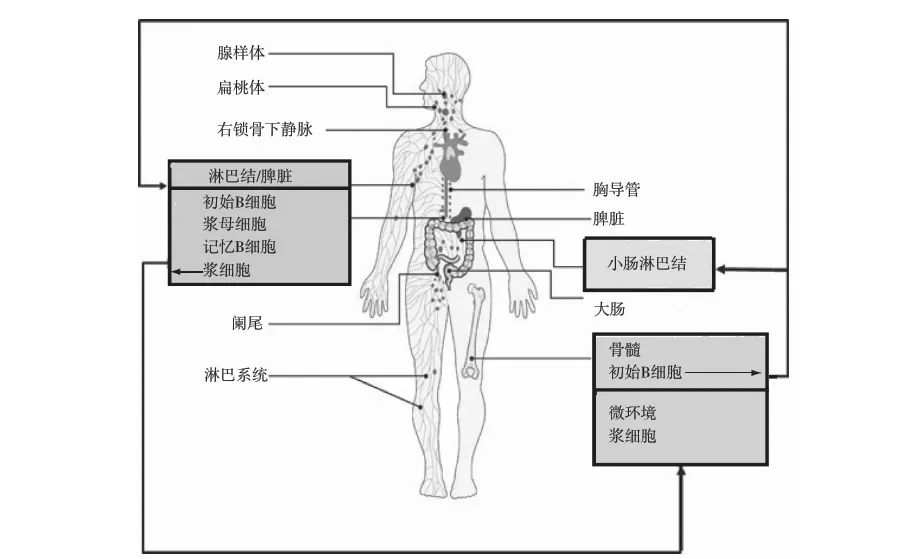
图2 B2淋巴细胞迁移过程
按照成熟B细胞表面是否表达CD5分子将其分为B1(CD5+)和B2(CD5-)两个亚群。前者可视为参与非特异性免疫或先天性免疫的一种细胞,后者则是通常意义上的B细胞,主要介导特异性免疫中的体液免疫。B1细胞的表面标记为mIgM和CD5,分布于腹腔、胸腔和肠壁固有层中,介导体液免疫应答无需辅助性T细胞(Th)的参与,不发生免疫球蛋白的类型转换,合成与分泌的低亲和力IgM能与多种不同的抗原表位结合,表现为多反应性。B2细胞表面同时表达mIgM和mIgD,产生抗体参与体液免疫。B细胞除能够产生抗体外,还有抗原递呈和免疫调节作用[4]。
B细胞发育成熟后其表面标记物可发生变化(图1),如CD19和CD20在未活化的B细胞上高表达,浆细胞低表达。B细胞表型与其成熟状态或功能并不总是相关的,例如CD20并不是表达在所有的记忆B细胞上,也不是反应B细胞成熟状态的特异性标志物。记忆B细胞是一组异质性细胞群体,既不分泌抗体也不是分化终端,除表达CD20外还表达CD27。近期有研究表明记忆细胞表面标志物具有多样性[5,6]。在接触抗原数小时后,记忆B细胞活化为浆母细胞,然后分化为能分泌抗体的浆细胞。记忆B细胞向浆细胞转化过程中有T细胞辅助作用,但其作用机制尚不明确。如非抗原特异性刺激物如CpG寡核苷酸和Toll样受体可能促使记忆B细胞向浆细胞转化,而不依赖辅助T细胞[7,8]。浆细胞在外周血中稀少,B细胞占外周血淋巴细胞的40%~60%。记忆B细胞表达经典的标记物CD27,转化间期的记忆B细胞同时也表达CD19和CD38,这些表型表明这些细胞可能向浆细胞转化。
浆细胞是能持续分泌抗体的细胞,占所有骨髓细胞的0.5%,外周血细胞的0.05%[2]。大多数浆细胞表达CD138和CD38,非活化的B细胞则不表达。关于浆细胞寿命及在特定条件下抗体产生的机制尚有争议[9,10]。目前有三种观点:(1)大多数浆细胞来源于抗原激活的记忆B细胞,寿命短(数天到数月);(2)浆细胞来源于记忆B细胞,寿命较长;(3)浆细胞寿命较长,但不依赖于记忆B细胞。一项关于注射疫苗后长期体液免疫反应的研究支持浆细胞寿命长的假说[11]。疫苗诱导的抗体寿命较长,估计抗破伤风抗体半衰期11年,风疹和腮腺炎病毒抗体可持续存在。在这些研究中,骨髓中抗原特异性浆细胞产生相应的抗体,但外周血记忆B细胞产生抗体较少,因此体液免疫的维持有赖于长寿命的浆细胞而不是持续性的记忆B细胞转化的浆细胞。
致敏受者移植前同种异体抗体产生机制
数年内致敏人群体内持续产生抗体,且抗体的血清浓度及特异性没有显著变化。近期研究发现致敏人群中骨髓来源的CD138细胞占浆细胞的10%~25%,能产生同种异体抗体[12]。因此,骨髓中的浆细胞可能是抗体的主要来源。研究也发现能产生针对HLA抗体的浆细胞很少,占骨髓细胞的1/2×106。这一研究说明同种异体抗体的产生并不来自外周血细胞,也证明外周血中抗体分泌细胞很少。没有研究表明脾和淋巴结存在同种异体抗体分泌细胞,但是这些次级淋巴组织可以辅助抗体产生。
如果体内浆细胞能持续产生同种异体抗体,那么传统的免疫抑制剂对体内抗体产生的作用很有限,目前的临床研究都支持这一假说。因此我们应进一步探讨联合应用三种药物抑制抗体的产生。
Zand等[13]的研究显示抗胸腺细胞球蛋白包含针对CD138和CD38(浆细胞表面标志物)的抗体,其能促使浆细胞凋亡。也有研究显示抗胸腺细胞球蛋白并不能清除肾移植受者脾脏内的浆细胞[14]。另项研究显示抗胸腺细胞球蛋白对骨髓来源的浆细胞无效,移植前大剂量应用不能使患者脱敏[12]。针对这些研究的解释是活化的浆细胞在体内能抵抗抗体介导的凋亡;近期的一项研究显示抗胸腺细胞球蛋白体外实验中并不能使骨髓来源的CD138细胞凋亡[15]。
Jordan等[16]体外研究表明静脉应用大剂量免疫球蛋白(IVIG)有脱敏作用;治疗组对等待肾移植的高敏患者给予每月一次IVIG,抗体平均下降20%,停止治疗后抗体水平返回基线值,说明单用IVIG并不能长期抑制抗体产生。此外,近期两项体外实验也未能证实IVIG能抑制同种异体抗体的产生[15]或减少体内浆细胞数目[14]。大剂量IVIG在脱敏治疗中的作用机制仍未明确,其在体外实验中能抑制细胞毒性交叉配对实验,说明它能封闭抗体。事实上,IVIG在自身免疫反应中抗炎症的主要机制是通过诱导B细胞表面抑制性Fcγ受体的表达,从而抑制B细胞的活性[17],这种机制在脱敏治疗中是否同样有效有待进一步研究。
抗CD20抗体(利妥昔单抗)抑制同种异体抗体产生的机制也不明确。Viera等[18]对9例肾功能衰竭的高敏患者给予单剂量的利妥昔单抗,部分患者可以看到同种异体抗体水平的改变,但总体影响较小,仅1例患者能接受移植。Genberg等[19]给予29例ABO血型不相容的肾移植受者单剂利妥昔单抗后,88%的患者外周血、腹股沟淋巴结及移植肾内的CD20、CD79阳性细胞减少。随访至10.5个月时,治疗组患者平均血清免疫球蛋白水平没有变化,但血清IgG能降至正常水平的50%,1例患者长期存在低丙种球蛋白血症。另外两项研究显示利妥昔单抗在体外不能阻断骨髓来源的浆细胞产生抗体[15],也不能清除肾移植受者脾脏来源的浆细胞[14]。由于浆细胞不表达CD20,利妥昔单抗对长寿命浆细胞无效。然而,对于部分患者有快速转化的浆细胞(CD20+细胞),包括初始B细胞或记忆B细胞可能有效。因此,利妥昔单抗对同种异体抗体作用的机制可能是作用于CD20+细胞,但其有效性还需大型对照研究。
上述研究尚没有一种免疫抑制剂能用于脱敏治疗或抑制浆细胞产生同种异体抗体,但仍有一些新的药物可以尝试。例如,蛋白酶体抑制剂——硼替佐米,原用于治疗多发性骨髓瘤,研究发现能减少狼疮小鼠正常浆细胞数[20],在体外实验中能促使人类正常浆细胞的凋亡从而封闭自身抗体的产生[15]。
移植后早期抗体的产生和急性体液性排斥反应(AHR)
存在高水平的DSA的患者与供者的交叉配型实验呈阳性的肾移植称为“+XMKTx”。在没有任何新抗体产生的情况下,高水平的预存异体抗体就能导致超急性排斥反应的发生。脱敏治疗的主要目的之一是移植前用大剂量的IVIG和(或)血浆置换有效减少抗体水平,从而预防超急性排斥反应的发生。
移植后AHR的患者DSA水平增加,这可能与记忆B细胞反应有关。根据这一推断,如果能阻断或清除记忆B细胞则能预防AHR的发生。DSA水平的升高通常都是短暂的,大多数交叉配型阳性的肾移植受者移植4d后DSA水平明显下降,28d后会降至移植前水平或更低。这提示AHR的反应是自限性的,AHR期间高水平DSA不会持续存在[21]。传统的免疫抑制及脱敏治疗方案对抑制浆细胞分泌抗体的作用很弱[12]。
AHR时DSA水平在升高之前会有一过性减少,提示移植物可能吸收DSA[22]。没有发生AHR的移植物可能是因为能有效地吸收抗体。AHR可导致内皮细胞损伤,降低移植肾灌注,这时血清DSA水平显著增加。因此高水平的DSA并不是AHR的起因,而是AHR的结果。
移植后同种异体抗体产生的机制目前仍不明确。非移植研究的数据显示浆细胞产生基线水平以上的抗体数量有限[23]。初始B细胞也能导致抗体的产生。因此,记忆B细胞向浆细胞转换是对AHR时同种异体抗体产生的最可能的解释。
Han等[24]证明从致敏患者体内分离出的CD27+细胞能刺激同种异体抗体的产生,提示同种异体特异性记忆B细胞的存在。Mulder[25]和Zachary等[26]使用特异性的HLA分离出表达同种异体抗体的B细胞,研究显示这些细胞在体外能被激活产生同种异体抗体。
许多研究表明“+XMKTx”后DSA水平减少[27],提示记忆B细胞最初转化成短寿命浆细胞。新形成的浆细胞产生抗体持续减少可能是因为不能转变成长寿命浆细胞的缘故。因此,脾切除或利妥昔单抗治疗AHR可能有效[28-30]。
抗胸腺细胞球蛋白,IVIG和利妥昔单抗对记忆B细胞的作用也不明确。体内试验中这些药物不能减少脾脏中CD27细胞数。如果CD20+记忆B细胞在AHR中起着重要作用,利妥昔单抗在AHR预防中可能有作用。然而,不是所有的记忆B细胞都表达CD20,且CD20+细胞不分泌抗体而且它们在同种异体移植物中的存在并不意味着它们是同种异体抗体产生的根源。在“+XMKTx”受者中研究发现利妥昔单抗与血浆置换治疗组相比,AHR的发生率没有差异[31]。
移植后晚期同种异体抗体的产生
“+XMKTx”1个月后,同种异体抗体产生迅速增加并不常见。Zachary等[32]报道“+XMKTx”后1年仅有11%的DSA保留。晚期DSA水平减少的机制尚不明确,可能是多因素的,包括长寿命浆细胞的减少,异体移植物DSA的吸收或阻断因子的存在如抗独特型抗体[33]。
目前尚没有关于“+XMKTx”后浆细胞或B细胞存在机制的研究。移植后DSA的存在是一个有争议的问题。一些研究显示同种异体抗体的存在与移植肾肾小球病相关,能降低移植物存活期[34]。Lee等[35]已证实所有的晚期移植肾失功与同种异体抗体相关。大多数“+XMKTx”后的患者很少会有高水平的抗体存在,移植肾存活期较长。然而,这些患者长期预后与传统的肾移植患者相比还是较差。
同种异体抗体产生机制尚存的临床问题
研究证实切除慢性排斥反应的移植物会使异体抗体水平升高,可能是因为移植物不再吸收抗体[36],也可能是因为停用免疫抑制剂后抗体产生增加或切除的肾脏释放抗原刺激抗体产生。另一种可能的假说是移植物切除后,抗原刺激清除,抗体产生减少,DSA减少。但是尚缺乏这一方面的详细研究。
脾切除术在减少同种异体抗体产生方面的作用尚不明确。虽然脾脏内存在浆细胞,但没有研究能证实脾脏能产生异体抗体。近期的一项研究显示脾切除后远期DSA水平并没有显著的变化[27]。脾切除的患者骨髓和其他淋巴组织中仍有大量的浆细胞维持高水平的异体抗体产生。然而,这一领域仍有许多临床问题,需要大型对照研究明确脾切除在异体抗体产生方面的作用。
传统的免疫抑制剂在“+XMKTx”患者抗体产生中的作用仍不清楚。如上所述这些药物对浆细胞基线值影响不大,因此在脱敏治疗中无效。然而,神经钙蛋白抑制剂和直接针对T细胞的抗体在非致敏患者中能显著减少T细胞介导的同种异体抗体的产生。抗T细胞免疫抑制治疗对记忆B细胞和同种异体抗体持续产生方面的作用仍不清楚。
小结:致敏肾移植受者同种异体抗体的产生主要是由终末分化的长寿命浆细胞在骨髓和其他次级淋巴组织中产生,外周血中B细胞不是移植前同种异体抗体产生的根源。记忆B细胞在同种异体抗体持续产生中有重要意义,尤其是CD20+细胞。移植后受者对同种异体抗原并不全都发生记忆反应,仅一半之内的致敏受者有同种异体抗体水平增加。移植后最初几周内高水平的同种异体抗体产生会导致AHR的发生,说明AHR的发生可能是由于记忆B细胞的激活。移植后晚期DSA消失的原因可能包括预存浆细胞的消失。DSA被移植物吸收或血清存在阻断因子等。在“+XMKTx”移植后各个时期,有证据表明利妥昔单抗和IVIG等药物并不能显著降低浆细胞基线水平。大剂量的IVIG、抗补体C5抗体或阻断其他的下游因子可能改善“+XMKTx”患者的预后。明确移植后不同时期同种异体抗体产生的机制,有助于我们设计更好的治疗方案,改善致敏受者移植术后的预后。
1 Cecka JM,Zhang Q,Reed EF.Preformed cytotoxic antibodies in potential allograft recipients:recent data.Hum Immunol,2005,66(4):343-349.
2 Fairfax KA,Kallies A,Nutt SL,et al.Plasma cell development:from B-cell subsets to long-term survival niches.Semin Immunol,2008,20(1):49-58.
3 Stegall MD,Dean PG,Gloor J.Mechanisms of alloantibody production in sensitized ranal allograft recipients.Am J Transplant,2009,9(5):998-1005.
4 Hardy RR,Hayakawa K.B cell development pathways.Annu Rev Immunol,2001,19:595-621.
5 Sanz I,Wei C,Lee FE,et al.Phenotypic and functional heterogeneity of human memory B cells.Semin Immunol,2008,20(1):67-82.
6 Agematsu K,Hokibara S,Nagumo H,et al.CD27+:a memory B cell marker.Immunol Today,2000,21(5):204-206.
7 Lanzavecchia A.One out of five peripheral blood B lymphocytes is activated to high-rate Ig production by human alloreactive T cell clones.Eur J Immunol,1983,13(10):820-824.
8 Poltorak A,He X,Smirnova I,et al.Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice:mutations in Tlr4 gene.Science,1998,282(5396):2085-2088.
9 Ravetch JV,Nussenzweig M.Killing some to make way for others.Nat Immunol,2007,8(4).337-339.
10 Bernasconi NL,Traggiai E,Lanzavecchia A.Maintenance of serological memory by polyclonal activation of human memory B cells.Science,2002,298(5601):2199-2202.
11 Amanna IJ,Carlson NE,Slifka MK.Duration of humoral immunity to common viral and vaccine antigens.N Engl J Med,2007,357(19):1903-1915.
12 Perry DK,Pollinger HS,Burns JM,et al.Two novel assays of alloantibody-secreting cells demonstrating resistance to desensitization with IVIG and rATG.Am J Transplant,2008,8(1):133-143.
13 Zand MS,Vo T,Huggins J,et al.Polyclonal rabbit antithymocyte globulin triggers B-cell and plasma cell apoptosis by multiple pathways.Transplantation,2005,79(11):1507-1515.
14 Ramos EJ,Pollinger HS,Stegall MD,et al.The effect of desensitization protocols on human splenic B-cell populations in vivo.Am J Transplant,2007,7(2):402-407.
15 Perry DK,Burns JM,Pollinger HS,et al.Proteasome inhibition causes apoptosis of normal human plasma cells preventing alloantibody production.Am J Transplant,2009,9(1):201-209.
16 Jordan SC,Tyan D,Stablein D,et al.Evaluation of intravenous immunoglobulin as an agent to lower allosensitization and improve transplantation in highly sensitized adult patients with end-stage renal disease:report of the NIH IG02 trial.J Am Soc Nephrol,2004,15(12):3256-3262.
17 Nimmerjahn F,Ravetch JV.The antiinflammatory activity of IgG:the intravenous IgG paradox.J Exp Med,2007,204(1):11-15.
18 Vieira CA,Agarwal A,Book BK,et al.Ritixumab for reduction of anti-HLA antibodies in patients awaiting renal transplantation:1.Safety.pharmacodynamics and pharmacokinetics.Transplantation,2004,77(4):542-548.
19 Genberg H,Hansson A,Wernerson A,et al.Pharmacodynamics of rituximab in kidney allotransplantation.Am J Transplant,2006,6(10):2418-2428.
20 Neubert K,Meister S,Moser K,et al.The proteasome inhibitor bortezomib depletes plasma cells and protects mice with lupus-like disease from nephritis.Nat Med,2008,14(7):748-755.
21 Fairfax KA,Kallies A,Nutt SL,et al.Plasma cell development:from B-cell subsets to long-term survival niches.Semin Immunol,2008,20(1):49-58.
22 Adeyi OA,Girnita AL,Howe J,et al.Serum analysis after transplant nephrectomy reveals restricted antibody specificity patterns against structurally defined HLA class I mismatches.Transpl Immunol,2005,14(1):53-62.
23 Ellyard JI,Avery DT,Phan TG,et al.Antigen-selected.immunoglobulin-secreting cells persist in human spleen and bone marrow.Blood,2004,103(10):3805-3812.
24 Han M,Rogers JA,Lavingia B,et al.Peripheral blood B cells producing donor-specific HLA antibodies in vitro.Hum Immunol,2009,70(1):29-34.
25 Mulder A,Eijsink C,Kardol MJ,et al.Identification.isolation and culture of HLA-A2-specific B lymphocytes using MHC class I tetramers.J Immunol,2003,171(12):6599-6603.
26 Zachary AA,Kopchaliiska D,Montgomery RA,et al.HLA-specific B cells:I.A method for their detection.quantification.and isolation using HLA tetramers.Transplantation,2007,83(7):982-988.
27 Burns JM,Cornell LD,Perry DK,et al.Alloantibody levels and acute humoral rejection early after positive crossmatch kidney transplantation.Am J Transplant,2008,8(12):2684-2694.
28 Locke JE,Zachary AA,Haas M,et al.The utility of splenectomy as rescue treatment for severe acute antibody mediated rejection.Am J Transplant,2007,7(4):842-846.
29 Becker YT,Becker BN,Pirsch JD,et al.Rituximab as treatment for refractory kidney transplant rejection.Am J Transplant,2004,4(6):996-1001.
30 Zarkhin V,Li L,Kambham N,et al.A randomized.prospective trial of rituximab for acute rejection in pediatric renal transplantation.Am J Transplant,2008,8(12):2607-2617.
31 Stegall MD,Gloor J,Winters JL,et al.A comparison of plasmapheresis versus high-dose IVIG desensitization in renal allograft recipients with high levels of donor specific alloantibody.Am J Transplant,2006,6(2):346-351.
32 Zachary AA,Montgomery RA,Leffell MS.Factors associated with and predictive of persistence of donor-specific antibody after treatment with plasmapheresis and intravenous immunoglobulin.Hum Immunol,2005,66(4):364-370.
33 Hardy MA,Suciu-Foca N,Reed E,et al.Immunomodulation of kidney and heart transplants by anti-idiotypic antibodies.Ann Surg,1991,214(4):522-528.
34 王庆文.移植肾慢性排斥反应的发病机制和治疗.肾脏病与透析肾移植杂志,2000,9(2):181-185.
35 Lee PC,Terasaki PI,Takemoto SK,et al.All chronic rejection failures of kidney transplants were preceded by the development of HLA antibodies.Transplantation,2002,74(8):1192-1194.
36 Martin L,Guignier F,Mousson C,et al.Detection of donor-specific anti-HLA antibodies with flow cytometry in eluates and sera from renal transplant recipients with chronic allograft nephropathy.Transplantation,2003,76(2):395-400.
